
Volume1
.pdf
408 Часть 2. Основные генетические механизмы
3·109 пар нуклеотидов) изменяется предположительно лишь на 3 нуклеотида при каждом делении клетки. Это позволяет большинству людей передавать точные генетические инструкции от одного поколения другому, равно как и избегать изменений в соматических клетках, которые могли бы привести к раку.
5.2. Механизмы репликации ДНК
Все организмы перед каждым делением клетки должны дублировать свою ДНК с исключительной точностью. В этом параграфе мы исследуем, как замысловатая «репликационная машина» достигает такой точности, причем при скорости удвоения ДНК 1 000 нуклеотидов в секунду.
5.2.1. В основе процессов репликации и репарации ДНК лежит принцип комплементарности оснований
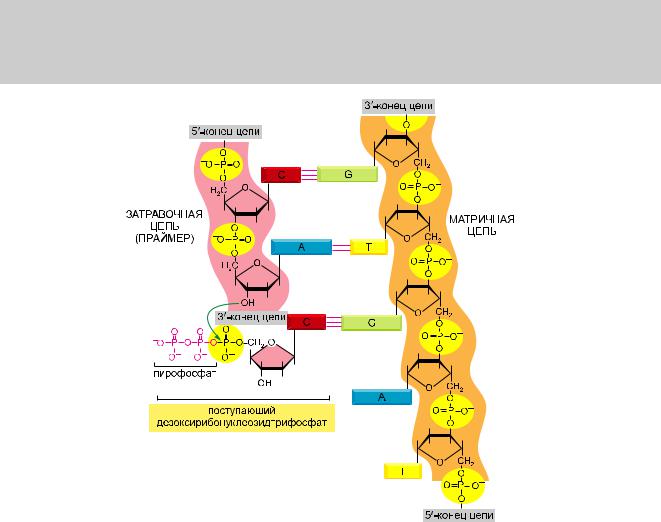
Как уже было упомянуто в главе 1, матричный синтез ДНК — это механизм, используемый клеткой, чтобы копировать нуклеотидную последовательность одной цепи ДНК в комплементарную последовательность ДНК (рис. 5.2). Этот процесс связан с узнаванием каждого нуклеотида матричной нити ДНК (шаблона) свободным (неполимеризованным) комплементарным нуклеотидом, и это требует отделения двух цепей спирали ДНК друг от друга. В результате такого расхождения цепей донорные и акцепторные группы водородных связей, расположенные на образующих ДНК основаниях, становятся доступными для спаривания с соответствующими свободными нуклеотидами, из числа поступивших «в зону проведения работ», — для осуществления катализируемой ферментом полимеризации в новую цепь ДНК.
Первый полимеризующий нуклеотиды фермент, а именно ДНК-полимераза, был открыт в 1957 г. Тогда же было установлено, что свободные нуклеотиды, служащие субстратами для этого фермента, представлены дезоксирибонуклеозидтрифосфатами, а для их полимеризации в ДНК необходима одноцепочечная матрица ДНК. На рис. 5.3 и 5.4 представлен ступенчатый механизм такой реакции.
Рис. 5.2. Двойная спираль ДНК служит матрицей для своей собственной дупликации. Поскольку нуклеотид А спаривается лишь с T, а G — только с C, каждая из цепей ДНК может служить матрицей, определяющейпоследовательностьнуклеотидоввкомплементарнойейнитипутемспариванияоснований. Благодаря такому механизму двухцепочечная молекула ДНК может копироваться с большой точностью.
Глава 5. Репликация, репарация и рекомбинация ДНК 409
Рис. 5.3. Химия синтеза ДНК. Присоединение дезоксирибонуклеотида к 3'-концу полинуклеотидной цепи (затравочная цепь) — основополагающая реакция, посредством которой и синтезируется ДНК. Как показано на рисунке, спаривание оснований между подошедшим к «месту действия» дезоксирибонуклеозидтрифосфатом и существующей цепью ДНК (матричная цепь) определяет формирование новойцепиДНКскомплементарнойнуклеотиднойпоследовательностью.
5.2.2. Репликационная вилка ДНК асимметрична
В ходе репликации ДНК в клетке каждая из двух исходных цепей ДНК служит матрицей для формирования полноразмерной новой цепи. Поскольку каждая из двух «дочерей» делящейся клетки наследует новую двойную спираль ДНК, содержащую одну исходную и одну новую цепи (рис. 5.5), говорят, что двойная спираль ДНК реплицируется ДНК-полимеразой «полуконсервативно». Как же свершается сие таинство?
Исследования, выполненные в начале 1960-х гг. на целых реплицирующихся хромосомах, показали наличие ограниченной зоны репликации, которая поступательно перемещается по двойной спирали родительской ДНК. В силу Y-образной формы этой активной области ее называют репликационной, или репликативной, вилкой (рис. 5.6). В зоне репликационной вилки многоферментный комплекс, который содержит ДНК-полимеразу, синтезирует ДНК обеих новых дочерних нитей.

410 Часть 2. Основные генетические механизмы
Рис.5.4.СинтезДНК,катализируемыйДНК-полимеразой.а)Какпоказанонарисунке,ДНК-полимераза катализируетпошаговоеприсоединениедезоксирибонуклеотидовк3'-OHконцуполинуклеотиднойцепи, такназываемойзатравочнойцепи,котораяспаренасовторой,матричной,цепью.Новосинтезированная нить ДНК поэтому полимеризуется в направлении 5' → 3', как показано на предыдущем рисунке. Посколькукаждыйприбывающийдезоксирибонуклеозидтрифосфатдолженспаритьсясматричнойнитью, чтобы быть опознанным ДНК-полимеразой, то эта нить и определяет, который из четырех возможных дезоксирибонуклеотидов(A,C,GилиT)будетприсоединен.Реакцияосуществляетсязасчетзначительного по величине благоприятного изменения свободной энергии, что обусловлено высвобождением пирофосфата с последующим гидролизом до двух молекул неорганического фосфата. б) Форма моле- кулыДНК-полимеразы,определеннаярентгеноструктурныманализом.Грубоговоря,ДНК-полимеразы напоминаютправуюруку,вкоторойладонь,пальцыибольшойпалец1 «захватывают»ДНКиобразуют активныйучасток(сайт).Визображеннойпоследовательностиправильноерасположениеприбывшегок местудействиядезоксинуклеозидтрифосфатапобуждаетпальцыполимеразысомкнуться,чтоинициирует реакцию присоединения нуклеотида. Диссоциация пирофосфата вызывает размыкание пальцев и перемещение (транслокацию) ДНК на один нуклеотид, так что активный участок полимеразы готов принятьследующийдезоксинуклеозидтрифосфат.
Первоначально простейший механизм репликации ДНК представляли как непрерывное наращивание обеих новых цепей, нуклеотид за нуклеотидом, в репликационной вилке, по мере того как она перемещается от одного конца молекулы ДНК к другому. Но в силу антипараллельной ориентации двух цепей ДНК в двойной спирали (см. рис. 5.2) при таком механизме одна дочерняя нить должна была бы полимеризоваться в направлении 5′ → 3′, а вторая — в направлении 3′ → 5′. Для такой репликационной вилки потребовалось бы два разных типа фермента ДНКполимеразы. Однако все множество ДНК-полимераз, которые открыты к настоящему времени, может осуществлять синтез лишь в направлении 5′ → 3′.
Как же в таком случае наращивается цепь ДНК в направлении 3′ → 5′? Сначала ответ предложили на основании результатов эксперимента, выполненного
вконце 1960-х гг. Исследователи добавили радиоактивный 3H-тимидин к делящимся бактериям на несколько секунд, чтобы радиоактивная метка попала только
вДНК, реплицированную позже всех, то есть находящуюся сразу за репликаци-
1 Оригинальное название — наладонник. — Прим. пер.

Глава 5. Репликация, репарация и рекомбинация ДНК 411
Рис. 5.5. Полуконсервативный характер репликации ДНК.
ВодномциклерепликациикаждаяиздвухцепейДНКиспользуетсявкачествематрицыдляобразованиякомплементарной ейцепиДНК.Поэтомуисходныецепиостаютсянеизменными напротяжениимногихпоколенийклеток.
онной вилкой. Этот эксперимент выявил кратковременно существующие фрагменты ДНК длиной 1 000–2 000 нуклеотидов, которые теперь широко
известны как фрагменты Оказаки, в растущей репликационной вилке. (Позднее, подобные промежуточные продукты репликации были обнаружены и у эукариот, где они имеют длину всего лишь
100–200 нуклеотидов.) Показано, что фрагменты Оказаки полимеризуются только в направлении цепи 5′ → 3′ и присоединяются друг к другу после их синтеза с образованием длинных цепей ДНК.
Репликационная вилка поэтому имеет асимметричную структуру (рис. 5.7). Дочерняя нить ДНК, которая синтезируется непрерывно, известна
как ведущая (лидирующая), или опережающая, цепь. Ее синтез немного опережает синтез дочерней нити, которая синтезируется с перерывами и известна как отстаю- щая, или запаздывающая, цепь. В отстающей нити полимеризация нуклеотидов идет в направлении, встречном общему наращиванию цепи ДНК. Синтез этой нити прерывистым механизмом «обратных стежков» означает, что для репликации ДНК необходима лишь ДНК-полимераза типа 5′ → 3′.
5.2.3. Высокую точность репликации ДНК обеспечивают несколько корректирующих механизмов
Как мы говорили выше, точность копирования ДНК в ходе репликации такова, что на каждые 109 скопированных нуклеотидов возникает не более 1 ошибки. Такая точность намного выше, чем можно было бы ожидать от точности комплементарного спаривания оснований. Стандартные комплементарные пары оснований (см.
рис. 4.4) — не единственно возможные.
Рис. 5.6. Две репликационные вилки, движущиеся впротивоположныхнаправленияхпокольцевойхро-
мосоме.АктивнаязонарепликацииДНКперемещаетсяпоследовательнопореплицируемоймолекулеДНК, создавая Y-образную структуру ДНК, известную как репликационнаявилка:дваплечакаждойY-образной структурысутьдвемолекулыдочернейДНК,а«ножка» Y-образнойструктурыестьспиральродительскойДНК. На этой схеме родительские нити оранжевые; новосинтезированныенитикрасные.(Запредоставленную микрофотографиюмыблагодаримJeromeVinograd.)

412 Часть 2. Основные генетические механизмы
Рис. 5.7. Структура репликационной вилки ДНК. Поскольку обе цепи дочерней ДНК полимеризуются
внаправлении 5' → 3', ДНК, синтезируемая на отстающей нити, должна изначально синтезироваться
ввидерядакороткихмолекулДНК,названныхфрагментамиОказаки.ФрагментыОказакисинтезируютсянаотстающейнитипоследовательно,приэтомчемониближеквилке,тем«новее».
Например, с маленькими изменениями в геометрии спирали между G и T в ДНК могут образовываться две водородные связи. Кроме того, кратковременно возникают редкие таутомерные формы четырех оснований ДНК в отношении 1 на 104 или 105. Такие формы ошибочно образуют пару, не нарушая при этом геометрии спирали: например, редкая таутомерная форма C спаривается не с G, а с А.
Если бы ДНК-полимераза не предпринимала никаких специальных действий, когда происходит ошибочное спаривание между прибывшим дезоксирибонуклеозидтрифосфатом и матрицей ДНК, то в новую цепь ДНК зачастую включался бы неправильный нуклеотид, что приводило бы к частому возникновению мутаций. Однако высокая точность репликации ДНК зависит не только от изначального спаривания оснований, но также и от нескольких «корректирующих» механизмов, которые последовательно работают над исправлением ошибочных пар, периодически возникающих в новом поколении ДНК.
Первый этап коррекции ДНК-полимераза выполняет непосредственно перед тем, как новый нуклеотид присоединяется к наращиваемой цепи. Наши знания об этом механизме получены в ходе исследований нескольких различных ДНК-полимераз, а в их числе и одной производимой бактериальным вирусом T7, который реплицируется в E. coli. Нужный нуклеотид имеет более высокое сродство к движущейся полимеразе, чем неверно выбранный, потому что правильное спаривание благоприятнее
вэнергетическом отношении. Более того, после связывания нуклеотида, но прежде чем нуклеотид ковалентно присоединится к растущей цепи, фермент должен претерпеть конформационное изменение, в результате которого его «пальцы» сжимаются вокруг активного участка (см. рис. 5.4). Поскольку такое изменение легче происходит при правильном, чем при неправильном спаривании оснований, это позволяет полимеразе выполнять «двойную проверку» точной геометрии пары оснований, прежде чем она решится катализировать присоединение нуклеотида к цепи.
Следующая исправляющая ошибки реакция, известная как экзонуклеолити- ческая коррекция (exonucleolytic proofreading), имеет место незамедлительно после тех редких случаев, когда неверный нуклеотид все-таки ковалентно присоединяется к растущей цепи. Ферменты ДНК-полимеразы являются чрезвычайно разборчивыми
вотношении типов цепей ДНК, которые они удлиняют: они безапелляционно требуют заранее сформированного, спаренного с матрицей 3′-OH-конца затравочной цепи, или праймера (primer strand; см. рис. 5.4). Те молекулы ДНК, что несут некомплементарный (ошибочно спаренный) нуклеотид на 3′-OH-конце затравочной цепи, не

Глава 5. Репликация, репарация и рекомбинация ДНК 413
эффективны в качестве матрицы, потому что полимераза не может продолжить такую нить. Молекулы ДНК-полимеразы исправляют такую содержащую ошибку затравочную цепь с помощью особого каталитического участка (или в специальной субъединице, или в специальном домене молекулы полимеразы — в зависимости от полиме-
разы). Такая корректирующая экзонуклеаза 3′ → 5′ удаляет любые неспаренные остатки на
конце затравки, продолжая это до тех пор, пока не будут удале-
ны все ошибочно вставленные нуклеотиды и не восстановится 3′-OH-конец с комплементар-
ным основанием, способный служить затравкой для синтеза ДНК. Таким образом, ДНК-полимераза работает как «самокорректирующийся» фер-
мент, который устраняет свои собственные ошибки полимеризации по мере своего продвиже-
ния по ДНК (рис. 5.8 и 5.9). Самокорректирующие
свойства ДНК-полимеразы полностью зависят от на-
личия идеально спаренного с основанием конца затравки,
и совершенно очевидно, что такой фермент не может на-
чать синтез de novo. Напротив, ферменты РНК-полимеразы, участвующие в транскрипции
Рис.5.8.Экзонуклеолитическаякоррек- ция,выполняемаяДНК-полимеразой в ходе репликации ДНК. В данном примере несоответствие возникло изза включения редкой неустойчивой таутомерной формы C, обозначенной звездочкой.Нототжекорректирующий механизмспособенисправлятьлюбое ошибочное включение на растущем 3'-OH-конце. Часть ДНК-полимеразы, которая удаляет ошибочно включенный нуклеотид, представляет собой специализированный фермент, относящийсякбольшомуклассуферментов, известных как экзонуклеазы, которые отщепляютнуклеотидысодногоизконцовполинуклеотиднойцепи.

414 Часть 2. Основные генетические механизмы
Рис.5.9.Редактирование(editing)репликацииДНК-полимеразой.ОбщаясхемаструктурыДНК-полимеразы вкомплексесматрицейДНК:врежимеполимеризации(слева)иврежимередактирования,иликоррекции (справа).Обозначеныкаталитическиесайтыдляэкзонуклеолитическойреакции(E)иреакцииполимеризации(P).ВрежимередактированияновосинтезированнаяДНКкратковременноотходитотматрицыиполимеразапретерпеваетконформационноеизменение,врезультатекоторогокорректирующийкаталитическийучасток занимаетдругоеположение,гдеипроисходитудалениепоследнегоизприсоединенныхнуклеотидов.
генов, не нуждаются в таком эффективном экзонуклеолитическом корректирующем механизме: ошибки, возникающие при создании РНК, не передаются следующему поколению, и случайная дефектная молекула РНК, которая произведена, не имеет никакого значения в долгосрочной перспективе. Поэтому РНК-полимеразы способны начинать синтез новых полинуклеотидных цепей без затравки.
Как в процессе синтеза РНК, так и в самостоятельном процессе — трансляции последовательностей мРНК в последовательности белков — частота появления ошибок составляет около одной ошибки на каждые 104 событий полимеризации. Такой коэффициент ошибок в 100 000 раз больше, чем при репликации ДНК, в каковом случае ряд корректирующих процессов обеспечивает необычайную точность работы (таблица 5.1).
Таблица5.1.Триэтапа,обеспечивающихвысокуюточностьсинтезаДНК
ЭТАП РЕПЛИКАЦИИ |
ЧАСТОТА ОШИБОК |
Полимеризация в напралении 5' → 3' |
1 на 105 |
Экзонуклеолитическая коррекция в направлении 3' → 5' |
1 на 102 |
Направляемое цепью исправление ошибок спаривания |
1 на 102 |
Итого |
1 на 109 |
Примечание: третий этап — направляемое цепью исправление ошибок спаривания — описан ниже в этой главе.
5.2.4. Эффективное исправление ошибок возможно лишь при репликации ДНК в направлении 5' →3'
Причина, по которой репликация ДНК происходит исключительно в направлении 5′ → 3′, объясняется, вероятно, необходимостью получения на выходе «качественного продукта». Если бы существовала ДНК-полимераза, которая присоединяла бы дезоксирибонуклеозидтрифосфаты в направлении 3′ → 5′, то активи-

Глава 5. Репликация, репарация и рекомбинация ДНК 415
рующий трифосфат, необходимый для образования ковалентной связи, обеспечивал бы наращиваемый 5′-конец цепи, а не присоединяемый мононуклеотид. В таком случае ошибки полимеризации попросту не могли бы исправляться гидролизом, потому что голый 5′-конец цепи, созданный таким образом, немедленно завершил бы синтез ДНК (рис. 5.10). Поэтому исправить несоответствующее основание
Рис.5.10.ОбъяснениефактанаращиванияцепиДНКвнаправлении5'→3'.Роствнаправлении5'→3',
представленный справа, позволяет цепи продолжать расти, после того как ошибка в полимеризации удалена экзонуклеолитической коррекцией (см. рис. 5.8). Напротив, экзонуклеолитическая коррекция в гипотетической схеме полимеризации в направлении 3' → 5', помещенной слева, блокировала бы дальнейшееудлинениецепи.ДляудобствапоказанатолькозатравочнаянитьдвойнойспиралиДНК.

416 Часть 2. Основные генетические механизмы
можно, только если оно было присоединено к 3′-концу цепи ДНК. Хотя механизм репликации ДНК, действующий по принципу «обратных стежков» (см. рис. 5.7), и кажется сложным, он сохраняет направление полимеризации 5′ → 3′, которое является непременным условием экзонуклеолитической коррекции.
Несмотря на эти меры безопасности, направленные против ошибок репликации ДНК, ДНК-полимеразы иногда все же ошибаются. Однако, как мы увидим позже, клетки имеют еще один шанс исправить эти ошибки при помощи процесса,
названного направляемым цепью исправлением ошибок спаривания (stranddirected mismatch repair ), или mismatch-репарацией. Однако, прежде чем подойти к обсуждению этого механизма, мы опишем белки других типов, которые «несут свою службу» в репликационной вилке.
5.2.5. Короткие молекулы РНК-затравок на отстающей цепи синтезирует специальный фермент
Для синтеза ведущей нити специальная затравка необходима только в начале репликации: как только репликационная вилка утвердит свое существование, ДНКполимеразе непрерывно предоставляется конец цепи со спаренным основанием и на этот конец она добавляет новый нуклеотид. На отстающей же цепи вилки, однако, каждый раз, когда ДНК-полимераза заканчивает короткий отрезок ДНК фрагмента Оказаки (на который у нее уходит несколько секунд), она должна начать синтезировать совершенно новый фрагмент на участке, расположенном далее по ходу матричной цепи (см. рис. 5.7). Спаренный с лидирующей цепью праймер, необходимый для работы ДНК-полимеразы, образуется посредством специального механизма. Этот механизм включает в себя фермент, названный ДНК-праймазой, который использует рибонуклеозидтрифосфаты для синтеза коротких РНК-затравок на отстающей нити (рис. 5.11). У эукариот такие затравки имеют длину около 10 нуклеотидов и собираются на отстающей нити с промежутками в 100–200 ну-
клеотидов.
Химическая структура РНК была представлена читателю в главе 1 и будет описана подробно в главе 6. Здесь же мы лишь заме-
тим, что РНК весьма подобна ДНК по своей структуре. Нить РНК может спариваться с нитью ДНК и формировать таким образом гибридную двойную спираль ДНК–РНК, — если эти две нуклеотидных последовательности комплементарны друг другу. Таким
Рис. 5.11. Синтез РНК-затравки. Принципиальная схе-
ма реакции, катализируемой ДНК-праймазой — ферментом, который синтезирует короткие РНК-затравки наотстающейцепи,используяДНКвкачествематрицы. В отличие от ДНК-полимеразы, этот фермент может начинать синтез новой полинуклеотидной цепи путем соединениядвухнуклеозидтрифосфатов.Праймазасинтезируеткороткийполинуклеотидвнаправлении5'→3' и затем останавливается, предоставляя 3'-конец этой затравкивраспоряжениеДНК-полимеразы.

Глава 5. Репликация, репарация и рекомбинация ДНК 417
Рис.5.12.СинтезодногоизмногочисленныхфрагментовДНКнаотстающейцепи.Вклеткахэукариот РНК-затравки синтезируются на отстающей цепи с промежутками, разделенными приблизительно 200 нуклеотидами, и каждая РНК-затравка имеет длину около 10 нуклеотидов. Такая затравка вычищается специальным ферментом репарации ДНК (РНКазойH),которыйраспознаетнитьРНКвспирали РНК – ДНКифрагментируетее;послеэтогоостаются бреши(gaps),которыезаполняютсяспомощьюДНК- полимеразыиДНК-лигазы.
образом, синтез РНК-затравок направляется по тому же матричному принципу (по шаблону), что используется для син-
теза ДНК. Поскольку РНК-затравка содержит должным образом спаренный ком-
плементарный нуклеотид с группой 3′-OH
на одном из концов, то он может быть продолжен ДНК-полимеразой с этого конца и дать тем самым начало фрагменту Ока-
заки. Синтез каждого фрагмента Оказаки заканчивается, когда ДНК-полимераза натыкается на РНК-затравку, находящуюся
на 5′-конце предыдущего фрагмента. Для того чтобы собрать непрерывную цепь ДНК из многочисленных фрагментов ДНК, синтезируемых на отстающей нити, на выручку быстро приходит специальная
система репарации ДНК — она вычищает старую РНК-затравку и заменяет ее последовательностью ДНК. После этого фермент, называемый ДНК-лигазой, сводит воедино 3′-конец нового фрагмента ДНК с 5′-концом предыдущего и завершает этим актом весь процесс (рис. 5.12 и 5.13).
По какой же причине недолговечной РНК-затравке могло быть отдано предпочтение перед ДНК-затравкой, которую не было бы надобности удалять? Тот факт,
Рис. 5.13. Реакция, катализируемая ДНК-лигазой. Этот фермент «сшивает» разрыв фосфодиэфирной связи.Какпоказанонасхеме,ДНК-лигазаиспользуетмолекулуATP,чтобыактивировать5'-конецвраз- рыве (шаг 1) перед образованием новой связи (шаг 2). Благодаря этому энергетически невыгодная реакция «сшивания» разрыва осуществляется за счет сопряжения с энергетически благоприятным процессомгидролизаATP.
