
- •Саратовский государственный технический университет
- •Лабораторная работа 1 определение коэффициента взаимной диффузии воздуха и водяного пара
- •Основные теоретические положения
- •Методика эксперимента
- •Описание экспериментальной установки и порядок выполнения работы
- •Обработка результатов измерений
- •Лабораторная работа 2 определение коэффициента теплопроводности методом нагретой нити
- •Основные теоретические положения
- •Методика эксперимента
- •Описание экспериментальной установки и порядок выполнения работы
- •Обработка результатов измерений
- •Методика эксперимента
- •Описание экспериментальной установки и порядок выполнения работы
- •Обработка результатов эксперимента
- •Лабораторная работа 4 Определение отношения теплоемкостей воздуха при постоянных давлении и объеме
- •Основные теоретические сведения
- •Методика эксперимента
- •Описание экспериментальной установки и порядок выполнения работы
- •Обработка результатов измерений
Описание экспериментальной установки и порядок выполнения работы
Для этого предназначена экспериментальная установка, общий вид
которой показан на рис. 3.3.
Нагревание олова происходит в тигле с помощью электрического нагревателя 3, источник питания которого размещён в блоке приборов 7. Температура олова определяется цифровым термометром, расположенным в блоке рабочего элемента 6. Время нагрева измеряется цифровым секундомером, который находится в блоке приборов. Секундомер приводится в действие при включении питания блока приборов.
Включить установку тумблером «Сеть» и измерить начальную температуру олова Т0.
Одновременно включить нагреватель и запустить секундомер и через каждую минуту измерять температуру олова. Измерения проводить до тех пор, пока температура не достигнет постоянной величины Тпл, и затем начнет увеличиваться. Результаты измерений занести в таблицу.
Выключить нагреватель и провести аналогичные измерения при охлаждении олова, отмечая температуру, как в п.2.
Выключить установку тумблером «Сеть».
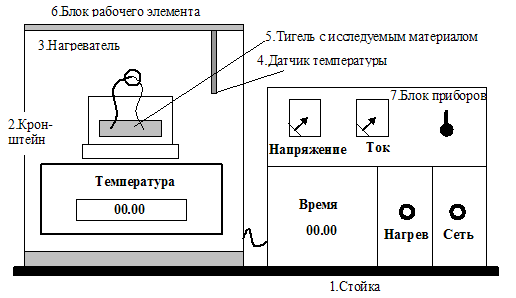
Рис. 3.3 Экспериментальная установка для исследования
плавления и кристаллизации олова
Обработка результатов эксперимента
Построить графики зависимости Тот времениtв процессах плавления и кристаллизации олова.
По двум полученным графикам определить средние температуры, соответствующие параллельным оси времени участкам.
По формуле (3.18) определить приращение энтропии олова во время нагревания и плавления. Удельная теплоёмкость олова с=230 Дж/кг·К,удельная теплота плавления олова
 =5,86·104
Дж/кг.
=5,86·104
Дж/кг.
Расчёт погрешностей выполнить
по методике расчёта погрешностей прямых
измерений
![]() ,
используя формулы (П.1), (П.2) и (П.3). В нихX=Tплдля температуры плавления иX=Trh. Результаты записать в виде
,
используя формулы (П.1), (П.2) и (П.3). В нихX=Tплдля температуры плавления иX=Trh. Результаты записать в виде![]() и
и![]() .
.
Рассчитать погрешность приращения
энтропии
![]() олова по формуле расчёта погрешности
косвенных измерений:
олова по формуле расчёта погрешности
косвенных измерений:
![]() .
.
Результат представить в виде:
![]() .
.
Лабораторная работа 4 Определение отношения теплоемкостей воздуха при постоянных давлении и объеме
Цель работы: изучение I начала термодинамики и применение его к изопроцессам в идеальных газах; введение понятия теплоёмкости и определение теплоёмкостей в различных изопроцессах и в адиабатном процессе; экспериментальное определение показателя адиабаты для воздуха методом Клемана-Дезорма.
Основные теоретические сведения
Iначало термодинамики утверждает, что количество теплоты, переданное термодинамической системе, идёт на увеличение её внутренней энергии и на работу, совершаемую силами, приложенными со стороны системы к внешним телам:
![]() .
(4.1)
.
(4.1)
Элементарная работа, совершаемая газом
при бесконечно малом изменении объёма
![]() ,
когда давление газа
,
когда давление газа![]() можно считать неизменным, равна
можно считать неизменным, равна
![]() . (4.2)
. (4.2)
Для идеального газа элементарное
изменение внутренней энергии
![]() определятся изменением его температуры
определятся изменением его температуры![]() и равно:
и равно:
![]() , (4.3)
где
, (4.3)
где![]() –
масса газа;
–
масса газа;![]() –
его молярная масса;
–
его молярная масса;![]() –
универсальная газовая постоянная,
–
универсальная газовая постоянная,![]() –
число степеней свободы молекул газа.
–
число степеней свободы молекул газа.
Числом степеней свободы
![]() называют число независимых координат,
определяющих положение молекулы в
пространстве. Например, число степеней
свободы для одноатомной молекулы, равно
трём, для жесткой двухатомной – пяти.
называют число независимых координат,
определяющих положение молекулы в
пространстве. Например, число степеней
свободы для одноатомной молекулы, равно
трём, для жесткой двухатомной – пяти.
Количество теплоты
![]() ,
требуемое для нагревания газа, зависит
от количества нагреваемого газа и от
того, на сколько градусов должна быть
изменена его температура. Поэтому для
характеристики тепловых свойств газа
используетсятеплоёмкость.
,
требуемое для нагревания газа, зависит
от количества нагреваемого газа и от
того, на сколько градусов должна быть
изменена его температура. Поэтому для
характеристики тепловых свойств газа
используетсятеплоёмкость.
Удельной теплоёмкостьюгаза называется величина, равная количеств теплоты, которую необходимо сообщить единице массы газа для увеличения его температуры на 1 К:
![]() .
(4.4)
.
(4.4)
Теплоемкость одного моля вещества называетсямолярной теплоемкостью:
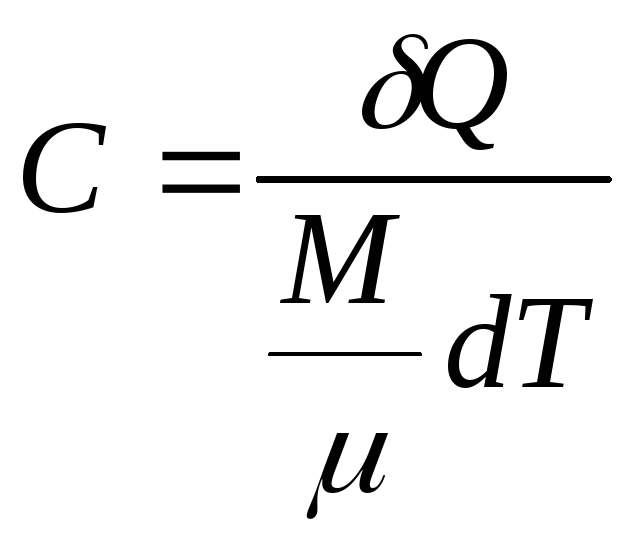 . (4.5)
. (4.5)
Значение теплоемкости газов зависит от условий их нагревания. ЗапишемIначало термодинамики и найдём теплоёмкости идеальных газов в различных термодинамических процессах.
В случае изохорного процесса
![]() Iначало термодинамики
принимает вид:
Iначало термодинамики
принимает вид:
![]() . (4.6)
Учитывая
(4.3) и (4.5), для молярной теплоёмкости при
постоянном объёме получим:
. (4.6)
Учитывая
(4.3) и (4.5), для молярной теплоёмкости при
постоянном объёме получим:
![]() . (4.7)
. (4.7)
При изотермическом процессе (![]() ),
),![]() иIначало термодинамики
запишется так:
иIначало термодинамики
запишется так:
![]() . (4.8)
Теплоёмкость газа становится бесконечно
большой
. (4.8)
Теплоёмкость газа становится бесконечно
большой![]() .
Это относится кидеальномуизотермическому процессу, который
возможен лишь при идеально хорошем
обмене теплом между газом и внешними
телами. Практически приблизиться к
изотермическому процессу можно, заставляя
его протекать настолько медленно, чтобы
температура газа все время успевала
выравниваться с температурой окружающих
тел.
.
Это относится кидеальномуизотермическому процессу, который
возможен лишь при идеально хорошем
обмене теплом между газом и внешними
телами. Практически приблизиться к
изотермическому процессу можно, заставляя
его протекать настолько медленно, чтобы
температура газа все время успевала
выравниваться с температурой окружающих
тел.
Если в газе протекает процесс изобарный
(![]() ),
тоIначало термодинамики
имеет вид:
),
тоIначало термодинамики
имеет вид:
![]() (4.9)
или
(4.9)
или
![]() .
(4.10)
.
(4.10)
Из уравнения Менделеева- Клапейрона имеем
![]() .
Тогда
из уравнения (4.10) для молярной теплоёмкости
газа при постоянном давлении, получаем
.
Тогда
из уравнения (4.10) для молярной теплоёмкости
газа при постоянном давлении, получаем
![]() . (4.11)
. (4.11)
Таким образом, молярная теплоёмкость
при постоянном давлении
![]() превосходит молярную теплоёмкость при
постоянном объёме
превосходит молярную теплоёмкость при
постоянном объёме![]() на универсальную газовую постоянную
на универсальную газовую постоянную![]() .
Это объясняется тем, что при нагревании
газа при постоянном давлении газ
расширяется. Сообщаемое ему извне тепло
идёт не только на увеличение запаса его
внутренней энергии
.
Это объясняется тем, что при нагревании
газа при постоянном давлении газ
расширяется. Сообщаемое ему извне тепло
идёт не только на увеличение запаса его
внутренней энергии![]() ,
но и на совершение работы
,
но и на совершение работы![]() против внешних сил.
против внешних сил.
Процесс, протекающий в газе без теплообмена
с окружающей средой (![]() ),
называется адиабатным. В этом случаеIначало термодинамики имеет вид
),
называется адиабатным. В этом случаеIначало термодинамики имеет вид
![]() или
или
![]() . (4.12)
Из соотношения (4.12)
следует, что при адиабатном сжатии газа
(
. (4.12)
Из соотношения (4.12)
следует, что при адиабатном сжатии газа
(![]() ),
он нагревается (
),
он нагревается (![]() );
при адиабатном расширении (
);
при адиабатном расширении (![]() )
– газ охлаждается (
)
– газ охлаждается (![]() ).
).
Таким образом, при адиабатном изменении объёма газа его температура не остаётся постоянной, а молярная теплоёмкость газа равна 0.
Cоответственный расчёт
позволяет связать это изменение
температуры![]() с изменением его объёма
с изменением его объёма![]() .
Пусть газ, занимая объём
.
Пусть газ, занимая объём![]() ,
имел температуру
,
имел температуру![]() ,
тогда при адиабатном изменении объёма
до значения
,
тогда при адиабатном изменении объёма
до значения![]() ,
температура примет значение
,
температура примет значение![]() ,
причём будет иметь место следующее
соотношение:
,
причём будет иметь место следующее
соотношение:
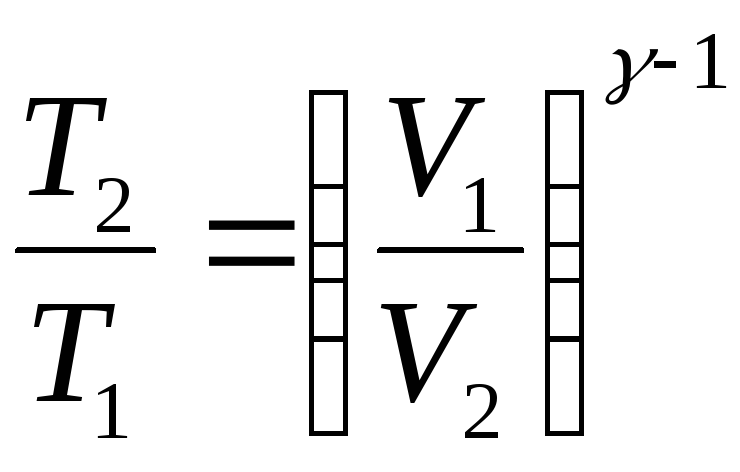 ,
(4.13)
,
(4.13)
где
![]() ,
т. е.
,
т. е.![]() есть
отношение теплоёмкостей газа при
постоянном давлении и постоянном объёме.
Величина
есть
отношение теплоёмкостей газа при
постоянном давлении и постоянном объёме.
Величина![]() называется показателем адиабаты.
называется показателем адиабаты.
Воспользовавшись формулой Менделеева-Клапейрона, справедливойдля каждого данного состояния газа, получим:
![]() ;
подставив
это значение
;
подставив
это значение![]() в
(4.13), получим:
в
(4.13), получим:
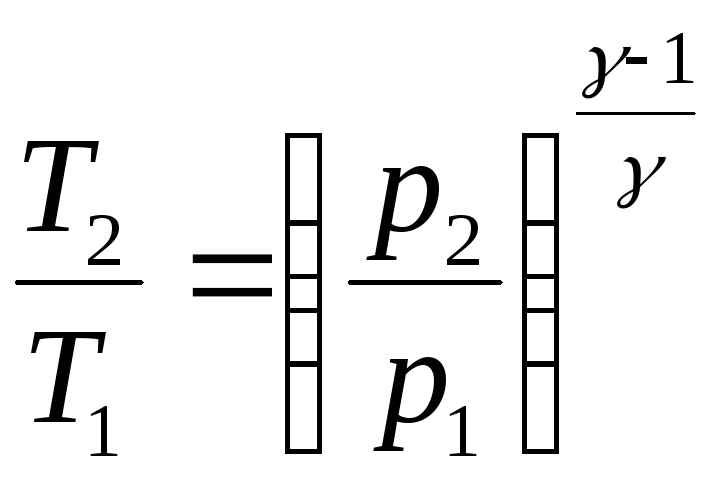 .
(4.14)
.
(4.14)
Формула (4.14), тождественная по своему смыслу с формулой (4.13), связывает изменение температуры, происходящее при адиабатном процессе, с изменением давления газа.
Приравнивая друг другу правые части выражений (4.13) и (4.14), получим
![]() или
или![]() , (4.15)
т.е. при адиабатном
изменении объёма давление газа
, (4.15)
т.е. при адиабатном
изменении объёма давление газа![]() меняется обратно пропорционально
объёму, взятому в степени
меняется обратно пропорционально
объёму, взятому в степени![]() .
Формула (4.15) носит название формулы
Пуассона.
.
Формула (4.15) носит название формулы
Пуассона.
Практически процессы не носят строго адиабатного характера, так как невозможно осуществить полной термической изоляции газа. Но поскольку для совершения теплообмена необходимо некоторое время, то адиабатным можно считать процесс, который протекает настолько быстро, что система не успевает вступить в теплообмен с окружающей средой.
