
- •ШЕСТИЧЛЕННЫЕ
- •Способы получения
- ••2). Синтезы пиридина на основе более простых реагентов:
- •Физические свойства
- ••Строение
- ••НЭП атома азота находится вне сопряженной системы и занимает гибридную sp2 –орбиталь, ориентированную
- ••Резонансные структуры, иллюстрирующие ароматическую делокализацию π-электронов в молекуле пиридина :
- ••В большей части этих структур атом азота имеет отрицательный заряд, что соответствует его
- ••пиридин
- •Химические свойства
- ••Пиридин более сильное основание, чем анилин.
- ••Пиридин легко образует соли с HBr, HCl, H2SO4 и др. кислотами.
- ••Однако основность пиридина значительно ниже, чем у жирных аминов Alk→NH2.
- ••Благодаря эл-ой паре N пиридин проявляет нуклеофильные в-ва. Так, пиридин легко алкилируется с
- ••Соли при нагревании перегруппировываются в гомологи пиридина.
- ••Нуклеофильные свойства пиридина подтверждаются и легкостью образования N-ацилпиридиниевых солей.
- ••П с SO3 образует комплекс С6H5N∙SO3, используемый для сульфирования ацидофобных соединений. Это мягкий
- •2. Электрофильное ароматическое замещение
- ••Это обусловлено двумя причинами:
- ••Пиридин по cв-вам напоминает нитробензол.
- •• Атака в положение 2:
- •• Атака в положение 3:
- •N пиридин
- •3. Реакции нуклеофильного замещения
- •• Классическим примером такой реакции является
- •NaNH2
- •4.Окисление
- •• SЕ-реакции у пиридин-N-оксида
- •Обработкой продукта р-ции PCl3 удаляют кислород.
- •5.Восстановление
- •Производные пиридина
- ••2- и 4 -гидрокси- и аминопиридины резко отличаются от 3-производных по cв-вам.
- ••Это можно объяснить таутомерным превращением.
- ••Анологично и у аминопроизводных.
- ••α- и γ-аминопиридины не диазотируютя,
- •• Пиридинкарбоновые кислоты:
- ••Никотиновая к-та – широко распространена в природе – сод-ся в печени, экстракте дрожжей,
- ••Никотин 3-[2-(N-метилпирролидил)]-пиридин содержится в листьях и корнях табака. Это

ШЕСТИЧЛЕННЫЕ
ГЕТЕРОЦИКЛИЧЕСКИЕ
СОЕДИНЕНИЯ

|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
5 |
3 |
|
|
|
|
|
|
|||||||
|
|
|
|
|
6 |
|
|
|
|
N |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
пиридин |
|
|
|
CH3 |
||||||||||
|
|
N |
|
CH3 |
|
|
|
|
|
N |
CH3 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
N |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|||||||||||||||
2-метилпиридин |
3-метилпиридин 4-метилпиридин |
||||||||||||||||||
( -пиколин) |
( -пиколин) |
( -пиколин) |
|||||||||||||||||
Способы получения
•1. В промышленных масштабах пиридин и его гомологи получают при коксохимической переработке каменного угля.
2. Лабораторные методы:
1). Наиболее известный метод синтеза Ганча. См. уч.

•2). Синтезы пиридина на основе более простых реагентов:
2 HC СH
СH
O 3CH3 C H
H
2 CH2 CH
HCN to 



 N
N
to
NH3 |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
кат. |
|
|
|
||||
|
N CH3 |
|||||||
|
|
|
|
|
|
|
||
|
|
|
H2, |
|
|
3H2O |
||
|
|
|
|
|||||
|
|
|
||||||
C O |
CH3 |
NH3 |
|
H |
2H O N |
|
|
|
2 |
Физические свойства
•Пиридин представляет собой бесц. жидкость с Т.кип. 115оС.
•Он обладает характерным неприятным запахом, смешивается во всех отношениях с водой, этанолом, диэтиловым эфиром; устойчив при хранении.
•Строение
•Пиридин является шестичленным гетероароматическим аналогом бензола. Все атомы цикла находятся в состоянии sp2-гибридизации и вносят по одному
π-электрону в ароматический секстет.
•Плоская молекула имеет сопряжённую систему из шести π-электронов.











 N
N
пиридин
гибридная
орбиталь

•НЭП атома азота находится вне сопряженной системы и занимает гибридную sp2 –орбиталь, ориентированную в плоскости цикла перпендикулярно осям негибридных орбиталей атомов С и N.

•Резонансные структуры, иллюстрирующие ароматическую делокализацию π-электронов в молекуле пиридина :
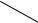 N
N
 N
N

 N
N

 N
N
•В большей части этих структур атом азота имеет отрицательный заряд, что соответствует его большей электроотрицательности. Степень разделения зарядов в молекуле пиридина характеризует сравнительно высокий дипольный момент.
