
- •Гетероциклические
- •Гетероциклическими соединениями
- •Ароматические
- ••Ароматические ГЦ соединения обладают всеми признаками ароматичности.
- •пятичленные
- •СПОСОБЫ ПОЛУЧЕНИЯ
- ••Фурфурол получил название от латинского слова «отруби».
- ••Пиррол – при фракционной перегонке каменноугольной смолы.
- •• 2. Лабораторные способы
- ••б) Взаимопревращения фурана, пиррола и тиофена: цикл Юрьева.
- ••г) Из бутин-1,4-диола и аммиака в присутствии катализатора
- •СТРОЕНИЕ
- ••Теория резонанса подтверждает ароматический характер фурана, пиррола и тиофена.
- ••Наблюдается отклонение от принципа аддитивности параметров связей и молекулы в этих системах –
- •Ест (кДж/моль)
- •• Все три гетероарена
- •ХИМИЧЕСКИЕ СВОЙСТВА
- •• Относительная
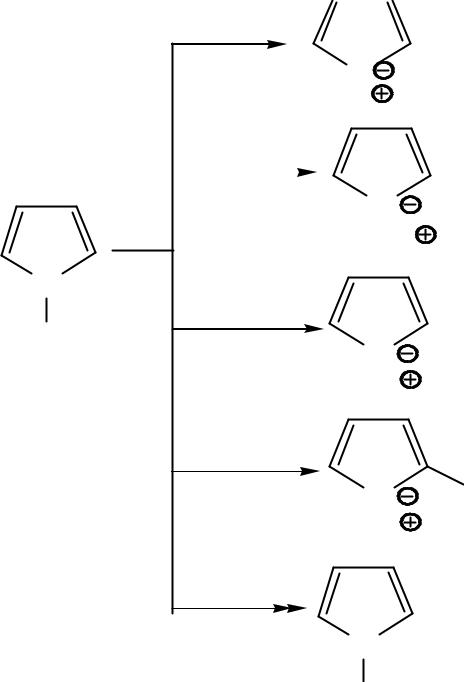
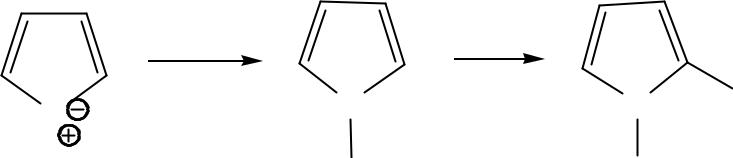
- ••Т.к. в α-положении δ- -заряд больше, то электрофил атакует
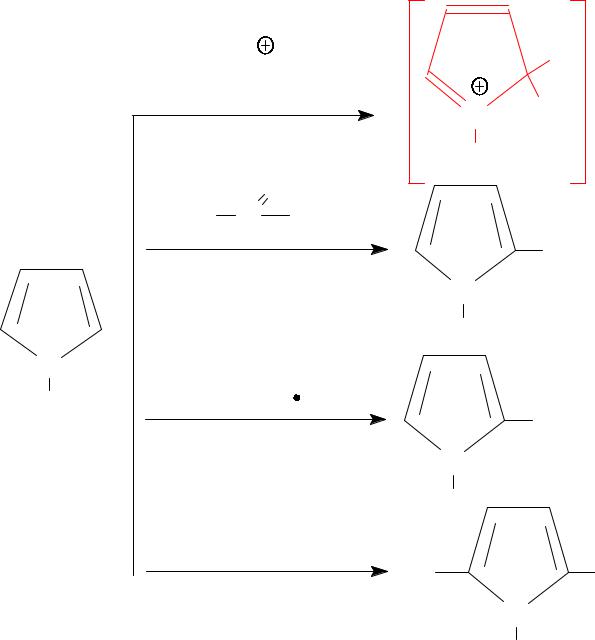
- •• Механизм электрофильного замещения (SЕ)
- •• 2) Пятичленные
- ••С-протонирование энергетически более выгодно, чем N-протонирование.
- •Нитрующие реагенты:
- •ульфирующие реагенты:
- •Ацетилирующие
- ••3) Основность - низкая, т.к. пара эл-ов гетероатома занимает р-орбиталь, к-рая участвует в
- •• 4) Реакции нуклеофильного
- •• 5) Склонность вступать в р-
- •• 6) Окисление - можно
- •Фуран
- •Реакции
- •HCON(CH3)2, POCl3
- •• Реакции нуклеофильного
- ••Реакции присоединения
- •• Реакции 1,4-
- ••Производные ФУРАНА
- •• Применение фурана
- ••Производные фурана довольно широко распространены в природе. Фурановые производные входят в состав многих
- ••ПИРРОЛ
- •• Кислотность и реакции
- ••Реакции присоединения
- •• Значение пиррола и его
- ••Все эти соединения содержат
- ••В порфине пиррольные остатки связаны метиновыми мостиками.
- ••Порфины, входящие в состав природных пигментов имеют заместители в пиррольных ядрах (порфирины).
- ••Гемоглобин отвечает за обеспечение тканей кислородом, хлорофилл принимает участие в трансформации солнечной энергии
- ••ТИОФЕН
- •CH3COCl / SnCl4
- •Реакции
- •Производные тиофена
•Производные фурана довольно широко распространены в природе. Фурановые производные входят в состав многих
душистых в-в, биологически активных в-в.
•Тетрагидрофурановый цикл входит в состав микотоксинов ( мускарин – яд красного мухомора).
•Вспомним, что тетрагидрофурановый цикл образует основу углеводов, имеющих фуранозное строение.
•ПИРРОЛ
•Жидкость, Тк=130оС, в воде растворим плохо.
•Реакции электрофильного замещения
|
H |
|
|
H |
о см о лен ие п ро дукто в |
|
|
|
N |
H |
|
|
|
|
раскры тия цикла |
||
|
CH3 COONO2 |
|
H |
|
(ацидо ф о бн о сть) |
|
|
|
NO2 2-í èòðî ï èððî ë |
||
|
(уксусн ы й ан гидрид, |
N |
|||
|
|
|
|||
|
HONO2) |
|
H |
|
|
N |
|
|
|
|
|
п иридин SO3 |
|
|
|
|
|
H |
|
|
SO3H 2-сульф о п ирро л |
||
|
|
|
N |
||
|
|
|
|
(2-ï èððî ë- |
|
|
Br2 |
|
H |
|
сульф о кисло та) |
|
Br |
|
|
Br |
|
|
раство ритель |
|
N |
||
|
|
|
|
2,5-дибро м п ирро л |
|
|
|
|
|
H |
|
|
|
|
|
|
|

|
[ArN N]+X- |
|
SE |
CHCl3, NaOH |
|
N |
||
|
||
H |
|
|
|
1. ÑH3MgCl |
|
|
2. CH3I |
|
|
CH3COCl / ZnCl2 |
|
|
1. CH3MgI |
|
|
2. CO2 |

 N N Ar 2-арилазо п ирро л
N N Ar 2-арилазо п ирро л
N
H

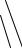
 CHO 2-п ирро лкарбальдегид N
CHO 2-п ирро лкарбальдегид N
H


 CH3 2-м етилп ирро л N
CH3 2-м етилп ирро л N
H
|
|
|
|
|
|
|
COCH3 |
2-ацетилп ирро л |
|
|
|
|
|
|
|
||
|
N |
|
||||||
|
|
|
|
|
|
|||
|
H |
|
||||||
|
|
|
|
|
|
COOH |
2-п ирро лкарбо н о вая |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
кисло та |
||
|
|
|
|
|
|
|||
N |
|
|||||||
|
|
|
|
|
|
|
|
|
H |
|
|||||||

• Кислотность и реакции
нуклеофильного замещения
•Пиррол имеет особые свойства – он проявляет не только основные, но и кислотные свойства, т.е. является амфотерным.
•При действии сильных оснований пиррол образует пирролят –ион.
•Является слабой к-той - Ка=5,4∙10-15 – слабее, чем фенол, но сильнее анилина.
|
KOHтв. |
|
N-пиррилкалий |
|
|
N |
(пирролят калия) |
|
|
K |
|
|
NaNH2 |
|
N-пиррилнатрий |
|
NH3 ж |
N |
|
|
|
||
|
|
Na |
|
N |
С4H9Li |
|
|
H |
|
N-пирриллитий |
|
|
N |
||
|
|
|
|
|
|
Li |
|
|
2С4H9Li |
|
1,2-дилитийпиррол |
|
|
N |
Li |
|
|
Li |
|
|
RMgCl |
|
-пиррилмагний- |
|
|
|
|
|
-RH |
N |
Nхлорид |
|
|
MgX |
|
CH I |
to |
|
|
3 |
|
|
|
N |
N |
N |
CH3 |
K |
CH3 |
H |
|
пирролкалий |
|
||
(пирролят калия) |
N-метилпиррол |
2- |
|
|
|
метилпиррол |
|
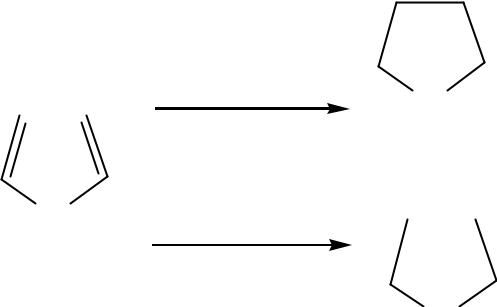
•Реакции присоединения
•(восстановления)
|
|
|
|
H2/Ni |
|
|
|
|
|
|
|
пирролидин |
|
|
|
|
|
|
|
N |
|||||
|
|
|
|
CH3COOH |
||||||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||
N |
|
|
|
H |
||||||||
|
|
Zn |
|
|||||||||
|
|
|
|
|
|
|
2,5-дигидропиррол |
|||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH3COOH |
||||||||
H |
|
|
||||||||||
|
|
|
|
|
|
|
|
N |
||||
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
H |
||||
• Значение пиррола и его
производных
•Производные пиррола имеют большое биологическое значение.
•Пиррольные ядра образуют основу многих биологически важных пигментов (красящих в-в) – пигментов крови (гемоглобин) и зеленых частей растений
(хлорофилл), желчи, витамина В12.

•Все эти соединения содержат
плоское 16-членное кольцо – ядро порфина.

 N N
N N

 NH H
NH H
 N
N

