
диссертации / 10
.pdf111
3.5. Прогностическое значение исследования изменения секреции активных
форм кислорода полиморфно-ядерными лейкоцитами крови при остром
деструктивном панкреатите
Для оценки возможности прогностического значения исследования из-
менения секреции АФК посредством метода ХЛ нами было произведено оп-
ределение суммарной секреции АФК ПМЛ крови, секреции О2ˉ ПМЛ крови и способности ПМЛ секретировать АФК крови под влиянием бактериальных ком-
плексных АГ в динамике развития ОДП (1-е, 3-и, 7-е и 14-е сутки стационарного лечения) у больных с асептической и инфицированной формой течения заболева-
ния.
3.5.1. Динамическое исследование суммарной секреции активных форм кислорода и секреции супероксид анион радикала кислорода полиморфно-ядерными лейкоцитами крови больных острым деструктивным панкреатитом
Значения величин Sхл Л-ХЛ и Лц-ХЛ, характеризующие суммарную секре-
цию АФК и секрецию О2ˉ ПМЛ крови в группе доноров были приняты нами за нормальные значения. В 1 сутки у 1 группы пациентов регистрируются макси-
мальные значения суммарной секреции АФК ПМЛ, превышающие норму на
272,1% (р<0,001) (рисунок 26).

112
Рис. 26. Динамика изменения суммарной секреции АФК крови, оцениваемой по величине площади под кривой Л-ХЛ, у больных с ОДП.
Примечание: *-р<0,05; #-p<0,001 по сравнению с группой доноров.
Во 2 группе это увеличение составило 83,5% (р<0,05). В динамике развития ОДП, по мере увеличения выраженности воспалительной реакции, к 3-м суткам стационарного лечения у всех больных наблюдается дальнейший рост значений суммарной секреции АФК ПМЛ крови. У пациентов 1 группы суммарная секре-
ция АФК ПМЛ крови увеличивается на 411,0% (р<0,001), а у пациентов 2 группы
- на 206,5% (р<0,05) по сравнению с донорами. К 7-м суткам данный показатель начинает достоверно снижаться в обеих обследуемых группах больных, но не достигает нормальных значений. В 1 группе пациентов с асептическим течением ОДП суммарная секреция АФК ПМЛ крови снижается в большей степени, чем во
2 группе с инфицированием ОДП. К 14-м суткам суммарная секреция АФК ПМЛ крови в 1 группе приближается к нормальным величинам, а у пациентов 2 груп-
пы ниже нормы на 22,6% (р<0,05).
Секреция О2ˉ ПМЛ крови в 1 группе пациентов выше нормы на 28,8%
(р<0,001) в 1-е сутки и на 31,9% (р<0,001) на 3-е сутки стационарного лечения ОДП, а на 7-е и 14-е сутки статистически не отличается от значений в группе до-
норов (рисунок 27). Во 2 группе пациентов уже в 1-е сутки наблюдается сниже-
ние уровня секреции О2ˉ ПМЛ крови на 34,2% (р<0,05) по сравнению с донорами

113
и на 48,9% (р<0,05) по сравнению с 1 группой пациентов. К 3-м суткам секреция О2ˉ возрастает и не сильно отличается от значений в 1 группе пациентов. На 7-е
сутки значения секреции О2ˉ становятся максимальными по сравнению с донора-
ми и 1 группой пациентов. Но к 14-м суткам данный показатель снова снижается и его значения ниже нормы на 16,7% (р<0,05).
Рис. 27. Динамика изменения секреции О2ˉ ПМЛ крови, оцениваемой по величине площади под кривой Лц-ХЛ, у больных с ОДП.
Примечание: *-р<0,05; #-p<0,001 по сравнению с группой доноров.
3.5.2. Динамическое исследование праймирующего влияния бактериальных комплексных антигенов на секрецию активных форм кислорода полиморфно-ядерными лейкоцитами крови больных острым деструктивным панкреатитом
При изучении праймирующего влияния бактериальных комплексных АГ на суммарную секрецию ПМЛ крови у доноров нами было отмечено, что воздейст-
вие самой высокой концентрации всех исследуемых комплексных АГ (кроме
Klebsiella pneumoniae) - Смах= 1000×104 микр. кл/мл вызывает достоверное подав-
ление эффекта прайминга ПМЛ (ИП<1,0). У пациентов с различными формами течения ОДП в динамике развития заболевания это влияние на суммарную сек-
114
рецию АФК ПМЛ крови было неоднозначным. Наблюдаемый нами факт заложен в основу возможного прогнозирования формы течения воспалительного процесса при ОДП.
Праймирующее влияние комплексного антигена Escherichia coli на секрецию активных форм кислорода полиморфно-ядерными лейкоцитами крови больных острым деструктивным панкреатитом
При воздействии комплексного АГ E.coli в различных концентрациях (5×104 -
1000×104 микр.кл/мл) на ПМЛ крови больных 1 группы не наблюдается обратной дозовой зависимости ИП, как в группе доноров (Приложение. Таблица 1). На протяжении всего исследования вплоть до 14-х суток стационарного лечения влияние всех концентраций комплексного АГ вызывает праймирование суммар-
ной секреции АФК ПМЛ крови, в том числе и Смах, достоверно подавляющая суммарную секрецию АФК ПМЛ у доноров. Воздействие оптимальной концен-
трацией данного комплексного АГ вызывает увеличение праймирующей способ-
ности ПМЛ по сравнению с группой доноров на 32,4% (р<0,001) в 1-е сутки ста-
ционарного лечения, на 29,7% (р<0,001) - на 7-е сутки, на 16,2% (р<0,05) - на 14-е
сутки. При воздействии Смах в 1 группе наблюдается увеличение праминг-
эффекта в 1-е сутки - на 139,3% (р<0,001), 7-е сутки - на 332,6% (р<0,001), а на
14-е сутки - на 71,9% (р<0,001) по сравнению с донорами (рисунок 28).
При воздействии комплексного АГ E.coli на ПМЛ крови пациентов 2 группы на протяжении всего срока наблюдения фиксируется обратная дозовая зависи-
мость ИП от концентрации комплексного АГ, но данный показатель достоверно снижен по сравнению с таковым у доноров. Воздействие Сопт данного комплекс-
ного АГ вызывает снижение праймирующей способности к суммарной секреции АФК ПМЛ по сравнению с группой доноров и 1 группой пациентов. При воздействии Смах во 2 группе также фиксируется снижение праймингэффекта: в
1-е сутки на 23,6% (р<0,001), 7-е- на 6,7% (р<0,05), а 14-е сутки - на 5,6% (р<0,05)
по сравнению с донорами.

115
Рис. 28. Динамика изменения прайминг - эффекта ПМЛ крови, оцениваемого по индексу соотношения площадей Л-ХЛ у больных с ОДП при воздействии комплексного АГ E.coli. в концентрации 1000×104 микр. кл/мл.
Примечание: *-р<0,05; #-p<0,001 по сравнению с группой доноров.
Праймирующее влияние комплексного антигена Staphylococcus aureus
на секрецию активных форм кислорода полиморфно-ядерными лейкоцитами крови больных острым деструктивным панкреатитом
При воздействии комплексного АГ Staphylococcus aureus в различных кон-
центрациях (5×104 -1000×104 микр.кл/мл) на ПМЛ крови у пациентов 1 группы не наблюдается обратной дозовой зависимости ИП, как в группе доноров (Прило-
жение. Таблица 2). На протяжении первых 7-ми суток стационарного лечения влияние всех концентраций комплексного АГ вызывает праймирование суммар-
ной секреции АФК ПМЛ крови, в том числе и Смах, достоверно подавляющая суммарную секрецию АФК ПМЛ у доноров. К 14- м суткам значения ИП в 1
группе пациентов на всех концентрациях комплексного АГ не значительно отли-
чаются от таковых в группе доноров. Воздействие оптимальной концентрацией данного комплексного АГ вызывает увеличение праймирующей способности ПМЛ к секреции АФК по сравнению с группой доноров на 11,5% (р<0,05) в 1-е

116
сутки стационарного лечения, на 39,7% (р<0,05) - в 7-е сутки. При воздействии Смах в 1 группе наблюдается достоверное увеличение праминг-эффекта в 1-е
сутки - на 251,6% (р<0,001), 7-е сутки - на 487,0% (р<0,001), а на 14-е сутки -
всего на 3,2% (р<0,05) по сравнению с донорами (рисунок 29).
При воздействии комплексного АГ Staphylococcus aureus на ПМЛ крови па-
циентов 2 группы на протяжении всего срока наблюдения фиксируется обратная дозовая зависимость ИП от концентрации комплексного АГ, но данный по-
казатель достоверно снижен по сравнению с таковым у доноров на всех концен-
трациях комплексного АГ. Воздействие Сопт данного комплексного АГ вызывает снижение праймирующей способности к суммарной секреции АФК ПМЛ по сравнению с группой доноров и 1 группой пациентов. При воздействии Смах во 2
группе также фиксируется снижение праймингэффекта: в 1-е сутки на 67,7% (р<0,001), 7-е-14-е сутки - на 29,0% (р<0,05) по сравнению с донорами.
Рис. 29. Динамика изменения прайминг - эффекта ПМЛ крови, оцениваемого по индексу соотношения площадей Л-ХЛ у больных с ОДП при воздействии комплексного АГ Staphylococcus aureus в концентрации 1000×104 микр. кл/мл.
Примечание: *-р<0,05; #-p<0,001 по сравнению с группой доноров.
117
Праймирующее влияние комплексного антигена Klebsiella pneumoniae
на секрецию активных форм кислорода полиморфно-ядерными лейкоцитами крови больных острым деструктивным панкреатитом
При воздействии комплексного АГ Klebsiella pneumoniae в различных кон-
центрациях (5×104 -1000×104 микр.кл/мл) на ПМЛ крови больных 1 группы не на-
блюдается двухфазной дозовой зависимости ИП, как в группе доноров (Прило-
жение. Таблица 3). На протяжении всего исследования вплоть до 14-х суток ста-
ционарного лечения влияние всех концентраций комплексного АГ вызывает праймирование суммарной секреции АФК ПМЛ крови, в том числе и Смах, досто-
верно подавляющая суммарную секрецию АФК ПМЛ |
у доноров. Воздействие |
оптимальной концентрацией данного комплексного АГ |
не вызывает увеличение |
праймирующей способности ПМЛ по сравнению с группой доноров. Однако, при воздействии Смах комплексного АГ, в течение всего исследования фиксируется увеличение праймирующей способности ПМЛ крови в 1 группе пациентов по сравнению с донорами. В 1-е сутки ИП увеличивается на 79,4% (р<0,001), на 7-е
сутки - на 53,9% (р<0,05), а на 14-е сутки - на 20,6% (р>0,05).
Во 2 группе пациентов при воздействии комплексного АГ Klebsiella pneumoniae показатель, характеризующий прайминг - ИП также не имеет двухфа-
зовой дозовой зависимости от концентрации комплексного АГ, как и в 1 группе.
Но достоверно снижен по сравнению с таковым у доноров. Воздействие Сопт дан-
ного комплексного АГ вызывает снижение праймирующей способности к сум-
марной секреции АФК ПМЛ по сравнению с группой доноров и 1 группой паци-
ентов. При воздействии Смах в 1сутки ИП достоверно снижен на 43,1% (р<0,05),
на 7-е сутки – на 28,4% (р<0,05), а на 14-е сутки – на 38,2% (р<0,05) (рисунок 30).

118
Рис. 30. Динамика изменения прайминг - эффекта ПМЛ крови, оцениваемого по индексу соотношения площадей Л-ХЛ у больных ОДП при воздействии комплексного АГ Klebsiella pneumoniae в концентрации 1000×104 микр. кл/мл.
Примечание: *-р<0,05; #-p<0,001 по сравнению с группой доноров.
Праймирующее влияние |
комплексного |
антигена |
Pseudomonas |
aeruginosa на секрецию |
активных форм |
кислорода полиморфно- |
|
ядерными лейкоцитами |
крови больных |
острым |
деструктивным |
панкреатитом |
|
|
|
При воздействии комплексного АГ Pseudomonas aeruginosa в различных концентрациях (5×104 -1000×104 микр.кл/мл) на ПМЛ крови больных 1 группы не наблюдается обратной дозовой зависимости ИП, как в группе доноров (Прило-
жение. Таблица 4). На протяжении всего срока наблюдения вплоть до 14-х суток стационарного лечения влияние всех концентраций комплексного АГ вызывает праймирование суммарной секреции АФК ПМЛ крови, в том числе и Смах, дос-
товерно подавляющая суммарную секрецию АФК ПМЛ у доноров. Воздействие Сопт данного комплексного АГ не вызывает увеличение праймирующей способ-
ности ПМЛ по сравнению с группой доноров. Однако, при воздействии Смах в 1
группе наблюдается достоверное увеличение праминг-эффекта в 1-е сутки - на
119
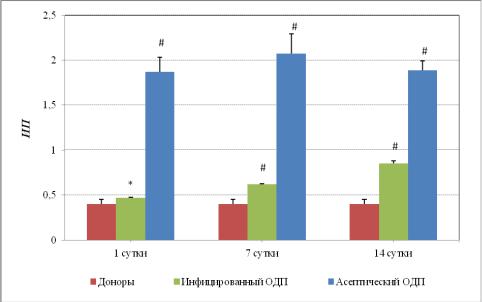
367,5% (р<0,001) , 7-е сутки - на 477,5% (р<0,001), а на 14-е сутки - на 117,5% (р<0,001) по сравнению с донорами (рисунок 31).
Рис. 31. Динамика изменения прайминг - эффекта ПМЛ крови, оцениваемого по индексу соотношения площадей Л-ХЛ у больных с ОДП при воздействии концентрацией 1000×104 микр.кл/мл комплексного АГ Pseudomonas aerugenosa.
Примечание: *-р<0,05; #-p<0,001 по сравнению с группой доноров.
Во 2 группе пациентов при воздействии комплексного АГ Pseudomonas aeruginosa показатель, характеризующий прайминг - ИП также не имеет обрат-
ной дозовой зависимости, как в 1 группе. Причем влияние всех концентраций комплексного АГ Pseudomonas aeruginosa не вызывает эффекта прайминга ПМЛ крови в течение всех 14-ти суток. Однако воздействие Смах во 2 группе также вызывает снижение данного эффекта, но оно выше, чем у доноров: в 1-е сутки на
12,5% (р<0,05), 7-е- на 52,5% (р<0,001), а 14-е сутки - на 115,0% (р<0,001).
Таким образом, полученные результаты по динамическому исследованию секреции АФК ПМЛ крови у больных с ОДП показывают, что уже на ранних сроках заболевания (1-е сутки стационарного лечения) при инфицированном течении ОДП наблюдается изменение кислородозависимого метаболизма ПМЛ крови, проявляющееся в снижении суммарной секреции АФК, снижении секреции О2ˉ и снижении суммарной секреции АФК под влиянием бактериаль-
ных комплексных АГ, участвующих в инфицировании при ОДП.
120
ЗАКЛЮЧЕНИЕ
На начальном этапе нашей работы мы отработали условия определения сек-
реции АФК ПМЛ методами Л-ХЛ и Лц-ХЛ в норме, а также исследовали прай-
мирующее влияние инкубации в течение 60 мин при 37˚С на ПМЛ. Данное воз-
действие на ПМЛ будет являться неспецифическим фактором, поскольку не тре-
бует наличия специфических рецепторов на поверхности клетки для запуска ды-
хательного взрыва. Механизм такого влияния заключается в изменении ионной проницаемости мембран клеток и последующей сборке и активации НАДФН-
оксидазы ПМЛ [35]. В наших исследованиях мы установили, что в механизмах прайминга ПМЛ при воздействии инкубации в течение 60 мин при 37˚С играют роль компоненты цельной крови, которые in vivo присутствуют в кровеносном русле. При изучении праймирующего влияния инкубации в течение 60 мин при
37˚С на выделенных ПМЛ мы получили, что влияние компонентов цельной кро-
ви на активацию НАДФН-оксидазы незначительно и составляет 13-15%. В то же время влияние на другие ферментные системы – МПО и СОД, ответственные за секрецию АФК, отличных от О2ˉ составляло 160-169%.
Таким образом, можно заключить, что в цельной крови присутствуют фак-
торы, которые при воздействии инкубацией при 37˚С в течение 60 минут оказы-
вают значительное предстимулирующее влияние на работу таких ферментных систем окислительного метаболизма ПМЛ как МПО и СОД. В то же время, мож-
но сделать вывод о том, что процессы выделения клеток оказывают негативное влияние на способность ПМЛ к секреции АФК. Поэтому для получения резуль-
татов по изучению секреции АФК ПМЛ in vitro неискажающих и приближен-
ных к картине in vivo необходимо проводить исследование на цельной крови.
Также мы подтвердили наше предположение о том, что и сами ПМЛ в кровенос-
ном русле могут предстимулироваться в ответ на влияние такого неспецифиче-
ского фактора как температура 37˚С, причем за счет активации НАДФН-
оксидазной реакции.
