
Лабораторный практикум по химической технологии неорганических веще
..pdf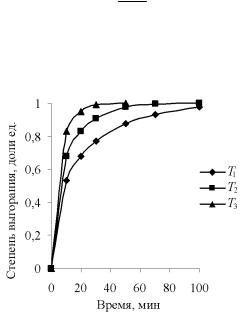
Зная количество серы в навеске колчедана заданного состава, рассчитывают теоретическое количество SO2 – G, которое может выделиться при полном выгорании серы из образца сульфидного материала. По опытным данным рассчитывают степень выгорания серы α:
α = GGSO2 .
По результатам расчетов строятся графики зависимости α = f(τ) (рис. 2), которые используются для проверки ряда закономерностей, вытекающих из кинетического уравнения (5).
Рис. 2. Зависимость степени выгорания серы отвремени приразличных температурах (пример)
Проверка зависимости скорости выгорания серы от температуры и определение энергии активации процесса
Данный анализ проводится, если по заданию преподавателя в работе изучалось горение колчедана в зависимости от температуры при постоянном расходе воздуха и постоянных размерах частиц сульфидного материала.
11
Если уравнению (5) придать вид
|
|
|
|
k |
0 |
e−E / RT Cm F n |
|
|||
(1− 3 1−α)2 = |
|
O2 |
|
τ |
(6) |
|||||
|
|
d |
|
|||||||
|
|
|
|
|
|
|
|
|
||
|
k |
0 |
e−E / RT Cm F n |
|
|
|
||||
и обозначить величину |
|
|
|
|
O2 |
|
через а, то получим |
|||
|
|
|
|
|
d |
|||||
|
|
|
|
|
|
|
|
|
||
выражение
(1− 3 1−α)2 = аτ.
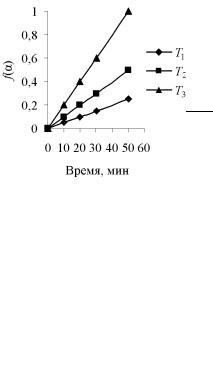
В этом выражении левая часть является функцией α, которая линейно зависит от τ.
Таким образом, экспериментальные данные, в случае, если для описания процесса справедливо уравнение (5), в координатах f(α) – τ должны укладываться для каждого опыта на прямую линию (рис. 3). Тангенс угла наклона прямой линии равен а, при постоянных исходных условиях пропорционален константе скорости процесса k0 e−E / RT и зави-
сит от температуры.
В свою очередь зависимость ln(α) от величины 1/Т также является линейной и тангенс
угла наклона этой прямой линии к оси абсцисс равен E/R и, следовательно, по нему может быть рассчитана кажущаяся энергия активации процесса горения сульфидного материала.
Результаты расчетов должны быть оформлены в виде табл. 2. По данным табл. 2 необходимо построить зависимость ln(α) от величины 1/Т и найти значение Е.
12

Таблица 2
Результаты обработки экспериментальных данных по кинетическому уравнению
Т, К |
1/Т |
α |
f (α) = (1− 3 1−α)2 |
ln( f (α)) |
τ, мин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
По величине найденной энергии активации процесса делается вывод о протекании процесса в кинетической, диффузионной или переходной областях и предлагаются меры для интенсификации процесса обжига.
Зависимость скорости горения колчедана от исходных размеров его частиц
Этот анализ проводится, когда изменяется размер частиц, а все остальные параметры (температура, расход и состав газа) остаются постоянными.
Из уравнения (6) следует, что при прочих постоянных параметрах величина f(α)обратно пропорциональна размерам частиц колчедана d. Следовательно, зависимость f(α) и 1/d должна быть прямой линией при одинаковом времени τ. Для проверки этого положения на кривых зависимостей α от τ при различных размерах исходных частиц сульфидного материала необходимо найти значения α при одном и том же τ. Результаты определения сводятся в табл. 3.
Таблица 3
Результаты обработки экспериментальных данных по зависимости процесса горения от размеров частиц
τ |
α |
f(α) |
d |
1/d |
|
|
|
|
|
13

По данным табл. 3 строится график в координатах: f(α) – 1/d. В результате проведенного анализа должен быть сделан вывод о влиянии размеров частиц сульфидного материала на процесс его горения.
Список литературы
1.Амелин А.Г. Технология серной кислоты. – М.: Химия, 1971. – 495 с.
2.Справочник сернокислотчика / под ред. К.М. Малина. –
М.: Химия, 1971. – 744 с.
3.Технология серной кислоты / К.М. Малин, Н.Л. Аркин, Г.К. Боресков, М.Г. Слинько. – М.; Л.: Госхимиздат, 1950. – 570 с.
Работа 2. КАТАЛИТИЧЕСКОЕ ОКИСЛЕНИЕ ДИОКСИДА СЕРЫ
Цель работы – исследование каталитической активности ванадиевого катализатора в процессе окисления диоксида серы в триоксид.
Теоретическая часть
Процесс окисления SO2 в SO3 осуществляется по следующей экзотермической химической реакции:
SO2 + O2 = SO3 + 96,05 кДж.
В результате проведения термодинамического анализа можно определить, что энтальпия реакции зависит от температуры:
∆НТ0 = –96850 + 2,68Т.
Константа равновесия реакции
Kp = P PSOP3 0,5 .
SO2 O2
14

Зависимость константы равновесия от температуры может быть определена по следующему эмпирическому уравнению:
lg Kр = 4905,5/Т – 7,1484.
Расчет равновесной степени превращения SO2 ведется по уравнению
x = |
|
Kp |
|
|
, |
|
Kp + |
1−0,5ax |
|
1 |
|||
b −0,5ax |
P |
|||||
|
|
|
||||
где а и b – молярные доли SO2 и O2 в исходном газе, Р – общее давление.
Особенностью процесса окисления SO2 в SO3 является то, что в реальных условиях исходный газ, получаемый либо путем обжига флотационного колчедана, либо окислением серы кислородом воздуха, всегда содержит значительное количество инертного азота. Например, при получении исходного газа путем обжига флотационного колчедана а = 0,07, b = 0,11.
Поскольку в исходном газе содержится много азота, влияние давления на равновесие реакции окисления невелико. Поэтому процесс ведут при давлениях, близких к атмосферному(1,5–1,8 ата).
Наибольшее влияние на равновесие реакции оказывают температура и избыток кислорода по сравнению со стехиометрическим количеством.
Влияние температуры на равновесную степень превращения SO2 показано в таблице.
Зависимость константы равновесия реакции окисления SO2 в SO3 и равновесной степени превращения SO2
от температуры (а = 0,07, b = 0,11, Р = 105 Па)
Т, К |
Kр |
х |
673 |
1,38 |
0,994 |
773 |
0,158 |
0,934 |
873 |
0,0296 |
0,734 |
15
Таким образом, с точки зрения равновесия процесс окисления SO2 в SO3 необходимо проводить при более низкой температуре и при избытке кислорода. Применение давления может быть эффективным при использовании более концентрированного исходного газа, например, в случае использования в технологии серной кислоты обогащенного кислородом воздуха.
Далее рассмотрим основные результаты кинетического анализа каталитического процесса окисления SO2 в SO3.
Механизм каталитического процесса зависит от типа катализатора, применяемого в реальных условиях. В процессе окисления SO2 в SO3 используется катализатор на основе пентоксида ванадия. Чистый V2O5 проявляет низкую каталитическую активность, поэтому в катализатор добавляют в качестве активатора (промотора) сульфат калия. Установлено, что высокую каталитическую активность проявляют пиросульфованадаты калия. В интервале температур 673–873 К, в котором работают промышленные ванадиевые катализаторы, эти соединения находятся в расплавленном состоянии. Основной сульфованадат калия K2S2O7 V2O5, содержащийся в катализаторе, имеет температуру плавления 405–410 °С (678–683 К). Активный расплавленный пиросульфованадат калия распределен в катализаторе на поверхности пористого носителя.
Состав одного из отечественных катализаторов марки СВД (сульфованадатодиатомитового), мас.%: V2O5 – 7, К2О – 10, SO3 – 15, SiO2 – 62, CaO – 3.
Процесс окисления SO2 протекает в тонком слое расплава пиросульфованадата калия. Механизм процесса может быть представлен в виде следующих реакций:
К2О 2 SO3 V2O5 + SO2 = К2О SO3 SO2 V2O5+ SO3;
К2О SO3 SO2 V2O5= К2О 2SO3 V2O4;
К2О SO3 SO2 V2O5+SO2 +O2= К2О 2 SO3 V2O5 + SO3.
16
С учетом этого механизма получено кинетическое уравнение Борескова–Иванова, которое хорошо описывает промышленный процесс окисления SO2 в SO3:
|
|
|
PSO2 |
|
|
|
|
|
|
|
PSO3 |
|
|
2 |
|
|
r = k P |
|
|
|
|
1 |
− |
|
|
|
|
|
|
, |
|||
P |
|
+ A P |
|
|
|
|
|
|
|
|
||||||
O2 |
|
|
|
|
|
K |
|
P |
P |
0,5 |
|
|||||
|
SO |
|
SO |
|
|
|
|
р |
|
|
|
|
|
|||
|
|
2 |
|
3 |
|
|
|
|
SO2 |
|
O2 |
|
|
|||
где r – скорость реакции; k и Kр – константа скорости и константа равновесия; РSO2 , PSO3 и PO2 – текущие парциальные давления
участников реакции.
Анализ этого уравнения показывает, что основными параметрами, влияющими на скорость реакции, являются температура и концентрация кислорода, определяющая парциальное давление кислорода в газе.
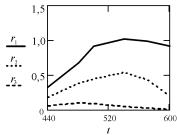
Температура влияет на скорость реакции сложным образом, так как с увеличением температуры растет константа скорости (в соответствии с уравнением Аррениуса), однако при этом уменьшается константа равновесия и, следовательно, уменьшается скорость процесса. Все это приводит к тому, что зависимость скорости от температуры проходит через максимум (рис. 1), т.е. в области низких температур скорость увеличивается, а в области высоких – уменьшается.
Характеристики, определяющие влияние температуры
на константу скорости, также изменяются с температурой. Так, для катализатора СВД значение энергии активации процесса при температуре менее 733 К равно 197 кДж/моль, в интервале темпе-
17
ратур 733–813 К – 38,6 кДж/моль, а при температуре более 813 К энергия активации равна нулю.
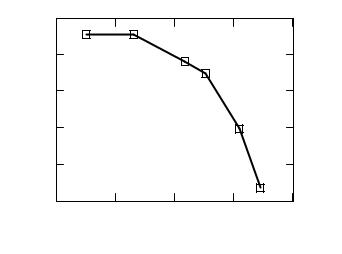
Эта зависимость в координатах log k – 1/Т приведена рис. 2. Таким образом, с точки зрения кинетики процесс окисления диоксида серы необходимо проводить при избытке кислорода. По мере увеличения степени превращения температура должна понижаться, т.е. оставаться вблизи линии оптимальных температур,
соответствующих максимальной скорости процесса.
|
0,28.28 |
|
|
|
|
loglogk |
0,06.06 |
|
|
|
|
–0,16. |
|
|
|
|
|
|
|
|
|
|
|
|
–0,38.38 |
|
|
|
|
|
–0,6 |
|
|
|
|
|
0.6 |
0. |
0. |
0. |
00,0011.0015 |
|
00,0011. |
||||
|
|
0,0012 |
0,0013 |
0,0014 |
|
|
|
|
1/T |
|
|
|
|
|
1/Т |
|
|
Рис. 2. Зависимость log k от 1/Т для катализатора СВД |
|||||
Так как каталитические процессы технологии неорганических веществ осуществляются, как правило, в аппаратах с неподвижным слоем катализатора, то реализация оптимального температурного режима обратимого экзотермического каталитического процесса возможна в аппаратах полочного типа, когда процесс проводится в нескольких слоях катализатора с промежуточным отводом тепла между слоями. Следовательно, процесс окисления SO2 в SO3 должен проводиться в каталитическом реакторе полочного типа с отводом тепла между полками катализатора.
18
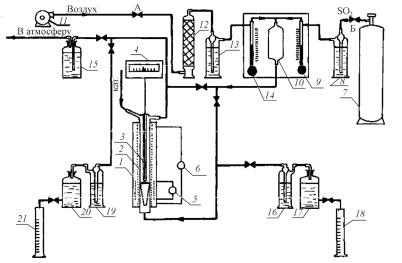
Практическая часть
Схема экспериментальной установки и порядок выполнения работы
Схема лабораторной установки для контактного окисления SO2 в SO3 приведена на рис. 3. Основным элементом установки является контактный аппарат, состоящий из электрической печи 1
икварцевой трубки 2, в которую помещается катализатор. Температура по высоте печи измеряется с помощью термопары 3
ирегистрируется потенциометром 4. Регулирование температуры в печи осуществляется автотрансформаторами 5 и 6.
Рис. 3. Схема установки для исследования контактного окисления SO2 в SO3: 1 – электрическая печь; 2 – реакционная трубка (кварцевая); 3 – термопара; 4 – потенциометр; 5, 6 – автотрансформаторы; 7 – баллон сSO2; 8 – дрексель; 9 – реометр для SO2; 10 – смеситель; 11 – воздуходувка; 12 – колонка с CaCl2; 13 – дрексель; 14 – реометр для воздуха; 15 – поглотительная склянка; 16, 19 – склянки для анализа; 17, 20 – аспираторы;
18, 21 – мерные цилиндры
19
Исходная газовая смесь готовится из диоксида серы и воздуха. Диоксид серы из баллона 7 проходит через дрексель 8, реометр 9
и поступает в смеситель 10. |
Воздух воздуходувкой 11 подается |
в систему осушки – колонку |
12 с хлористым кальцием идрек- |
сель 13, заполненный концентрированной серной кислотой. Затем поступает в смеситель 10 через реометр 14. Полученная таким образом газовая смесь направляется в контактный аппарат 2. Выходящие из зоны катализа газы проходят через склянку с поглотителем кислых компонентови выбрасываются в атмосферу.
Концентрацию диоксида серы до контактирования определяют йодометрически по Рейху с помощью склянки Дрекселя 16, аспиратора 17 и мерного цилиндра 18. Содержание диоксида серы после контактирования определяют тем же методом с помощью системы 19, 20, 21.
Работа проводится в следующем порядке:
1.С помощью вентиля А через систему пропускают определенное количество воздуха.
2.Включают печь и с помощью автотрансформаторов устанавливают необходимую температуру.
3.Через вентиль Б подают диоксид серы и устанавливают необходимую концентрацию его в исходной смеси.
4.После работы установки при заданных условиях в течение 15–30 мин (для достижения установившегося режима работы) приступают к анализу.
Йодометрический анализ газовой смеси
Для определения концентрации диоксида серы в газовой смеси перед контактированием в склянки 15 наливают пипеткой 10 мл 0,1 н. раствора йода, добавляют 50 мл дистиллированной воды и 0,5 мл крахмала. Газовую смесь при соответствующем положении кранов протягивают с помощью аспиратора 11 через склянку 16 до обесцвечивания йода. Воду, вытекающую из аспиратора, собирают в мерном цилиндре 18. Температуру
20
