
Лабораторный практикум по химической технологии неорганических веще
..pdf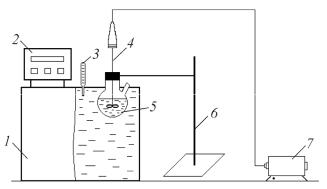
Схема экспериментальной установки и порядок проведения работы
Лабораторная установка состоит из водяного термостата 1 марки VT-14-02 с блоком автоматического регулирования температуры 2, реактора каустификации, представляющего собой стеклянную круглодонную двухгорловую колбу 5, мешалки с регулируемым числом оборотов 4, штатива для крепления реактора 6 и термометра 3 для контроля текущей температуры (рисунок).
Для проведения опыта в реактор заливают заданное количество (100–150 мл) проанализированного содового раствора, помещают его в термостат, запускают мешалку и включают нагрев термостата (температуру и концентрацию раствора задает преподаватель). Когда температура достигнет заданной величины (в пределах 50–90 °С), в реактор через боковое отверстие загружают небольшими порциями в течение 2–3 мин необходимое (рассчитанное) количество извести и отмечают время начала процесса каустификации (с момента загрузки извести).
Рис. Схемалабораторной установки: 1 – жидкостныйтермостат; 2 – блок автоматическогорегулированиятемпературы; 3 – термометр; 4 – мешалка; 5 – реактор каустификации; 6 – штатив; 7 – электропривод мешалки
Количество извести, необходимое для проведения каустификации, рассчитывают по уравнению с учетом концентрации
91
активной извести, найденной анализом концентрации содового раствора и количества этого раствора, взятого для опыта.
Процесс ведут в течение 45–60 мин, отбирая через каждые 15 мин пробы реакционной смеси для анализа. Пробы отбирают пробоотборником в количестве 10 мл (в цилиндр с делениями). Каждую из отобранных проб отфильтровывают (можно с помощью вакуум-насоса), замеряют объем фильтрата.
Отбирают пипеткой 5 мл фильтрата, переносят его в мерную колбу вместимостью 50 мл и доводят дистиллированной водой до метки. Фильтрат анализируют на содержание общей щелочности, гидроксида и карбоната натрия.
В зависимости от задания проводят опыты по каустификации с одной и той же концентрацией исходного содового раствора при разных температурах либо при одной и той же температуре, но различной концентрации соды в исходных растворах.
После окончания опыта останавливают мешалку, выключают нагрев термостата, удаляют реакционный сосуд из термостата.
Анализ растворов, получаемых в результате каустификации
Определение общей щелочности. Определение суммы NаОН
иNа2СО3 производят титрованием пробы анализируемой жидкости соляной кислотой в присутствии метилового оранжевого. Для этого отбирают из мерной колбы пипеткой 5 мл раствора и помещают в коническую колбу вместимостью 250 мл, добавляют 50 мл дистиллированной воды, 2–3 капли метилового оранжевого
ититруют 0,1 н. раствором соляной кислоты до перехода желтой окраски в розовую. Количество миллилитров соляной кислоты (а), пошедшее на титрование пробы, отвечает общей щелочности,
т.е. сумме NаОН + Nа2СО3.
Определение концентрации гидроксида натрия. При при-
бавлении раствора хлорида бария к жидкости, содержащей едкий натр и карбонат натрия, ион СО32− осаждается с образованием нерастворимого карбоната бария по реакции
92
Ва2+ + СО32− = ВаСО3.
При титровании осажденной пробы соляной кислотой в присутствии фенолфталеина можно найти содержание ионов ОН–, эквивалентное первоначальному содержанию NаОН в пробе.
Это титрование следует вести весьма осторожно, не оставляя долго раствор на воздухе и не взбалтывая его по следующим причинам: раствор, содержащий ионы ОН– и Ва2+, поглощает из воздуха диоксид углерода, в результате чего может уменьшиться определяемое количество NаОН; осадок ВаСО3 может частично реагировать с соляной кислотой.
Для определения едкого гидроксида натрия 5 мл раствора из мерной колбы отбирают пипеткой в коническую колбу вместимостью 250 мл, добавляют 50 мл дистиллированной воды и 2 мл 10%-го раствора хлорида бария. После осаждения карбоната бария к пробе добавляют 3–4 капли фенолфталеина и тотчас же титруют 0,1 н. раствором соляной кислоты при осторожном перемешивании.
Объем соляной кислоты (V, мл), пошедший на титрование пробы, отвечает содержанию в ней гидроксида натрия:
CNaOH = |
V 0,004 K 1000 10 |
, |
|
5 |
|||
|
|
где СNаОН – концентрация NаОН в растворе, г/л; V – объем 0,1 н. раствора НСl, пошедший на титрование, мл; 0,004 – количество
NаОН, соответствующее 1 мл точно 0,1 н. раствора НСl, г; K – коэффициент поправки.
Определение концентрации карбоната натрия. Концентра-
цию карбоната натрия в пробе вычисляют как разность между общей щелочностью раствора и содержанием в нем гидроксида натрия, т.е. содержание в пробе карбоната натрия отвечает (а–b) мл 0,1 н. раствора соляной кислоты:
CNaв р-реCO |
= |
(a −b) 0,0053 K 1000 10 |
, |
2 |
3 |
5 |
|
|
|
93
где Cв р-ре |
– концентрация Nа2СО3 в растворе, г/л; 0,0053 – ко- |
Na2CO3 |
|
личество Nа2СО3, соответствующее 1 мл точно 0,1 н. раствора НСl; K – коэффициент поправки.
По полученным аналитическим данным рассчитывают степень каустификации по формуле
|
|
|
|
|
исх |
|
|
в р-ре |
|
|
|
|
|
|
|
α = |
CNa |
CO |
−CNa CO |
100 %, |
|
||||
|
|
|
|
2 |
|
3 |
2 3 |
|
||||
|
|
|
|
|
Cисх |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
Na2CO3 |
|
|
|
|
|
где Cисх |
– концентрация Nа2СО3 в исходном содовом раство- |
|||||||||||
Na2CO3 |
|
|
|
|
|
|
|
|
|
|
||
ре, г/л; Cв р-ре |
– концентрация Nа2СО3 в растворах, получаемых |
|||||||||||
|
Na2CO3 |
|
|
|
|
|
|
|
|
|
|
|
при каустификации (через 15, 30, 45, 60 мин), г/л. |
|
|||||||||||
Результаты работы оформляют в виде таблицы. |
|
|||||||||||
|
|
|
|
|
Результаты опыта |
|
||||||
|
|
|
|
|
|
|
|
|
|
|||
Время от на- |
|
Темпера- |
|
|
|
Состав раствора |
Степень |
|||||
чала каусти- |
|
тура кау- |
исход- |
|
конечного |
каусти- |
||||||
фикации, мин |
|
стифика- |
ного |
|
|
|
|
фикации, |
||||
|
|
|
ции, °С |
|
Nа2СО3, |
Nа2СО3, |
Nа2СО3, |
NаОН, |
% |
|||
|
|
|
|
|
|
г/л |
г/л |
|
моль/л |
г /л |
|
|
15 |
|
|
|
|
|
|
|
|
|
|
|
|
30 |
|
|
|
|
|
|
|
|
|
|
|
|
45 |
|
|
|
|
|
|
|
|
|
|
|
|
60 |
|
|
|
|
|
|
|
|
|
|
|
|
Исследование кинетики процесса каустификации
Экспериментальные данные позволяют рассчитать константу скорости процесса, найти величину энергии активации, установить область протекания процесса. С этой целью данные анализов по изменению концентрации раствора соды во времени наносят на график в координатах СА (моль/л) – τ (мин).
Реакция каустификации предположительно может быть описана бимолекулярной реакцией типа А + В = 2 С + Д, дифференциальное уравнение которой имеет вид
94
|
|
|
|
− |
dCA |
|
= k CA CB . |
|||||
|
|
|
dτ |
|||||||||
|
|
|
|
|
|
|
|
|
||||
|
Если СА = СВ, то данная реакция может описываться уравне- |
|||||||||||
нием |
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
− |
dCA |
= k CA2 . |
||||
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
dτ |
||||
|
После преобразования и интегрирования правой и левой |
|||||||||||
части получим |
|
|
|
|||||||||
|
|
|
|
|
1 |
= |
|
1 |
+ k τ. |
|||
|
|
|
|
|
|
|||||||
|
|
|
|
|
CA |
CAo |
||||||
|
Данное уравнение является уравнением прямой в координа- |
|||||||||||
тах |
1 |
−τ. |
|
|
|
|||||||
|
|
|
|
|||||||||
|
СА |
|
|
|
|
|
|
|
|
|
|
|
|
Прямая на оси ординат отсекает отрезок, численно равный |
|||||||||||
величине |
1 |
, а тангенс угла наклона прямой к оси абсцисс – ве- |
||||||||||
|
||||||||||||
|
|
|
СА |
|
|
|
||||||
личине k, т.е. величине константы скорости.
В задачу исследований кинетики процесса входит определение величины константы скорости реакции. Поэтому экспериментальные значения концентрации Nа2СО3 (моль/л) наносят на
график |
1 |
−τ. Если точки укладываются на прямую линию, не |
|
||
|
СА |
|
проходящую через начало координат, то механизм реакции выбран правильно и по графику определяют константу скорости.
Опыты проводят при различных температурах и в каждом случае находят константу скорости реакции. По полученным данным определяют кажущуюся энергию активации согласно уравнению Аррениуса:
|
k1 |
|
E |
|
1 |
|
1 |
|
|
|
ln |
= |
|
− |
|
, |
|||||
k2 |
R |
|
T1 |
|||||||
|
|
T2 |
|
|
|
|||||
95
где k1 – константа скорости при Т1; k2 – константа скорости при Т2; Е – энергия активации процесса; R – универсальная газовая постоянная.
По величине энергии активации делают вывод о механизме реакции (области еепротекания), о путях интенсификации процесса.
Список литературы
1.Крашенинников С.А. Технология соды. – М.: Химия, 1988. – 304 с.
2.Зайцев И.Д., Ткач Г.А., Стоев Н.Д. Производство соды. –
М.: Химия, 1986. – 312 с.
3.Чарыков А.К. Математическая обработка результатов химического анализа: Методы обнаружения и оценки ошибок. – Л.:
Химия, 1984. – 166 с.
Работа 11. КИНЕТИКА РАЗЛОЖЕНИЯ КАРБОНАТА КАЛЬЦИЯ
Цель работы – исследование кинетики разложения карбоната кальция с использованием методов термического анализа.
Теоретическая часть
Теоретические основы разложения карбоната кальция
Природный карбонат кальция входит в состав основных карбонатных пород: мела, известняка, мрамора. Известняк применяется как строительный материал, как исходный продукт для получения извести, как наполнительдля резиновых смесей, бумаги ит.д.
Прокаливанием карбонатного сырья, в первую очередь известняка, при высоких температурах получают углекислый газ и известь, которые используются в производстве кальцинированной соды.
Разложение содержащегося в известняке карбоната кальция протекает по обратимой эндотермической реакции
96

CaCO3 = CaO+CO2 – 177,73 кДж/моль.
Равновесие реакции определяется из уравнения
Ka = fCO2 aCaO ,
aCaCO3
где fCO2 – летучесть диоксида углерода; aCaO, aCaCO3 – активности конденсированных фазCaO и CaCO3; Ka – константаравновесия.
При неизменном составе конденсированных фаз CaO и CaCO3 их активности равны 1 и константа равновесия будет определяться парциальным давлением диоксида углерода, так как при высоких температурах газообразный продукт реакции является идеальным газом и Kа = K p = РСО2 .
В соответствии с уравнением Вант-Гоффа величину Kр можно определить как функцию температуры:
d lndTK p = R∆HT 2 .
Для эндотермической реакции разложения карбоната кальция Kр с увеличением температуры увеличивается, следовательно, с точки зрения термодинамики процесс необходимо проводить при высоких температурах. Равновесие реакции разложения карбоната кальция сдвигается в правую сторону при температуре более 800–850 °С. В практических условиях процесс обжига известняка проводят в шахтных печах при температуре 1100– 1200 °С.
Кинетика разложения карбоната кальция
Реакция разложения карбоната кальция относится к классу топохимических реакций. Топохимической называется гетерогенная реакция, в которой участвуют твердое исходное вещество и твердый продукт реакции. Чаще всего это реакция термического разложения твердых веществ типа: Атв = Втв + Сгаз.
97
К таким реакциям относится диссоциация карбонатов. Топохимические реакции протекают на границе между твердым исходным веществом и твердым продуктом химического превращения, при этом твердый продукт образуется в виде отдельных зародышей или ядер. Скорость реакции будет определяться числом зародышей, скоростью их образования и роста.
Для анализа кинетики реакций термического разложения твердых веществ широко используется уравнение, известное также как уравнение Колмогорова–Ерофеева–Аврами:
x =1−e−k tn ,
где х – степень превращения исходного вещества; k – обобщенная константа скорости; n – показатель степени, значения которого даны в табл. 1; t – время.
|
|
|
|
Таблица 1 |
||
Характеристические параметры кинетического |
||||||
уравнения зародышеобразования – роста |
|
|
||||
|
|
|
|
|
|
|
|
|
Химическая |
Диффузия |
|||
Тип зародыше- |
Геометрия роста |
реакция (линей- |
(параболический |
|||
образования |
зародышей |
ный закон) |
|
закон) |
||
|
|
n |
E |
n |
|
E |
Мгновенное |
Объемныемеханизмы |
|
ЕG |
|
|
ED/2 |
зародышеобра- |
Одномерныйрост |
1 |
0,5 |
|
||
зование(насы- |
Двумерныйpocт |
2 |
2ЕG |
1 |
|
ED |
щениемест, |
Трехмерныйрост |
3 |
3ЕG |
1,5 |
|
3ED/2 |
доступныхдля |
Поверхностный |
|
|
|
|
|
зародышеобра- |
механизм |
|
2ЕG |
|
|
ED |
зования до на- |
Двумерныйрост |
2 |
1 |
|
||
чала процесса) |
|
|
|
|
|
|
Постоянная |
Объемныемеханизмы |
|
ЕG+EN |
|
|
ЕD/2+EN |
скоростьгомо- |
Одномерныйрост |
2 |
1,5 |
|
||
генногозароды- |
Двумерныйрост |
3 |
2ЕG+EN |
2 |
|
ЕD+EN |
шеобразования |
Трехмерныйрост |
4 |
3ЕG+EN |
2,5 |
|
3ЕD/2+EN |
втечениепро- |
Поверхностный |
|
|
|
|
|
цесса |
механизм |
|
2ЕG+EN |
|
|
ЕD+EN |
|
Двумерныйрост |
3 |
2 |
|
||
98 |
|
|
|
|
|
|
В табл. 1 EN – парциальная энергия зародышеобразования, EG – парциальная энергия роста зародышей; ED – парциальная энергия диффузии.
Общая энергия активации процесса является суммой парциальной энергии зародышеобразования, парциальной энергии роста зародышей и парциальной энергии диффузии, а показатель степени n зависит от формы зародышей, пространственной мерности их роста и скорости их образования.
Таким образом, значение показателя степени в определенной мере связано с механизмом процесса.
Для исследования кинетики разложения карбоната кальция в работе используются методы термического анализа.
Термический анализ
Термический анализ – это группа методов, в которых изменение физических и химических свойств регистрируется, как функция температуры или времени, при нагревании или охлаждении по определенной температурной программе.
Обычно выделяют несколько методов, отличающихся друг от друга тем, какое свойство материала измеряется, в частности:
•дифференциально-термический анализ(ДТА): температура;
•дифференциально-сканирующая калориметрия (ДСК): те-
плота;
•термогравиметрический анализ (ТГА): масса;
•анализ выделяемых газов (ГТА): газовые продукты разло-
жения.
Вработе для исследования кинетики разложения карбоната кальция используем термогравиметрический анализ на приборе фирмы NETZSCH в сочетании с программным обеспечением для кинетического анализа термических данных NETZSCH Thermokinetiks.
Программное обеспечение позволяет оценить стадийность реакции разложения и найти кинетическое уравнение, которое наилучшим образом описывает экспериментальные данные.
99
Оценка стадийности реакции проводится путем обработки экспериментальных данных по одному из трех методов модель- но-независимой оценки кинетических параметров, например, по методу Озавы–Флинна–Уолла. После проверки стадийности для одностадийных реакций проводится выбор типа реакции и ее кинетической модели с использованием многовариантной линейной регрессии.
В программе анализируются типы реакций и их кинетических уравнений, приведенные в табл. 2.
Общий вид уравнения dx/dt = A·exp(–E/RT)·f(x).
|
|
|
Таблица 2 |
||
Типы реакций и соответствующие им уравнения |
|
||||
|
|
|
|
||
Обозначение |
f(x) |
Тип реакции |
|
||
F1 |
1–x |
Реакция первого порядка |
|
||
F2 |
(1–x)2 |
Реакция второго порядка |
|
||
Fn |
(1–x)n |
Реакция n-го порядка |
|
|
|
R2 |
2(1–x)1/2 |
Двумерная |
реакция |
на |
границе |
|
3(1–x)2/3 |
раздела фаз |
|
|
|
R3 |
Трехмерная |
реакция |
на |
границе |
|
|
|
раздела фаз |
|
|
|
D1 |
0,5/(1–x) |
Одномерная диффузия |
|
||
D2 |
–1/ln(x) |
Двумерная диффузия |
|
|
|
D3 |
1,5·x1/3(x–1/3 – 1) |
Трехмернаядиффузия(типЯндера) |
|||
D4 |
1,5/(x–1/3 – 1) |
Трехмерная диффузия (тип Гигст- |
|||
|
2·(1–x)·( –ln(1–x))1/2 |
линга–Броунштейна) |
|
|
|
A2 |
Двумерное зародышеобразование |
||||
A3 |
3·(1–x)·( –ln(1–x))2/3 |
Трехмерное зародышеобразование |
|||
An |
n·(1–x)·( –ln(1–x)))n–1/n |
n-мерное зародышеобразова- |
|||
|
|
ние/рост ядер согласно Аврами– |
|||
|
|
Ерофееву |
|
|
|
В результате расчетов дается оценка параметров рассмотренных моделей и определяется их адекватность.
100
