
Лабораторный практикум по химической технологии неорганических веще
..pdf
Практическая часть
Описание прибора для проведения термического анализа
Внешний вид прибора фирмы NETZSCH показан на рис. 1, а, принципиальная схема прибора – на рис. 1, б.
а |
б |
Рис. 1. Внешний вид (а) и принципиальная схема (б) прибора |
|
фирмы NETZSCH |
|
Основные технические характеристики: |
|
диапазон измерений температуры.................................. |
35–1650 °С; |
диапазон измерений энтальпии................................... |
1–100 кДж/кг; |
диапазон измерений теплоемкости................... |
100–3000 Дж/(кг·К); |
предел допускаемой основной относительной |
|
погрешности измерения температуры................................... |
±1,5 %; |
предел допускаемой основной относительной |
|
погрешности измерения энтальпии.......................................... |
±3 %; |
предел допускаемой основной относительной |
|
погрешности измерения теплоемкости................................. |
±2,5 %; |
сходимость температурных измерений |
|
(по стандартному образцу) ....................................................... |
0,3 К; |
калориметрическая чувствительность.................... |
0,5–15 мкВ/мВт; |
|
101 |
диапазон показания массы................................................. |
0–5000 мг; |
дискретность показаний потери массы................................. |
0,1 мкг. |
Методика исследования кинетики разложения карбоната кальция
До начала проведения термических исследований стоит подробнее остановиться на требованиях, которые предъявляются к исследуемому образцу. Материала должно быть столько, чтобы можно было покрыть дно тигля. При взятии навесок в данной работе использовались внутренние весы прибора.
Последовательность операций:
1.Берем пустой тигель, устанавливаем на держатель, ждем установки веса тигля.
2.Извлекаем тигель, заполняем веществом (в данном случае
СаСО3), используя только инструмент (руками трогать тигель нельзя).
3.Ставим тигель с навеской обратно в прибор, закрываем.
4.Переходим к ПО на компьютере, устанавливаем расход газов, создаем температурную программу (интервал температур, скорость нагрева, количество точек сканирования).
5.Проверяем начальные условия и нажимаем запуск.
Обработка полученных данных. Запускаем программу рас-
чета и открываем файл с данными. Используем сглаживание, вычисление 1-й производной, вычисление изменения массы, вычисление температуры, начала, площади пика. Сохраняем результат.
Для исследования кинетики необходимо произвести несколько измерений (не менее трех).
Переходим в программу для кинетики. Проверяем полученные модели, определяем стадийность и тип реакции, выявляем нужные нам параметры.
102
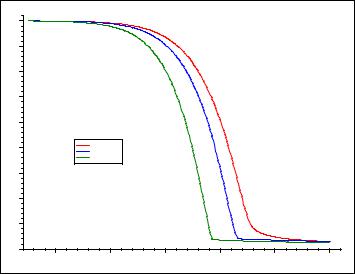
Результаты исследования и их обработка
Результаты термогравиметрического анализа представлены на рис. 2.
NETZSCH Thermokinetics |
Kinetic |
Mass/a.u. |
|
|
|
|
|
95 |
|
|
|
|
|
85 |
|
|
|
|
|
75 |
29.9 K/min |
|
|
|
|
20.0 K/min |
|
|
|
|
|
|
|
|
|
|
|
|
10.0 K/min |
|
|
|
|
65 |
|
|
|
|
|
55 |
|
|
|
|
|
600 |
700 |
800 |
900 |
1000 |
1100 |
|
|
Temperature/°C |
|
|
|
Рис. 2. Зависимость массы образца (%) от температуры |
|||||
|
при различной скорости нагревания |
|
|||
В результате модельно-независимого анализа найдено значение энергии активации – 191 кДж/моль.
График, представленный на рис. 3, указывает на одностадийность реакции, так как угол наклона одинаков.
Для выбора наиболее адекватной кинетической модели одностадийной реакции в программе NETZSCH Thermokinetiks используется многовариантная линейная регрессия. Этот метод основан на том, что для одностадийных реакций определение кинетических параметров может быть сведено к нахождению параметров уравнений линейной регрессии, полученных после преобразования кинетических уравнений при условии постоянства степени превращения. Перед преобразованием интегральные
103

экспериментальные величины, к которым относятся данные ТГА, дифференцируются.
Ozawa-Flynn-Wall Analysis |
Kinetic |
log Heating rate/(K/min)
|
0.98 |
|
|
|
0.02 |
|
1.5 |
|
|
|
|
|
|
1.4 |
|
|
|
|
|
|
1.3 |
|
|
|
|
|
|
1.2 |
|
|
|
|
|
|
1.1 |
|
|
|
|
|
|
1.0 |
|
|
|
|
|
|
0.75 |
0.80 |
0.85 |
0.90 |
0.95 |
1.00 |
1.05 |
|
|
|
1000 K/T |
|
|
|
Рис. 3. Результаты обработки экспериментальных данных по методу Озавы–Флинна–Уолла
К примеру, для уравнения, соответствующего реакции с n-мер- ным зародышеобразованием и ростом ядер согласно Аврами– Ерофееву, дифференцирование и преобразование приводит к следующему уравнению:
ln dx1−/ xdt = ln(n A) − RTE + n n−1 ln(−ln(1− x).
Это уравнение может быть представлено в виде уравнения линейной регрессии
у = а0 + а1·х1 + а2·х2,
104

|
dx / dt |
|
х1 = 1/Т, х2 = ln(–ln(1–х)), а0 = ln(n·A), а1 = |
|||
где |
y = ln |
|
|
, |
||
1− x |
||||||
|
|
|
|
|
||
= –Е/R, а2 = n/(n–1).
После нахождения параметров уравнения регрессии определяются параметры кинетического уравнения.
Для выбора адекватной кинетической модели проводится сравнение нескольких выбранных моделей с использованием критерия Фишера.
В рассматриваемом примере в качестве возможных кинетических моделей выбраны модели типа A1, A2, An, D1, D2, D3, D4, R1, R2 (см. табл. 2).
Результаты сравнения адекватности кинетических моделей по критерию Фишера:
Сравнение адекватности кинетических моделей показало, что наименьшее значение критерия Фишера зафиксировано для кинетической модели реакции типа An.
Результаты обработки экспериментальных данных и нахождения кинетических параметров кинетической модели реакции типа An:
105

Таким образом, найдена кинетическая модель процесса разложения карбоната кальция, которая позволяет рассчитывать степень разложения при заданных температуре и времени.
Для этой модели зависимость обобщенной константы скорости от температуры описывается выражением k = 145,23·ехр(–191700/8,31·Т), при этом n = 1,5.
Проверочное задание. Рассчитать степень разложения карбоната кальция при температуре 700 °С и времени 15 мин.
106
Список литературы
1.Шестак Я. Теория термического анализа: Физико-хими- ческие свойства твердых неорганических веществ: пер. с англ. –
М.: Мир, 1987. – 456 с.
2.Пилоян Г.О. Введение в теорию термического анализа. –
М.: Мир, 1987. – 232 с.
Работа 12. ПОЛУЧЕНИЕ МАГНЕЗИИ
Теоретическая часть
Свойства и применение магнезий. Магнезиями называют оксид, гидроксид и основной карбонат магния.
Применение магнезии в той или иной отрасли обусловлено ее физико-химическими свойствами, которые зависят от условий получения. Различные сорта магнезий отличаются по своей химической активности, объемному весу, адсорбционной способности. Чем более дисперсна и пориста магнезия, тем большей активностью и меньшим объемным весом она обладает, поэтому о качестве магнезии судят по ее легкости.
Основной карбонат магния – 3MgCO3·Mg(OH)2·3H2O – плохо растворим в воде, при нагревании до 400 °C и выше разлагается с образованием оксида магния. Основная соль карбоната магния – наиболее легкая и рыхлая магнезия (магнезия альба) – применяется как наполнитель и усилитель в резиновых смесях, для изготовления высококачественных теплоизоляционных материалов и в медицине.
Оксид магния MgO (жженая магнезия или магнезия уста) – легкий белый порошок, поглощающий на воздухе пары воды и углекислый газ с образованием гидроксида и карбоната магния. Оксид магния плохо растворим в воде, но легко растворяется в кислотах и растворах солей аммония. Нагревание оксида магния выше 500 °C приводит к рекристаллизации MgO, сопровождающейся уменьшением удельной поверхности, а при 1200–1600 °C
107
образуются крупные кристаллы, оксид магния становится твердым и теряет способность соединяться с водой и растворяться в кислотах. Легкие сорта жженой магнезии применяются в резинотехнической и шинной промышленности в качестве наполнителей в резиновых смесях и усилителей свойств резины. В металлургической промышленности они применяются в качестве термостойкого защитного покрытия электротехнических сталей, в нефтяной промышленности для отбеливания нефтепродуктов. Используются также в химической и других отраслях промышленности. Менее легкие сорта жженой магнезии (каустический магнезит) применяют для изготовления цементов, строительных материалов. Тяжелые сорта жженой магнезии (металлургический порошок) идут на изготовление различных огнеупорных материалов. Жженая магнезия является также исходным сырьем
впроизводстве магния термическим способом, по которому MgO подвергают прямому восстановлению углеродом, кремнием или карбидом кальция при высоких температурах.
Сырье для получения магнезий. Сырьем для получения маг-
незий служат различные магнийсодержащие минералы. В свободном виде магний в природе не встречается и находится только
ввиде различных соединений, чаще всего в виде силикатов, карбонатов, хлоридов и сульфатов. К силикатам относятся, например,
оливин (Mg,Fe)2SiO2, серпентин 3MgO·2SiO2·2H2O, тальк
3MgO·4SiO2·H2O; к карбонатам – магнезит MgCO3 и доломит MgCO3·CaCO3; к хлоридам – бишофит MgCl2·6H2O, карналлит KCl·MgCl2·6H2O; к сульфатам – кизерит MgSO4·H2O, каинит
MgSO4·KCl·3H2O, лангбейнит 2MgSO4·K2SO4 и др. В природе встречается также гидроксид магния Mg(OH)2 в виде минерала брусита.
Большинство из перечисленных соединений магния являются породообразующими минералами. Меньшая часть их, главным образом хлориды и сульфаты, содержится в морской воде и в воде соляных озер. В морской воде находится около 3,7 % общего количества магния, содержащегося в земной коре.
108
К основным видам промышленного сырья для производства магнезий относятся магнезит, доломит, а также природные растворы, содержащие хлорид магния: морская и озерная вода.
Магнезит – это минерал, отвечающий химической формуле карбоната магния MgCO3.
Техническим магнезитом называют горную породу, состоящую в основном из минерала магнезита и сопутствующих ему примесей (карбонаты кальция, железа, марганца, а также диоксид кремния).
Магнезит различных месторождений (Челябинская обл., Иркутская обл., Красноярский край, Хабаровский край) имеет следующий состав (в пересчете на оксиды, мас.%): MgO – 41–47; CaO – 0,3–1,9; Al2O3 и Fe2O3 – 0,4–1,9; SiO2 – 0,2–1,8; летучие вещества (CO2 и H2O) – 46–52.
Доломит – это минерал, отвечающий по составу химической формуле двойного карбоната магния и кальция MgCO3·CaCO3 и теоретически содержащий 30,4 % CaO; 21,8 % MgO; 47,8 % CO2. Теоретическое весовое отношение CaO : MgO равно 1,39.
Технический доломит – карбонатная горная порода, содержащая примеси – кварц, глинистые вещества, кальцит, гипс и др.
Доломит различных месторождений (Щелкинское месторождение в Московской обл., Саткинское – в Челябинской, Изверское – в Ленинградской и др.) содержит, мас.%: MgO – 19–22; CaO – 28–32; Al2O3 и Fe2O3 – 0,2–2,8; SiO2 – 0,1–4,7; летучие вещества (CO2 и H2O) – 44–48.
Самым распространенным источником растворенных солей магния является морская вода. Общая концентрация солей в морской воде колеблется в широких пределах. Так, в окраинных морях, куда поступает много пресных вод с суши, она может быть в несколько раз ниже, и, наоборот, в изолированных морях, расположенных в районах с жарким климатом, она бывает несколько выше. Наибольшее количество солей магния содержится в воде океанов (0,33–0,38 % MgCl2 и 0,16–0,22 % MgSO4). Вода соляных озер по сравнению с морской представляет собой более концентрированные растворы солей, в том числе и магниевых.
109
Хлормагниевые растворы. При переработке природных калийных солей (карналлита, каинита, лангбейнита, полигалита) с целью получения из них калийных удобрений образуется большое количество маточных растворов, содержащих 25–28 % MgCl2
инезначительное количество (до 3 %) MgSO4, KCl и NaCl. Эти растворы, являющиеся отходом производства, могут служить исходным сырьем для получения соединений магния.
Брусит – природное минеральное сырье, содержащее 53–57 %
Mg(OН)2 (в пересчете на MgO); 5–7 % Са (в форме оксида, карбоната и т.п.) и другие примеси.
Хризотил-асбест – минерал группы серпентина, представляю-
щий собой силикат магния Mg[Si4O10](OH)8 или 3MgO·2SiO2·2H2O,
находит широкое применение в промышленности. При обогащении этого вида сырья образуется значительное количество отхода – серпентинит, содержащий до 24 % магния в виде серпентина. Так, например, отходы производства асбеста ОАО «Ураласбест» содержат, мас.%: Mg – 20–22; Si – 37–39; Ca – 5–6; Fe – 5–6; Al – 0,6–0,7 и некоторые количества никеля, хрома, марганца и др. В настоящее время эти отходы практически не перерабатываются
ивывозятся в отвал. Однако в связи с высоким содержанием магния серпентинит относится к весьма ценному и перспективному минеральному сырью для получения различных магнийсодержащих товарных продуктов.
Получение тяжелых форм магнезии. Тяжелые формы маг-
незии получаются при обжиге магнезита и доломита. При этом в зависимости от температурного режима обжига получают каустический магнезит, идущий на изготовление цементов и строительных материалов, и металлургический порошок, используемый в огнеупорной промышленности. Тяжелые формы магнезии могут быть получены в результате термического разложения сульфата магния, илипутемокисления игидролиза хлоридамагния.
Обжиг магнезита. При высокотемпературной обработке магнезит декарбонизуется и превращается в MgO. Реакция разложения карбоната магния
110
