
Поверхностно-активные вещества в золь-гель технологии
..pdf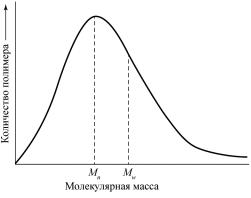
4) ионизующиеся полимеры − полиэлектролиты (полиакриловая кислота).
Предметом нашего рассмотрения являются водорастворимые полимеры, которые представляют наибольший интерес для процессов золь-гель технологии. Ионизующиеся полимеры также относятся к типу водорастворимых полимеров.
Важнейшей характеристикой полимеров является молекулярная масса. За исключением белков почти невозможно найти полимер, в котором все макромолекулы имели бы одну и ту же молекулярную массу. Синтетические полимеры, а также полисахариды характеризуются распределением по молекулярным массам, которое зависит от метода синтеза полимера и способов фракционирования. Схематически молекулярно-массовое распределение полимера показано на рис. 46.
Рис. 46. Схемараспределенияполимера помолекулярныммассам
Некоторые физические свойства полимеров более чувствительны кналичию низкомолекулярных фракций, другие− кналичию высокомолекулярныхфракций.
Величину молекулярно-массовой полидисперсности можно получить, определив среднюю молекулярную массу двумя ме-
61
тодами с различным способом усреднения. Среднечисленная молекулярная масса Mn определяется как
Mn = ΣNi Mi ,
ΣNi
где Ni − число молекул, имеющих молекулярную массу Mi. Величину Mn можно определять по понижению точки за-
мерзания, по осмотическому давлению, а также с помощью химического анализа концевых групп.
Другая усредненная характеристика − средневесовая молекулярная масса Mw, когда усредняющим множителем служит масса w. Средневесовая молекулярная масса определяется как
M w = |
Σw M |
i |
= |
ΣN |
M 2 |
i |
i |
i . |
|||
Σwi |
|
||||
|
|
|
ΣNi Mi |
||
Экспериментально величину Mw можно найти методами светорассеяния, классического или квазиупругого. Молекулярная масса Mw чувствительна к высокомолекулярным фракциям, поэтому всегда превышает величину Mn. При определении молекулярной массы методом светорассеяния очень важно контролировать условия для избежания загрязнения дисперсными частицами, например пылью, поскольку это будет сильно влиять на результат. Отношение средневесовой молекулярной массы к среднечисленной молекулярной массе (Mw/Mn) служит мерой полидисперсности образца. Образец можно считать монодисперсным, если это соотношение не превышает 1,1.
Растворение полимеров
Процесс растворения полимера начинается с того, что растворитель, более подвижный, чем полимерные цепи, проникает между ними и вызывает набухание полимера. Оно характерно для всех полимеров и никогда не наблюдается в низкомолекулярных веществах. Набухание заключается в следующем: прежде чем перейти в раствор, полимер, поглощая значительное количество низкомолекулярной жидкости – растворителя, увеличивается в объеме и массе (рис. 47).
62

а б в г
Рис. 47. Стадиирастворенияполимера: а– системаполимер– растворитель донабухания; б– перваястадиянабухания(сольватациямолекулполимера);
в– втораястадиянабухания(заполнениепромежутковмеждумолекулами);
г– началорастворенияполимера
При растворении полимеров молекулы низкомолекулярной жидкости проникают в погруженный в нее полимер. Это возможно потому, что цепочечные молекулы полимера гибкие: их звенья, изгибаясь, создают неплотную упаковку макромолекул. Молекулы низкомолекулярной жидкости, проникая в полимер, заполняют свободные пространства между макромолекулами. Молекулы растворителя начинают раздвигать звенья цепей полимера друг от друга, ослабляя межмолекулярное взаимодействие и разрыхляя полимер. В образующиеся пустоты между макромолекулами устремляются новые молекулы растворителя. В результате расстояние между макромолекулами увеличивается, что приводит к увеличению объема образца. Жидкость, поглощенная на первой стадии набухания, идет на сольватацию полярных групп полимера. Измерения показывают, что энергетически прочно с полимером связывается небольшое количество жидкости – 1 моль на 1 моль полярных групп полимера.
Специфика набухания полимеров заключается в том, что взаимодействуют и смешиваются молекулы, различающиеся между собой на много порядков по своим размерам и подвижности. Процесс набухания представляет собой одностороннее смешение, обусловленное большим различием в размерах молекул.
63
Набухший полимер становится очень |
вязким |
и липким. |
В результате весь полимер налипает на |
стенки |
контейнера. |
На следующей стадии процесса растворения полимерные цепи распутываются и диффундируют из геля в растворитель. Это медленный процесс, поскольку динамика полимерных цепей, которая, в свою очередь, зависит от молекулярной массы полимера, является лимитирующей стадией растворения. Полимер, налипший на стенки контейнера, имеет небольшую площадь контакта с растворителем, поэтому растворение занимает много времени.
Известны некоторые приемы, позволяющие преодолеть проблему растворения полимеров. В промышленности применяют разбавление готовых высококонцентрированных растворов полимера. Другой путь − использование порошкообразных полимеров и интенсивное перемешивание на начальных стадиях набухания. При этом частицы полимера не агломерируют, а, наоборот, начинают растворяться. Таким образом, процесс растворения будет протекать на несколько порядков быстрее, поскольку суммарная площадь полимерных частиц гораздо больше, чем у полимера, налипшего на стенки контейнера.
Вязкость растворов полимеров является важной технологической характеристикой и зависит от многих параметров. Измерение вязкости проводят на вискозиметрах истечения (для растворов с низкой концентрацией) или на ротационных вискозиметрах.
Фазовое разделение растворов полимеров
В растворах двух жидкостей молекулы «свободно блуждают» внутри сосуда, следствием чего является большая энтропия жидкой смеси. В полимере сегменты связаны друг с другом, образуя «гирлянды». Поэтому энтропия одного сегмента полимера намного меньше, чем энтропия свободной молекулы растворителя. Таким образом, растворы полимеров имеют пониженную суммарную энтропию, и, следовательно, они менее стабильны
64
и более склонны к фазовому разделению, нежели смеси обычных низкомолекулярных жидкостей.
В 1941–1942 годах П. Флори и М.Л. Хаггинс выдвинули теорию растворов полимеров на основе квазикристаллической модели раствора. Эта теория позволила рассчитать энтропию смешения полимера с растворителем. Кроме того, Флори показал, что для каждого разбавленного раствора полимера существует такая температура, при которой он ведет себя как идеальный раствор. Флори назвал температуру, при которой раствор становится идеальным (тэта-точкой). В настоящее время известная как температура Флори, она является фундаментальным параметром при определении формы макромолекул.
Растворы полимера с большой молекулярной массой менее устойчивы по отношению к фазовому разделению, чем растворы того же полимера с низкой молекулярной массой. Следовательно, при фазовом разделении раствора полимера высокомолеку-
лярные |
частицы выделяются из раствора в первую очередь, |
а более |
низкомолекулярные частицы остаются в растворе. |
На этом явлении основано фракционирование полимеров по молекулярной массе.
Температура, при которой происходит фазовое разделение 1%-ного раствора полимера, называется точкой помутнения. Называется она так из-за резкого помутнения раствора полимера при достижении этой температуры.
Самую высокую или самую низкую температуру, при которых происходит фазовое разделение, называют критической температурой, а соответствующая концентрация полимера называется критическим составом. Температура и концентрация при этих условиях называется критической точкой.
Для большинства систем полимер – растворитель устойчивость к фазовому разделению понижается с уменьшением температуры. В таких системах при достаточном понижении температуры происходит фазовое разделение раствора. При этом отделяется фаза концентрированного раствора, которая находится
65
в равновесии с разбавленным раствором полимера. Фазовое разделение раствора полимера можно вызвать и добавлением нерастворяющей жидкости к системе полимер – растворитель.
Тэта-температура является одним из важнейших параметров, описывающих систему полимер – растворитель. При этой температуре сегменты полимера не могут «различить», находятся они в контакте друг с другом или в контакте с молекулами растворителя. При этом полимер будет принимать конфигурацию, которой он обладал бы в жидком состоянии. Можно сказать, что полимер находится в «невозмущенном» состоянии по размеру.
При температуре выше тэта-температуры сегменты полимера стремятся контактировать преимущественно с молекулами растворителя, а не находиться в контакте друг с другом. Это приводит к увеличению клубка макромолекулы.
При температуре ниже тэта-температуры сегменты полимера предпочтительно взаимодействуют между собой, а не смолекуламирастворителя. Приэтоммакромолекуласжимается.
Тэта-температуру называют также температурой Флори, а растворитель или смесь растворителей, использующихся при этой температуре, называют тэта-растворителем.
Повысить устойчивость коллоидных частиц или капелек эмульсий против флокуляции можно за счет адсорбции полимера на поверхности частиц. Если частица достаточно хорошо покрыта полимером, а сегменты полимера распространяются в раствор, частица ведет себя как полимер с бесконечно большой молекулярной массой. Такая система будет подвергаться флокуляции при тех же условиях, когда система полимер – растворитель оказывается в тета-условиях.
В случае использования в качестве растворителя воды все описанные эффекты характерны для водорастворимых полимеров, к числу которых относятся:
1) неионные водорастворимые полимеры с атомами кислорода в основной цепи (полиэтиленоксид);
66

2)полимеры, содержащие группы акриловой кислоты (полиакриламид);
3)неионные полимеры с виниловыми группами (поливиниловый спирт);
4)высокомолекулярные соединения природного происхождения (производные целлюлозы, полисахариды).
На рис. 48 приведена формула хитозана – одного из природных полисахаридов, нашедшего применение в качестве корма для животных, для изготовления продуктов питания и косметики, для создания саморассасывающихся хирургических шовных материалов, искусственных сосудов и т.д.
Основным источником хитозана является хитин. В естественном состоянии он находится в панцирях морских крабов, креветок, криля, омаров, лангустов, раков, а также в наружном скелете зоопланктона. Содержится хитин и в крыльях насекомых.
Рис. 48. Структурнаяформула водорастворимогополимера− хитозана
Полимерные ПАВ, обладающие поверхностной ак-
тивностью, можно получить тремя способами:
1)прививая гидрофобные цепи к гидрофильному полимерному остову (основной цепи);
2)прививая гидрофильные цепи к гидрофобному полимерному остову;
67
3) чередуя в макромолекуле гидрофильные и гидрофобные участки.
Поверхностно-активные полимеры чаще всего используются для стабилизации дисперсий и регулирования реологических свойств. Интерес к ним обусловлен двумя уникальными свойствами:
1.Они обладают большим сродством к межфазным границам, что приводит к их аккумулированию на межфазных границах независимо от физико-химических факторов, т.е. они эффективно действуют при низких концентрациях и нечувстительны к действию солей и изменению температуры.
2.Высокомолекулярные ПАВ являются чрезвычайно эффективными стабилизаторами дисперсных систем, действующими по стерическому механизму, и могут, в частности, эффективно предотвращать загрязнение поверхностей.
На практике обычно применяют не отдельные ПАВ и водорастворимые полимеры, а композиционные продукты различных составов, которые содержат несколько полимеров и ПАВ. При этом в большинстве случаев хорошо подобранная композиция позволяет достичь синергетического эффекта.
Важнейшим свойством ПАВ является снижение поверхностного натяжения между водным раствором и другой фазой. Для ионных ПАВ это свойство существенно зависит от присутствия в растворе полимера.
Влияние полимера на поверхностное натяжение водных растворов зависит от концентрации ПАВ (рис. 49). При низких концентрациях ПАВ иногда, в зависимости от поверхностной активности полимера, наблюдается понижение поверхностного натяжения. При некоторой концентрации на изотермах поверхностного натяжения наблюдается излом и достигается более или менее постоянное значение поверхностного натяжения. Тогда
внекотором концентрационном интервале, зависящем от концентрации полимера, значение поверхностного натяжения оста-
68
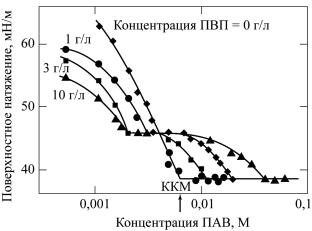
ется постоянным. Далее наблюдается его уменьшение до величины, характерной для раствора ПАВ в отсутствие полимера.
Рис. 49. Зависимостиповерхностногонатяжениярастворов додецилсульфатанатрияотегоконцентрациивприсутствии поливинилпирролидона, введенноговрастворыПАВ
вразличныхконцентрациях
При некоторой концентрации, которую принято называть
критической концентрацией ассоциации (ККА), начинается ассоциация молекул ПАВ и полимера. По этой причине при дальнейшем увеличении концентрации ПАВ его активность не увеличивается и поверхностное натяжение остается постоянным. При насыщении полимера молекулами ПАВ концентрация последнего и активность снова начинают расти, а поверхностное натяжение уменьшается вплоть до достижения KKM поверх- ностно-активного вещества, после чего в растворе начинают формироваться обычные мицеллы ПАВ.
Экспериментальные результаты исследований ассоциации в смешанных растворах ПАВ и полимера можно обобщить следующим образом:
69
1.KKA и KKM слабо зависят от концентрации полимера
вшироком диапазоне концентраций.
2.KKA и KKM не зависят от молекулярной массы полимера. При очень низкой молекулярной массе взаимодействие между компонентами ослабевает.
3.Протяженность плато на изотермах связывания увеличивается линейно с ростом концентрации полимера.
4.Анионные ПАВ взаимодействуют практически со всеми гомополимерами, взаимодействие катионных ПАВ с полимерами выражено слабее. Неионные и цвиттер-ионные ПАВ редко взаимодействуют с гомополимерами.
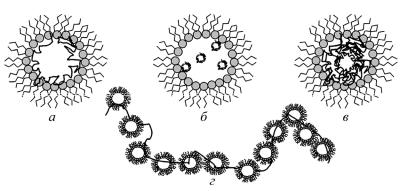
Структура агрегата полимера и поверхностно-активного вещества чаще всего представляется моделью мицеллообразования на полимерной цепи или вблизи ее (рис. 50).
Рис. 50. АгрегатыполимераиПАВвнеполярномрастворителе (системанонан– вода). Модель«жемчужногоожерелья»
Водорастворимые полимеры с низким молекулярным весом локализуются в виде мантии в водном ядре вблизи поверхностного слоя (рис. 50, а) или в виде клубка внутри водного ядра (рис. 50, б, в). В случае, когда размер полимера значительно превышает размер водной микрокапли, а гидрофильно-липо-
70
