
Поверхностно-активные вещества в золь-гель технологии
..pdf
Разнообразие структурных (нано)фаз хорошо выражено у так называемых блок-сополимеров, состоящих из линейных макромолекул, которые содержат чередующиеся блоки полимеров различного состава или строения, соединенные между собой химическими связями (рис. 21).
Рис. 21. Многообразие структурных фаз ассоциативных коллоидов блок-сополимеров: а – гексагональная; б – ламеллярная;
в– кубическая; г – биконтинуальная двойная алмазная структура;
д– биконтинуальная гироидная структура
Существует два подхода к описанию процесса мицеллообразования:
1. Образование мицелл рассматривают с точки зрения существования обратимого динамического равновесия.
2. Появление мицелл рассматривают как образование в растворе новой фазы – псевдофазы. Отдельной фазой (в клас-
31
сическом понимании) мицеллы назвать нельзя, потому что они включают конечное число молекул и не являются совершенно однородными.
Термодинамические исследования показывают, что оба подхода равноценны. Время образования и распада мицеллы – порядка 10–3 с, а время обмена ионами между мицеллой и водной фазой составляет от 10–5 до 10–7 с.
Процессы мицеллообразования непосредственно связаны с растворимостью ПАВ. Для ионных ПАВ характерно увеличение растворимости с ростом температуры. Нижний температурный предел мицеллообразования ионных ПАВ называется температурой (точкой) Крафта. В реальности речь идет не о конкретной температуре, а об узком температурном интервале.
На рис. 22 приведена простая диаграмма додецилсульфата натрия в водных растворах. До температуры Крафта растворение ПАВ в количествах, превышающих предел растворимости (ПР), приводит к выпадению в осадок конденсированной фазы. И только при достижении точки Крафта (ТК) удается достичь критической концентрации мицеллообразования и начинается процесс образования мицелл. Соответственно, охлаждение раствора, содержащего мицеллы, до точки Крафта приводит к выпадению в осадок конденсированной фазы. Именно этим процессом обусловлено то, что на упаковках моющих средств всегда указывают минимальную температуру их применения. При температуре ниже точки Крафта ПАВ, входящих в его состав, любое моющее средство практически не выполняет свою функцию.
Для ионных ПАВ с алкильными цепями характерны следующие закономерности:
1)точка Крафта возрастает с увеличением длины цепи;
2)точка Крафта сильно зависит от природы полярной группы и противоиона;
3)для понижения точки Крафта необходимо увеличить полярность алкильной цепи.
32

Рис. 22. ПростаяТ–Сфазоваядиаграммадодецилсульфатанатрия
вводныхрастворах. Отмеченыкритическиелиниимицеллообразования
ипределарастворимости, атакжетемператураКрафта
Растворимость неионных ПАВ падает с повышением температуры. Их характерной величиной является «точка помутнения», т.е. верхний температурный предел мицеллообразования, выше которого в системе ПАВ − растворитель происходит расслоение фаз, изменяющее ее оптические свойства.
Одним из наиболее важных свойств мицеллярных растворов ПАВ является солюбилизация (коллоидное растворение). Солюбилизацией называется самопроизвольное растворение мицеллярной фазой ПАВ веществ (твердых, жидких и газообразных), практически нерастворимых при обычных условиях в дисперсионной среде, с образованием термодинамически стабильного изотропного раствора. Растворимость многих газов, в том числе
33

О2 и CO2, в мицеллярных растворах ПАВ заметно выше, чем в воде. Так, например, растворимость октана в воде очень мала (всего 0,0015 %), но она возрастает в тысячу раз в 10%-ном растворе олеата натрия. В результате солюбилизации образуются термодинамически устойчивые равновесные изотропные растворы. Процесс солюбилизации является динамическим, при этом поглощаемое вещество (солюбилизат) распределяется между водной фазой и мицеллами. В мицелле солюбилизат может удерживаться за счет сил электростатического и гидрофобного взаимодействия, а также водородного связывания.
На рис. 23 представлена схема солюбилизации углеводородов и полярных органических веществ в мицеллах ПАВ. При солюбилизации происходит увеличение мицеллы в размерах, особенно значительноразбухаютламеллярные(см. рис. 19) мицеллы.
Рис. 23. СхемасолюбилизациивмицеллахПАВ: а– углеводородов; б– полярныхорганическихвеществ
На рис. 24 приведена схема солюбилизации бензола в мицелле олеата натрия.
Солюбилизация является одним из звеньев обмена веществ в живых организмах. Решающую роль в усвоении жиров играют наиболее типичные биологические ПАВ – холевые кислоты, содержащиеся в желчи.
34
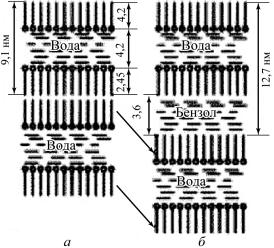
Рис. 24. Солюбилизациябензолавмицеллеолеатанатрия. Мицеллярныйраствор: а– досолюбилизации;
б– послесолюбилизации
Солюбилизация широко применяется и в фармации. Для этой цели особенно удобны неионогенные ПАВ, многие из которых вполне безопасны для организма. Они используются для солюбилизации витаминов, масел, барбитуратов, аспирина.
Способность к самоорганизации с образованием агрегатов молекул или ионов позволила получить новый тип растворителя–
ультрамикрогетерогенные организованные среды. По природе входящих в состав молекул и способу образования можно выде-
литьдва типаорганизованных сред:
1)среды, содержащие мицеллярные системы;
2)среды, содержащие молекулы-рецепторы, обладающие внутренней полостью, например краун-эфиры.
Примерами мицеллярных и родственных им систем являются прямые и обратные мицеллы, микроэмульсии (масло/вода
ивода/масло), пленки Ленгмюра–Блоджетт, везикулы, липосомы, жидкие кристаллы.
35
Представителями второй группы организованных сред являются растворы различных молекул-рецепторов, например циклодекстринов, каликсаренов, циклофанов, циклопептидов и т.д., образующих в пространстве жесткие трехмерные полости. Такие полости выступают в роли «хозяев» (рецепторов) для включаемых реагентов – «гостей» (субстратов). Образование такого супрамолекулярного комплекса включения лежит в основе принципа молекулярного распознавания веществ.
В целом термин «организованные среды» относят к прозрачным, оптически изотропным растворам, в которых в основной массе растворителя (водного или неводного) присутствуют наноразмерные системы, образующие собственную микропсевдофазу. Принципиальное отличие микрогетерогенных организованных сред от гомогенных растворов состоит в том, что определяющую роль в них играет локальный эффект, связанный с растворением гидрофильных и гидрофобных молекул в объеме мицеллярной системы или полости молекулы-рецептора. В этом случае изменение свойств растворенных веществ обусловлено изменением состояния среды только в их микроокружении, а не во всем растворителе.
Основные признаки организованных сред:
1.Способность растворять вещества, нерастворимые в объемной (чаще всего водной) фазе.
2.Способность сближать и концентрировать реагенты, различающиеся по гидрофобности, в микрофазе организованной системы.
3.Многофункциональное (электростатическое, донорноакцепторное, вандерваальсово, гидрофобное) взаимодействие микрофазы с субстратом.
4.Ярко выраженная ориентированная сорбция и эффект полости, при которых природа и геометрическое соответствие «хозяина» и «гостя» являются определяющими факторами связывания субстрата.
36
5. Значительная микрогетерогенность среды внутри микропсевдофазы в направлении от межфазной поверхности раздела с водой/растворителем к ее центру, выражающаяся в резком изменении диэлектрической проницаемости, микровязкости, микрополярности, микрокислотности и других физико-хими- ческих свойств среды.
Области использования организованных сред чрезвычайно разнообразны. В медицине и фармакологии их применяют, например, для увеличения растворимости веществ, транспорта лекарств в организме, приготовления мазей, гелей. Действие синтетических моющих средств основано на мицеллообразовании.
Вхимии и биохимии организованные среды применяют в реакциях трансмембранного транспорта, неорганическом и органическом синтезе, полимеризации, мицеллярном катализе, различных методах химического анализа, разделения, процессах крашения.
Впоследнее время мицеллы и микроэмульсии используют при получении наночастиц различных материалов (металлов, их оксидов, сульфидов, частиц полимеров). В целом сфера применения необычных свойств организованных сред в различных областях науки и технологии постоянно расширяется.
Всередине 60-х годов XX века английский ученый Алек Бэнгхем установил, что фосфолипиды, являющиеся основными компонентами клеточных мембран, способны самопроизвольно образовывать в воде замкнутые мембранные оболочки. Эти оболочки захватывают в себя часть окружающего водного раствора, а образующая их фосфолипидная мембрана обладает свойствами полупроницаемого барьера, легко пропускающего воду, но препятствующего диффузии растворенных в ней веществ.
Открытие имело огромное значение для дальнейшего развития всей мембранной биологии. Липидные частицы, описанные А. Бэнгхемом и его сотрудниками, оказались максимально упрощенной моделью клеточных мембран. Очень скоро эти ча-
стицы, получившие название липосомы (от греч. липос − жир
37

и сома − тельце или частица), стали излюбленным объектом исследования многих ученых, занимавшихся изучением самых разных свойств биологических мембран.
По своему химическому строению фосфолипиды относятся к группе амфифильных соединений, молекулы которых состоят из двух частей, радикальным образом различающихся по своему отношению к водному окружению. Такое «раздвоение личности» придает фосфолипидным молекулам замечательное свойство самопроизвольно образовывать в воде мембраны, которые
представляют собой двойной слой липидных молекул, обычно называемый просто липидным бислоем. Стремление максимально ограничить контакт неполярных цепей липида с водой приводит к тому, что бислой при его достаточной протяженности замыкается сам на себя (рис. 25), образуя полые оболочечные структуры, получившие название везикулы (от англ. vesicle – маленький пузырек).
Часто слова «липосомы» и «липидные везикулы» используют как синонимы. Однако исторически липосомами впервые были названы частицы, образующиеся при механическом диспергировании взвеси набухших фосфолипидов в воде. Эти частицы являются многослойными, и потому их иногда называют
мультиламеллярными везикулами (МЛВ). Они состоят из не-
скольких десятков, а то и сотен липидных бислоев, разделенных водными промежутками, и имеют довольно крупные размеры (до 50 мкм). Самые маленькие везикулы (около 20 нм), образованные одним липидным бислоем, называют малыми монола-
меллярными везикулами (ММВ).
Между этими двумя крайностями лежит целое поле разнообразных липосомных структур, различающихся размерами,
38

формой, числом липидных бислоев и внутренним устройством. Внешне липосомы не всегда выглядят как глобулярные частицы. Иногда они принимают уплощенную дискообразную форму (так называемые дискомы) или имеют вид очень длинных и тонких трубок, которые называют тубулярными липосомами.
Все эти структуры образуются в воде или аналогичных полярных растворителях. В неполярных растворителях молекулы липидного бислоя обращены внутрь полярными головками и наружу неполярными углеводородными цепями. Точно так же липидный слой образует различные структуры, которые принято называть обращенными, так как у них неполярные части молекул направлены в сторону неполярного растворителя в отличие от нормальных везикул (рис. 26).
Рис. 26. Схематическоеизображениенормальнойиобращеннойвезикул
Толщина липидного бислоя около 4 нм. Компоненты липидного бислоя обладают высокой молекулярной подвижностью, поэтому в целом он ведет себя как жидкая, текучая фаза
иобладает достаточной механической прочностью, гибкостью
ипластичностью. Благодаря этому липосомы сохраняют целостность при различных повреждающих воздействиях, а их
39

мембрана обладает способностью к самозалечиванию возникающих в ней структурных дефектов.
Для практического применения липосом и везикул исключительно важна их способность включать в себя и удерживать вещества различной природы (рис. 27).
Рис. 27. Способывключенияразличныхвеществ внормальнуювезикулу
Водорастворимые вещества включаются во внутренний водный объем липосом. Гидрофобные молекулы связываются в протяженном гидрофобном слое или во внутренней области обращенных везикул. На поверхности нормальных и обращенных везикул могут адсорбироваться различные вещества.
Хотя липосомы достаточно прочны и стабильны в широком диапазоне условий, их можно легко разрушить до мицеллярного состояния с помощью поверхностно-активных веществ, относящихся к разряду детергентов (моющих средств). Этот процесс яв-
40
