
vse_metody_MIKROB
.pdfтикратные разведения надосадочной жидкости в тиогликолевом буфере в объе-
ме 4,5 мл от 10-1 до 10-9, используя при приготовлении каждого разведения от-
дельную пипетку.
Для определения количества микроорганизмов в исследуемом материале из разведений производят высевы (по 0,1 мл) на соответствующие пластинча-
тые среды (с распределением исследуемого материала стерильным стеклянным шпателем по поверхности среды) или в полужидкие среды в пробирках (табл.
4). Среды Блаурокка и Вильсона-Блера перед посевом регенерируют путем ки-
пячения в течение 40 минут на водяной бане (для удаления кислорода). Посев протея осуществляют в конденсационную воду скошенного МПА (по Шукеви-
чу). При этом практически вся скошенная часть остается незасеянной, чтобы в дальнейшем выявить ползучий рост протея, отличающегося высокой подвиж-
ностью. После посева агар для анаэробов помещают в анаэростат, откачивают воздух вакуумным насосом, заполняют анаэростат газовой смесью: 80% азота, 10% углекислого газа, 10% водорода. Посевы термостатируют при 370С в тече-
ние 2-7 суток.
|
|
Таблица 4 |
Схема посева фекалий на дисбиоз |
||
|
|
|
Питательные среды |
Разведения |
Культивируемые микроорганизмы |
Блаурокка |
10-7, 10-9 |
Бифидобактерии |
Агар для анаэробов с ан- |
10-5, 10-7, 10-9 |
Бактероиды, эубактерии, фузобактерии, |
тибиотиками |
|
пептококки, пептострептококки и др. |
Вильсона-Блера |
10-3, 10-5, 10-7 |
Клостридии |
МРС (молочно- |
10-5, 10-7 |
Лактобактерии |
растительная среда) |
|
|
Эндо, Плоскирева |
10-3, 10-5, 10-7 |
Эшерихии, клебсиеллы и другие энте- |
|
|
робактерии |
Энтерококковый агар |
10-3, 10-5, 10-7 |
Энтерококки |
Кровяной агар |
10-3, 10-5, 10-7 |
Выявление гемолитической активности |
|
|
микроорганизмов |
Желточно-солевой агар |
10-2, 10-4, 10-6 |
Стафилококки |
Скошенный МПА |
10-1, 10-2, 10-3 |
Протей |
Сабуро |
10-2, 10-4, 10-6 |
грибы рода Candida |
II этап исследования.
18
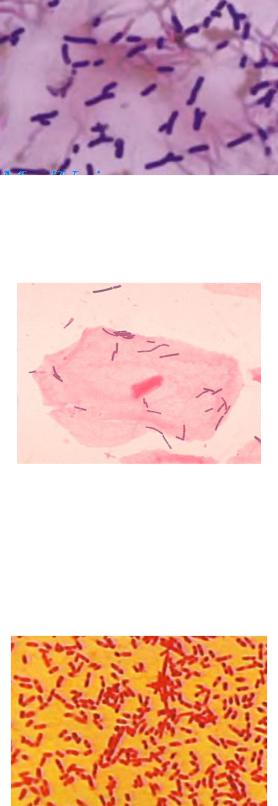
Макро- и микроскопическое изучение характера роста на средах:
Бифидобактерии. На полужидкой среде Блаурокка образуют колонии в виде «тяжей», «гвоздиков» или шаровидных форм. Морфология: грамположи-
тельные палочки с раздвоением на одном или обоих концах. Спор и жгутиков не образуют.
Лактобактерии. На МРС растут серовато-белыми колониями. Морфоло-
гия: полиморфные грамположительные палочки от длинных и тонких до корот-
ких, неподвижные, спор не образуют.
Бактероиды. На агаре для анаэробов образуют мелкие и точечные коло-
нии от сероватого до черного цвета. Морфология: грамотрицательные неравно-
мерно окрашенные, полиморфные палочки. Могут варьировать от коккобакте-
рий до нитевидных форм. Есть подвижные и неподвижные варианты. Спор не образуют.
19
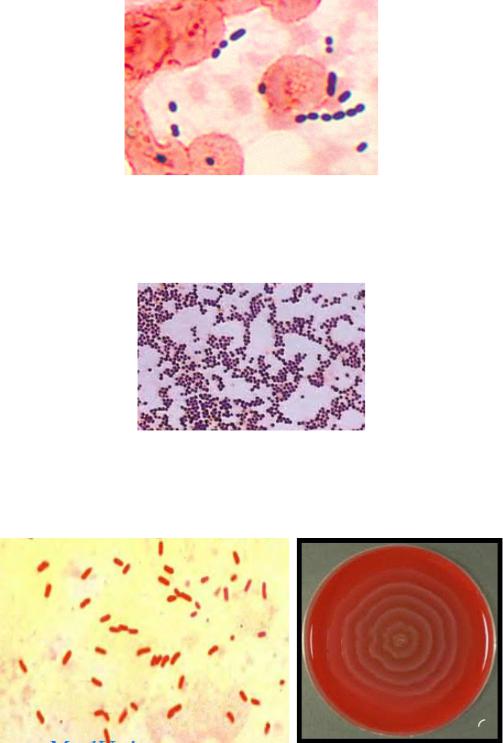
Эшерихии. На среде Эндо, как правило, образуют лактозопозитивные ко-
лонии, могут быть лактозонегативные варианты (не более 105 КОЕ/г).
Энтерококки (Е.faecalis, Е.faecium). На энтерококковом агаре образуют мелкие, выпуклые, сероватые колонии. Морфология: грамположительные кок-
ки, располагаются преимущественно попарно или в виде коротких цепочек; не-
подвижны, спор и капсул не образуют.
Стафилококки. Характеристика колоний и морфология описаны в учебно-
методическом пособии «Патогенные кокки и грамотрицательные бактерии.
Возбудители зоонозов».
Протеи. Характерной особенностью протея является ползучий рост (высо-
кая подвижность). Морфология: грамотрицательные палочки, средних разме-
ров, спор и капсул не образуют, подвижны.
20
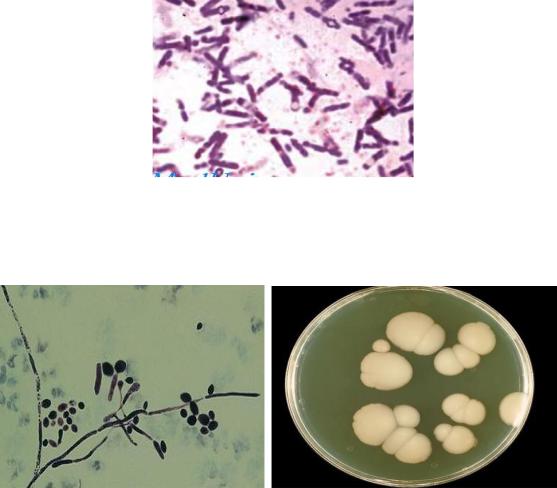
Клостридии. Колонии клостридий, развивающиеся в глубине среды Виль-
сона-Блера, шаровидной или чечевицеобразной формы черного цвета. Морфо-
логия: грамположительные палочки со слегка закругленными концами, иногда с центрально или субтерминально расположенной спорой.
Дрожжеподобные грибы рода Candida. На среде Сабуро образуют вы-
пуклые, сметанообразные, блестящие, белого или кремового цвета. Морфоло-
гия: круглые или овальные почкующиеся клетки с нитями мицелия.
Подсчет микроорганизмов в 1 г фекалий.
Необходимо учитывать количество выросших колоний, степень разведения исследуемого материала и величину посевной дозы. Количественную оценку производят по формуле:
M= N x 10n+1,
где: М – количество микроорганизмов в 1 г фекалий;
N – количество выросших колоний; n – степень разведения фекалий.
21

Пример подсчета: на среде Эндо при посеве 0,1 мл из разведения фекалий
10-5 выросло 20 колоний эшерихий. По формуле определяют количество E.coli в 1 г фекалий: М=20 х 10(5+1) = 20 х 106 = 2,0 х 107 КОЕ/1 г.
Cравнение полученных результатов с нормативными показателями.
Выдача заключения на специальном бланке об изменениях в составе фе-
кальной микрофлоры и степени дисбактериоза.
№ анализа______
Ф.И.О.________________________________ Возраст _____________________
Дата поступления материала__________________________________________
При микробиологическом исследовании фекалий выделены:
Микроорганизмы |
Норма |
Результат |
|
(взрослые, КОЕ/г) |
(КОЕ/г) |
||
|
|||
Бифидобактерии |
109-1010 |
|
|
Лактобактерии |
107-108 |
|
|
Бактероиды |
109-1010 |
|
|
Фузобактерии |
108-109 |
|
|
Эубактерии |
109-1010 |
|
|
Пептострептококки |
109-1010 |
|
|
Клостридии |
≤105 |
|
|
E.coli типичные |
107-108 |
|
|
E.coli лактозонегативные |
<105 |
|
|
E.coli гемолитические |
0 |
|
|
Другие энтеробактерии* |
<104 |
|
|
Неферментирующие бактерии** |
≤104 |
|
|
Энтерококки |
105-108 |
|
|
Стафилококки коагулазонегативные |
≤104 |
|
|
Стафилококки золотистые |
0 |
|
|
|
|
|
|
Грибы рода Candida |
≤104 |
|
Примечание: * – представители родов Klebsiella, Enterobacter, Hafnia, Serratia, Proteus, Morganella, Providencia, Citrobacter и др.; ** – Pseudomonas, Acinetobacter и др.
Дата выдачи результата _____________.
22
Занятие № 22 Тема: Микробиологическая характеристика сальмонеллезов (брюшного тифа,
паратифов, госпитальных сальмонеллезов), шигеллезов, кампилобактериозов и хеликобактериозов.
Цель занятия. Изучить характеристику сальмонелл, шигелл, кампилобактерий,
хеликобактерий и микробиологическую диагностику вызываемых ими заболе-
ваний.
I.Теоретические знания:
1.Характеристика возбудителей брюшного тифа и паратифов. Патогенез брюшного тифа. Микробиологическая диагностика.
2.Внутрибольничные (госпитальные) сальмонеллезы.
3.Возбудители дизентерии, их свойства. Микробиологическая диагностика бактериальной дизентерии.
4.Характеристика кампилобактерий и хеликобактерий, вызываемые заболева-
ния. Микробиологическая диагностика кампилобактериозов и хеликобакте-
риозов.
II.Практические навыки:
1.Изучение схемы бактериологического исследования крови больного с клини-
ческим диагнозом «брюшной тиф». Учет и интерпретация результатов.
2.Серологическая диагностика брюшнотифозного бактерионосительства (по демонстрации).
3.Изучение схемы бактериологического исследования фекалий больного с клиническим диагнозом «дизентерия». Учет и интерпретация результатов.
1

МЕТОДИЧЕСКИЕ УКАЗАНИЯ К ЗАНЯТИЮ
1. Характеристика возбудителей брюшного тифа и паратифов. Патогенез
брюшного тифа. Микробиологическая диагностика.
Возбудителей брюшного тифа относят к роду Salmonella, который включа-
ет более 2500 серотипов. Современная классификация сальмонелл основана на строении их ДНК и включает только 2 вида, из которых патогенным для чело-
века является вид Salmonella enterica с 6 подвидами и множеством серотипов в каждом. Это связано с изменчивостью генов, кодирующих синтез белков (фла-
геллинов) жгутиков. По современной номенклатуре возбудителя брюшного ти-
фа, как и возбудителей паратифов, относят к подвиду еntericа и обозначают как
S.еntericа еntericа, серотип typhi. Однако, во избежание путаницы, используют следующие названия возбудителей, соответственно их серотипу:
-возбудитель брюшного тифа – S.typhi;
-возбудитель паратифа А – S.paratyphi A;
-возбудитель паратифа В – S.paratyphi B;
-возбудитель паратифа С – S.paratyphi C.
Морфология: грамотрицательные палочки средних размеров, перитрихи,
спор и капсул не образуют.
Чистая культура S.typhi в окраске по Граму.
2

Культуральные свойства: растут на простых питательных средах: МПА
(S-колонии), МПБ, 20% желчном бульоне (диффузно-мутящий рост). На диф-
ференциально-диагностических средах Плоскирева и Эндо все виды сальмо-
нелл образуют бесцветные или цвета среды колонии, т.к. не ферментируют лак-
тозу, на висмут-сульфитном агаре возбудители брюшного тифа растут в виде черных колоний с металлическим блеском и почернением подлежащей среды.
Рост S.typhi на висмут-сульфитном агаре.
Биохимические свойства: сальмонеллы биохимически менее активны,
чем эшерихии. S.typhi ферментирует углеводы до кислоты, S.рaratyphi А и В до кислоты и газа. Изучение биохимических свойств сальмонелл проводят с по-
мощью энтеротест-систем.
Антигенная структура сальмонелл:
О – соматический антиген;
Н – жгутиковый антиген;
К – оболочечные антигены.
В системе оболочечных антигенов у S.typhi присутствует Vi-антиген (у ви-
рулентных штаммов), являющийся рецептором для Vi-бактериофагов.
На основании определения основных антигенов сальмонелл Ф. Кауфман и П. Уайт построили их классификацию (табл.1). Согласно этой классификации сальмонеллы делят на серогруппы (по наличию общих О-антигенов), которые обозначают буквами латинского алфавита: A, B, C и т.д.
3
Согласно схеме Кауфмана-Уайта, S.typhi относят к группе Д, S.рaratyphi A,
S.paratyphi B, S.paratyphi C к группам А, В, С соответственно. Дифференциация серотипов сальмонелл внутри группы проводится по Н-антигену.
|
|
|
Таблица 1 |
|
Схема Кауфмана-Уайта, антигенные формулы сальмонелл |
||||
|
(с сокращениями) |
|
|
|
|
|
|
|
|
Серогруппы, |
Соматический |
Жгутиковый антиген (H) |
|
|
серотипы |
антиген (О) |
Фаза I |
Фаза II |
|
Группа А (О2) |
|
|
|
|
S.рaratyphi A |
1, 2, 12 |
a |
(1, 5) |
|
Группа В (О4) |
|
|
|
|
S.paratyphi B |
1, 4, (5), 12 |
b |
1, 2 |
|
S.abony |
1, 4, (5), 12, 27 |
b |
е, n, x |
|
S.typhimurium |
1, 4, (5), 12 |
i |
1, 2 |
|
S.heidelberg |
1, 4, (5), 12 |
r |
1,2 |
|
Группа С1, С2, С3 (О6, 7, 8) |
|
|
|
|
S.paratyphi C |
6, 7 (Vi) |
с |
1,5 |
|
S.choleraesuis |
6, 7 |
(с) |
1,5 |
|
S.tompson |
6, 7 |
с |
1,5 |
|
S.newport |
6, 8 |
е, h |
1,2 |
|
Группа Д1 (О9, 12) |
|
|
|
|
S.typhi |
9, 12 (Vi) |
d |
- |
|
S.enteritidis |
1, 9, 12 |
g, m |
(1, 7) |
|
Группа Е1 (О3, 10) |
|
|
|
|
S.oxford |
3, 10 |
a |
1,7 |
|
S.anatum |
3, 10 |
e, h |
1,6 |
|
S.london |
3, 10 |
l, v |
1,6 |
|
Факторы патогенности сальмонелл:
1.Адгезины для прикрепления сальмонелл к энтероцитам с помощью pili.
2.Инвазины обеспечивают проникновение бактерий в макрофаги лимфоидной ткани тонкого кишечника (пейеровы бляшки) и размножение в них.
3.Vi и K-антигены обеспечивают защиту от фагоцитоза.
4.Эндотоксин (ЛПС).
5.R-плазмиды (кодируют формирование устойчивости к нескольким антибио-
тикам).
4
6. Острова патогенности (хромосомные гены, которые кодируют способ-
ность к адгезии, инвазии, защите от фагоцитоза).
Механизмы патогенного действия эндотоксина сальмонелл
на макроорганизм:
1.Вызывает выработку в организме веществ, обусловливающих лихорадочное состояние.
2.Приводит к расстройствам гемодинамики, резкому снижению артериально-
го давления.
3.Оказывает токсическое действие на нервную систему.
4.Вызывает выраженную лейкопению.
5.Активирует синтез простагландинов, что приводит к повышению цАМФ,
гиперсекреции солей и воды из клеток в просвет кишечника. Возникает
диарея.
Брюшной тиф – острое антропонозное кишечное инфекционное заболева-
ние, характеризующееся поражением лимфатического аппарата тонкого ки-
шечника, паренхиматозных органов, бактериемией, лихорадкой с явлениями общей интоксикации (головная боль, помрачение сознания, бред, галлюцина-
ции) и розеолезными высыпаниями на коже.
Особенности современного течения брюшного тифа:
-менее выраженная симптоматика;
-короткий период лихорадки;
-редко возникает status typhosis (помрачение сознания, бред, галлюцинации);
-частые рецидивы;
-преобладают стертые и абортивные формы (короткое течение, отсутствие ро-
зеолезных высыпаний и поражений внутренних органов).
Источники инфекции: больной человек или бактерионоситель.
Путь заражения: алиментарный при употреблении инфицированной воды
и молочных продуктов.
5
