- •1. Экзаменационные вопросы
- •Ферменты. Номенклатура. Классификация ферментов.
- •Уровни организации ферментов.
- •Механизм действия ферментов. Понятие об активном центре фермента, этапы ферментативного катализа.
- •Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от различных факторов. Уравнение Михаэлиса-Ментен, роль Кm и Vmax в характеристике фермен- тов.
- •Ингибиторы ферментов. Типы ингибирования. Графическое представление зависимости скорости ферментативной реакции от присутствия ингибиторов различных типов.
- •Механизмы регуляции активности ферментов. Примеры.
- •Аллостерические ферменты. Регуляция их активности. При- меры.
- •Введение в обмен веществ. Биологическое окисление
- •Важнейшие признаки живой материи. Особенности живых организмов, как открытых термодинамических систем.
- •1 Закон термодинамики:
- •2 Закон термодинамики:
- •Обмен углеводов
- •1 Схема-
- •2 Схема-
- •3 Этап оу – промежуточный обмен
- •Роль фосфорилазы при мобилизации гликогена
- •Обмен аминокислот, белков и нуклеотидов
- •Глюкозо-аланиновый цикл
- •Реакции глюкозо-аланинового цикла (выделен рамкой). Реакции, связанные с транспортными формами аммиака
- •Обмен липидов и липопротеидов
- •Гидролиз эфиров холестерина
- •Стеаторея
- •Процесс β- окисления: локализация, последовательность реакций, ферменты. Биологическое значение. Регуляция процесса β-окисления. Энергетический эффект окисления вжк (на примере пальмитиновой кислоты).
- •Этапы биосинтеза желчных кислот
- •Регуляция синтеза желчных кислот
- •Образование вторичных желчных кислот. Энтерогепатический цикл.
- •Метаболизм кетоновых тел при голодании
- •Биологические мембраны. Перекисное окисление липидов
- •1. Основные мембраны клетки и их функции.
- •2. Строение и состав мембран: структура и свойства липидов,белков, углеводов мембран. Общие свойства мембран и их функции.
- •3. Трансмембранный перенос малых молекул. Типы переноса веществ через мембрану. Трансмембранный перенос макромолекул и частиц. Механизмы мембранного транспорта
- •Проницаемость плазматической мембраны
- •Пассивный транспорт
- •Простая диффузия
- •Облегченная диффузия
- •Особенности облегченной диффузии
- •Активный транспорт
- •Ионные каналы
- •Эндоцитоз
- •Экзоцитоз
- •Функции биологических мембран
- •4. Механизмы трансмембранной передачи гормонального сигнала в клетку.
- •5. Активные формы кислорода (афк). Биологическое действие афк. Ферментативные и неферментативные системы, генерирующие афк.
- •6. Стадии свободно-радикального окисления липидов.
- •7. Повреждающее действие первичных и вторичных продуктов пероксидного окисления на мембраны и другие структуры клетки.
- •8. Ферментативные системы антирадикальной защиты. Катализируемые реакции.
- •9. Неферментативные системы антирадикальной защиты и их физиологическое значение.
- •10. Роль афк в механизме фагоцитоза. Кислородзависимые и кислороднезависимые механизмы фагоцитоза. Роль афк в антимикробной защите грудного молока.
- •11.Роль пероксидного окисления при гипоксии (ишемии). Факторы гипоксии, инициирующие пол. Понятие о «кислородном» и «кальциевом» парадоксах.
- •12. Простагландины и лейкотриены: схема синтеза и их биологические функции.
- •Гормоны. Гормональная регуляция метаболических процессов
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология Гипофункция
- •Биохимия питания и печени. Нервная, мышечная и соединительная ткани. Биохимия крови
- •Метаболизм скелетных мышц ( поперечно-полосатые мышцы)
- •Метаболизм скелетных мышц ( поперечно-полосатые мышцы)
- •Двойственная роль креатинфосфата
- •Пути генерации атф и восстановление атф в мышечных клетках миокарда
- •Механизм мышечного сокращения
- •Этапы цикла мышечного сокращения
- •Миозиновая регуляция сокращения
- •Сравнение актин-миозинового взаимодействия в 2-х видах мышц
- •Механизм расслабления поперечнополосатого мышечного волокна
- •Метаболические нарушения при инфаркте миокарда
- •Лабораторная диагностика инфаркта миокарда
- •Обмен железа: основные функции, пул железа в организме, всасывание в жкт, «ферритиновый блок».
- •Поступление экзогенного железа в ткани из кишечника
- •Нарушение метаболизма железа
1 Закон термодинамики:
Энергию невозможно ни создать, ни уничтожить, она лишь переходит из одной формы в другую.
Внутренняя энергия системы вместе с ее окружением остается постоянной.
Энтальпия (H)- это термодинамическое свойство вещества, которое указывает уровень энергии, сохраненной в его молекулярной структуре (мера упорядоченности системы, полная энергия )
Δ Н= Δ G – T ΔS
S-энтропия
G-свободная энергия Гиббса, величина, показывающая изменение энергии в ходе химической реакции.
Q= Δ Н+W
2 Закон термодинамики:
Каждая система стремится к росту энтропии.
Энтропия- мера неупорядоченности системы, обозначает меру необратимого рассеивания энергии или бесполезности энергии.
Свойства организма как открытой термодинамической системы:
Все клетки имеют одинаковую температуру-изотермичность и одинаковое давление -изобарность. Живая клетка изобарно-изотермическая система.
Живой организм не находится в равновесном состоянии с окружающей средой.
Система создает новые структуры и поддерживает ее за счет свободной энергии окружающей среды, это полезная форма энергии – свободная энергия Гиббса.
Эту энергию клетки возвращают обратно в окружающую среду в менее пригодной для использования форме -в виде энтропии.
Всю энергию, которую получают живые организмы, изначально они получают от энергии Солнца.
Живой организм непрерывно обменивается с окружающей средой и веществом, и энергией. Она находится в устойчивом, но не равновесном состоянии.
Устойчивость в данном случае означает стационарность.
Для поддержания стационарного состояния необходимо:
1)постоянство скорости притока и оттока питательных веществ и энергии
2)удаление конечных продуктов обмена из системы
3)постоянство физико-химических параметров: температура, давление, свободная энергия Гиббса, энтальпия.
4) концентрация субстрата должна обеспечивать насыщение ферментов, катализирующих данное превращение
5) реакции должны быть однонаправленны, создается поток в сторону деградации субстрата и такая реакция является лимитирующей, конечным звеном, кинетически необратимы
Понятие о процессах катаболизма и анаболизма. Функции клеточного метаболизма. Основные принципы организации метаболизма: этапность, конвергенция, унификация. Стадии генерирования энергии по Кребсу.
Обмен веществ (метаболизм) – совокупность разнообразных биохимических процессов, в результате которых поступающие питательные вещества усваиваются, происходит освобождение энергии и синтез необходимых организму соединений. Метаболизм состоит из двух частей: анаболизма (синтеза сложных веществ из более простых с затратой энергии) и катаболизма (распада более сложных веществ до более простых с выделением энергии).
Межуточный обмен начинается с момента поступления питательных веществ в кровь и до момента выведения конечных продуктов обмена и обеспечивающих организм веществами и энергией, необходимыми для его жизнедеятельности.
Анаболизм – ферментативный синтез крупномолекулярных клеточных компонентов (белков, полисахаридов, нуклеиновых кислот, липидов), который происходит с затратой энергии (эндергонический процесс)
Важно! Анаболизм. Анаболизм проходит также три стадии. Исходные вещества – те, которые подвергаются превращениям на 3-ей стадии катаболизма. Таким образом, 3 стадия катаболизма – исходная стадия анаболизма. Реакции этой стадии имеют двойную функцию – амфиболическую. Например, синтез белка из аминокислот.
2 стадия – образование из кетокислот аминокислот в реакциях трансаминирования.
3 стадия – объединение аминокислот в полипептидные цепи.
Также, в результате последовательных реакций происходит синтез нуклеиновых кислот, липидов, полисахаридов.
Ряд реакций катаболизма практически необратимы. Их протеканию в обратном направлении препятствуют непреодолимые энергетические барьеры. В ходе эволюции были выработаны обходные реакции, сопряженные с затратой энергии макроэргических соединений. Катаболический и анаболический пути отличаются, как правило, локализацией в клетке – структурная регуляция.
Например: окисление жирных кислот осуществляется в митохондриях, тогда как синтез жирных кислот катализирует набор ферментов, локализованных в цитозоле.
Именно благодаря разной локализации катаболические и анаболические процессы в клетке могут протекать одновременно.
Катаболизм- ферментативное расщепление сравнительно крупных органических молекул окислительным путем, сопровождаемое высвобождением энергии и ее запасанием в виде молекул АТФ (экзергонический процесс)
Анаболизм и катаболизм неразрывно связаны между собой: анаболизм поставляет катаболизму вещество, катаболизм поставляет анаболизму энергию. Однако в условиях постоянной температуры передача энергии в виде тепла от одного химического процесса другому невозможна. Поэтому в живых системах имеет место передача энергии посредством особых макроэргических соединений, обладающих значительным запасом энергии. Универсальным макроэргическим соединением во всех клетках служит аденозинтрифосфорная кислота (аденозинтрифосфат, АТФ).
Аналогия между горением и катаболизмом весьма условна. В обоих случаях мы имеем химическое превращение (окисление) органических веществ в СО2 и Н2О в присутствии кислорода. Однако горение – процесс молниеносный, нерегулируемый и неэффективный (вся энергия рассеивается в виде тепла). Напротив, при катаболизме энергия органических веществ выделяется порциями на различных его этапах, достаточно эффективно запасается при синтезе АТФ, а процесс регулируется потребностью клетки в энергии.
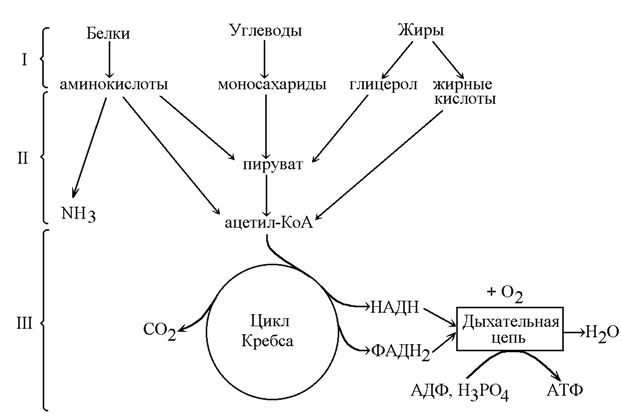
Известно два способа синтеза АТФ: аэробный (окислительное фосфорилирование) и анаэробный (субстратное фофорилирование). Анаэробный катаболизм представляет собой неполное окисление органических веществ, характерен только для углеводов (гликолиз), сопровождается образованием молочной кислоты и малым энергетическим выходом – 2 молекулы АТФ на 1 молекулу глюкозы. В физиологических условиях анаэробный катаболизм дает не более 10 % всей АТФ в клетке. Исключением 31 из этого общего правила являются скелетные мышцы: в белых мышечных волокнах основное количество АТФ синтезируется анаэробным путем. Кроме того, гликолиз становится единственно возможным путем продукции АТФ в любой клетке при дефиците кислорода – гипоксии. Однако анаэробный катаболизм в большинстве случаев не способен длительно поддерживать жизнедеятельность клеток. Так, хорошо известно, что самые чувствительные к гипоксии клетки – нейроны коры больших полушарий головного мозга – могут прожить без кислорода не более 5 мин. Большинство клеток получают свыше 90 % необходимой АТФ за счет аэробного катаболизма. Это высокоэффективный биохимический процесс полного окисления органических веществ (углеводов, липидов и белков) до неорганических соединений СО2 и Н2О в присутствии кислорода. Аэробное окисление 1 молекулы глюкозы дает возможность синтезировать 38 молекул АТФ, похожие значения дает окисление аминокислот, а полное окисление липидов поставляет клетке сотни молекул АТФ на 1 молекулу вещества. Большинство клеток могут использовать все три класса питательных веществ как источник энергии. Тем не менее, в их использовании наблюдается очередность: углеводы служат первым энергетическим «топливом», при исчерпании запасов которых клетки переходят на катаболизм липидов. Белки подвергаются катаболизму в последнюю очередь, в экстремальных ситуациях, например, при длительном голодании. Весь синтезируемый фонд АТФ клетки расходуют на совершение различных видов полезной работы. Во-первых, это химическая работа – реакции анаболизма, по определению требующие затраты АТФ. Сюда относятся все биосинтезы в клетках, в особенности самые «дорогостоящие» – синтезы биополимеров (белков, ДНК и РНК, полисахаридов) и липидов. Во-вторых, это механическая работа – процессы перемещения клеток и их органелл в пространстве, в том числе и мышечное сокращение. Наконец, это осмотическая работа – процессы активного транспорта веществ через биологические мембраны, направленные на создание разности концентраций этих веществ внутри клетки и во внеклеточной жидкости. Если в роли таких веществ выступают зараженные частицы – ионы К+ , Na+ , Ca2+, Cl– , то формируется не только разность концентраций, но и разность потенциалов. В этом случае говорят о совершении электрической работы. Однако следует помнить, что КПД всех этих видов работы существенно ниже 100 %. Оставшаяся доля энергии АТФ переходит в тепло. В этом заключается еще одна важная функция всех процессов распада АТФ – функция теплопродукции.
Важно! Катаболизм. Расщепление основных пищевых веществ в клетке представляет собой ряд последовательных ферментативных реакций, составляющих 3 основные стадиикатаболизма (Ганс Кребс) – диссимиляция.
1 стадия – крупные органические молекулы распадаются на составляющие их специфические структурные блоки. Так, полисахариды расщепляются до гексоз или пентоз, белки – до аминокислот, нуклеиновые кислоты – до нуклеотидов и нуклеозидов, липиды – до жирных кислот, глицеридов и др. веществ.
Количество энергии, освобождающееся на этом этапе, невелико – менее 1%.
2 стадия – формируются ещё более простые молекулы, причём число их типов существенно уменьшается. Важно подчеркнуть, что здесь образуются продукты, которые являются общими для обмена разных веществ – это, как бы узлы, соединяющие разные пути метаболизма. К ним относятся: пируват – образуется при распаде углеводов, липидов, аминокислот; ацетил-КоА – объединяет катаболизм жирных кислот, углеводов, аминокислот.
Продукты, полученные на 2-й стадии катаболизма, вступают в 3-ю стадию, которая известна как цикл Кребса – цикл трикарбоновых кислот (ЦТК), в котором идут процессы терминального окисления. В ходе этой стадии все продукты окисляются до СО2 и Н2О. Практически вся энергия освобождается во 2-й и 3-ей стадиях катаболизма.
Все перечисленные выше стадии катаболизма или диссимиляции, которые известны как «схема Кребса» как нельзя более точно отражает важнейшие принципы метаболизма: конвергенцию и унификацию.Конвергенция – объединение различных метаболических процессов, характерных для отдельных видов веществ в единые, общие для всех видов. Следующий этап – унификация – постепенное уменьшение числа участников обменных процессов и использование в метаболических реакциях универсальных продуктов обмена.
На первом этапе четко прослеживается принцип унификации: вместо множества сложных молекул самого различного происхождения образуются достаточно простые соединения в количестве 2-3 десятков. Эти реакции происходят в желудочно-кишечном тракте и не сопровождаются выделением большого количества энергии. Она обычно рассеивается в виде тепла и не используется для других целей. Значение химических реакций первого этапа состоит в подготовке питательных веществ к действительному освобождению энергии.
На втором этапе четко прослеживается принцип конвергенции: слияние различных метаболических путей в единое русло – то есть в 3-й этап.
На 2-ом этапе освобождается около 30% энергии, содержащейся в питательных веществах. Остальные 60-70% энергии освобождается в цикле трикарбоновых кислот и связанного с ним процесса терминального окисления. В системе терминального окисления или дыхательной цепи, основу которого составляет окислительное фосфорилирование, унификация достигает своей вершины. Дегидрогеназы, катализирующие окисление органических веществ в ЦТК, передают на дыхательную цепь только водород, который в процессе окислительного фосфорилирования претерпевает одинаковые превращения.
В энергетическом обмене принято различать следующие основные этапы:
1.Подготовительный этап. Включает в себя реакции гидролиза в желудочнокишечном тракте питательных веществ до их мономеров: белков – до аминокислот, полисахаридов – до моносахаридов (в основном глюкозы), липидов – до жирных кислот и глицерина. Данный этап необходим, чтобы сделать питательные вещества доступными для каждой клетки, поскольку крупные молекулы не подвергаются всасыванию в кровь.
Виды пищеварения в желудочно-кишечном тракте:
а) дистантное переваривание – например, расщепление белков под действием пепсина в полости желудка или трипсина в просвете кишечника.
б) пристеночное или мембранное – например, действие пептидаз, фиксированных на поверхности клеток слизистой кишечника;
в) внутриклеточное – например, в лизосомах переваривание под действием протеолитических ферментов.
Кроме ферментов макроорганизма в пищеварении участвуют и ферменты кишечной микрофлоры.
2.Резорбция. Процесс всасывания питательных веществ через слизистую оболочку кишечника.
3.Промежуточный обмен. Включает многочисленные биохимические реакции аминокислот, глюкозы, жирных кислот и глицерина, направленные на их превращение в ограниченный круг «малых» молекул – пировиноградной кислоты, ацетилкоэнзима А и ряда других. Промежуточный обмен не требует затраты кислорода и протекает с синтезом небольшого количества АТФ в реакциях субстратного фосфорилирования.
4.Терминальный (заключительный) этап. Происходит полное окисление продуктов промежуточного обмена до неорганических веществ. Этот этап протекает в митохондриях клеток, где происходит потребление кислорода и образование СО2 и Н2О, и в ходе окислительного фосфорилирования синтезируется основное количество АТФ. Выделение, экскреция.
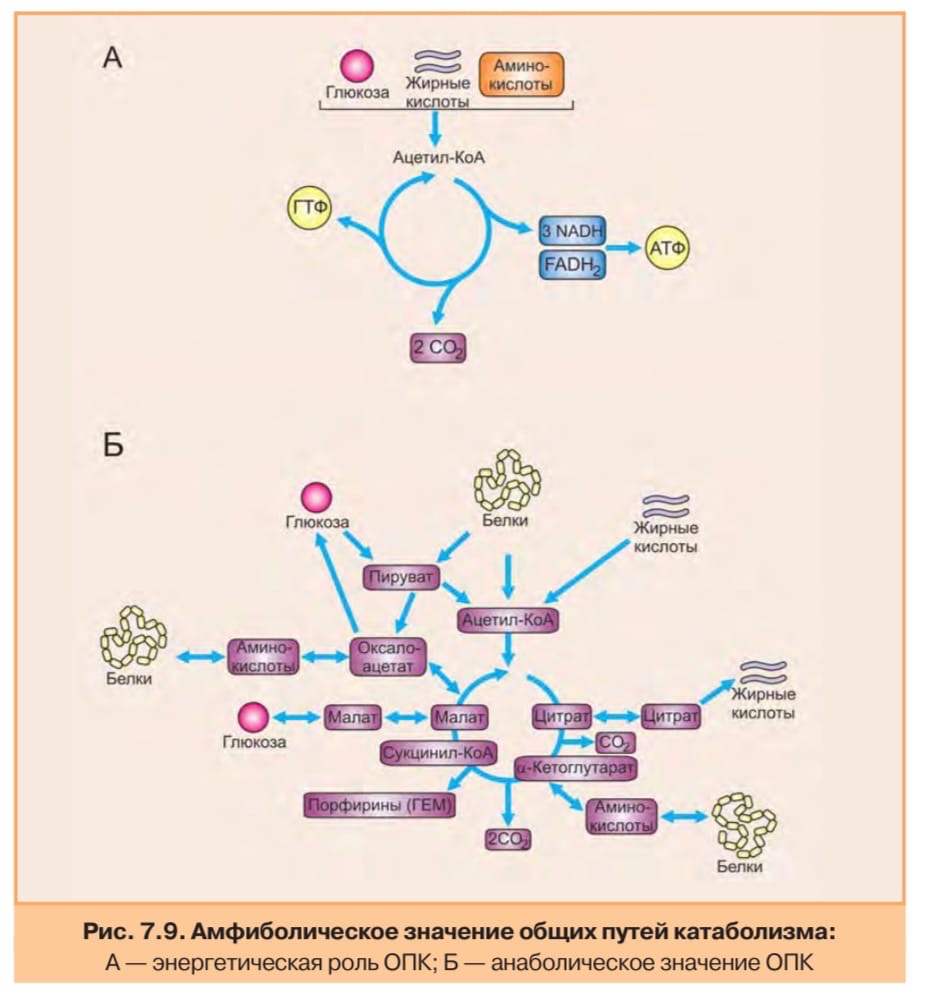
Схема катаболизма основных питательных веществ (см выше в вопросе 2). Понятие о специфических и общем путях катаболизма.
Общий и специфический путь катаболизма:


В процессе катаболизма можно выделить три основные его части (рис. 7.1):
1. Расщепление в пищеварительном тракте. Это гидролитические реакции, превращаю щие сложные пищевые вещества в относительно небольшое число простых метаболитов: глюкозу, аминокислоты, глицерол, жирные кислоты.
2. Специфические пути катаболизма. На этом этапе простые метаболиты подвергаются специфическим реакциям расщепления, в результате которых образуется либо пировиноградная кислота, либо ацетил-КоА. Ацетил-КоА может образоваться из пирувата, а также из жирных кислот и аминокислот. В специфических путях катаболизма могут образоваться со единения, которые непосредственно включаются в цитратный цикл.
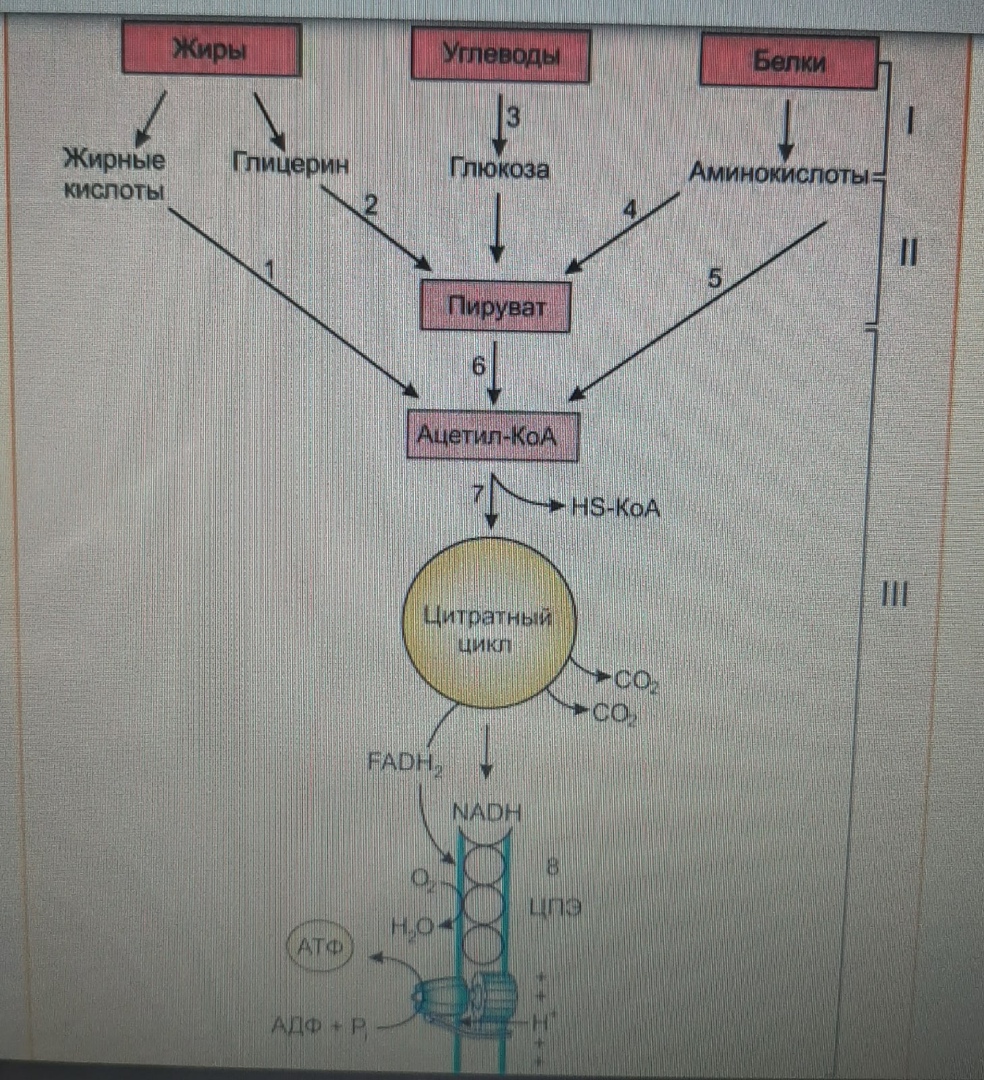
Катаболизм основных пищевых веществ: I — расщепление в пищеварительном тракте; II — специфичные пути катаболизма (1–5); III — общий путь катаболизма: 6 — окислительное декарбоксилирование пирувата; 7 — цитратный цикл; 8 — дыхательная цепь
3.Окислительное декарбоксилирование пирувата, цитратный цикл и дыхательная цепь завершают расщепление пищевых веществ до конечных продуктов — СО и Н2О. Следовательно, начиная со стадии образования пирувата, происходит унификация путей катаболизма. Из большого числа исходных соединений образуется всего два — пируват и аце тил-КоА. Процесс, начинающийся с окисления пирувата, называется общим путем ка таболизма. Именно в общем пути катаболизма образуется основное количество субстратов для реакций дегидрирования. Совместно с дыхательной цепью и окислительным фосфорилированием общий путь катаболизма является основным источником энергии в форме АТФ.
Стадии образования энергии по Кребсу:
В 4 окислительно-восстановительных реакциях ЦТК образуются 3 НАДН2 и 1 ФАДН2 , которые направляются далее в дыхательную цепь окислительного фосфорилирования. В процессе окислительного фосфорилирования в дыхательной цепи из 1 НАДН2 образуется 3 АТФ, из 1 ФАДН2 – 2 АТФ. Из 1 ГТФ, образующегося в ЦТК за счет субстратного фосфорилирования, синтезируется 1 АТФ. Таким образом, за 1 оборот ЦТК синтезируется 12 АТФ.
4.Представление о биологическом окислении. Сопряжение экзергонических и эндергонических процессов в организме (на примере фосфорилирования глюкозы).
4. Представление о биологическом окислении. Сопряжение
экзергонических и эндергонических процессов в организме (на
примере фосфорилирования глюкозы).
БИОЛОГИЧЕСКОЕ ОКИСЛЕНИЕ
Процессы катаболизма в клетках животных сопровождаются потреблением кислорода, который необходим для реакций окисления. В результате этих реакций происходит освобождение энергии, которая необходима организмам в процессах жизнедеятельности для осуществления различных видов работы.
Небиологические системы могут совершать работу за счёт тепловой энергии, биологические системы функционируют в изотермическом режиме и для осуществления процессов жизнедеятельности используют химическую энергию. Изучением превращений энергии, сопровождающих химические реакции, занимается биоэнергетика, или биохимическая термодинамика.
В биологических системах термодинамически невыгодные (эндергонические) реакции могут протекать лишь за счёт энергии экзергонических реакций. Такие реакции называют энергетически сопряжёнными. Многие из этих реакций происходят при участии аденозинтрифосфата (АТФ), играющего роль сопрягающего фактора.
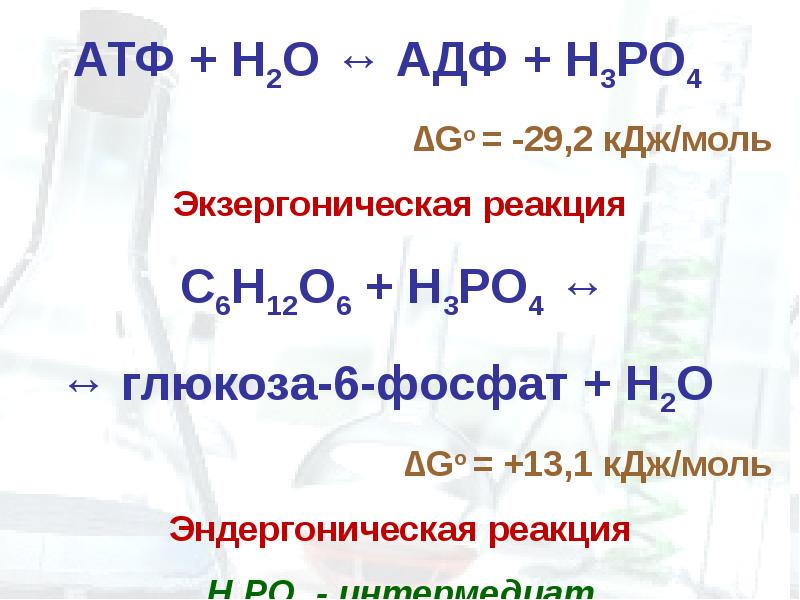
Реакция фосфорилирования глюкозы свободным фосфатом с образованием глюкозо-6-фосфата является эндергонической:
(1) Глюкоза + Н3РО4 → Глюкозо-6-фосфат + Н2О (ΔG = +13,8 кДж/моль).
Для протекания такой реакции в сторону образования глюкозо-6-фосфата необходимо её сопряжение с другой реакцией, величина свободной энергии которой больше, чем требуется для фосфорилирования глюкозы.
(2) АТФ → АДФ + Н3РО4 (ΔG = -30,5 кДж/моль).
При сопряжении процессов (1) и (2) в реакции, катализируемой гексокиназой, фосфорилирование глюкозы легко протекает в физиологических условиях; равновесие реакции сильно сдвинуто вправо, и она практически необратима:
(3) Глюкоза + АТФ → Глюкозо-6-фосфат + АДФ (ΔG = -16,7 кДж/моль).
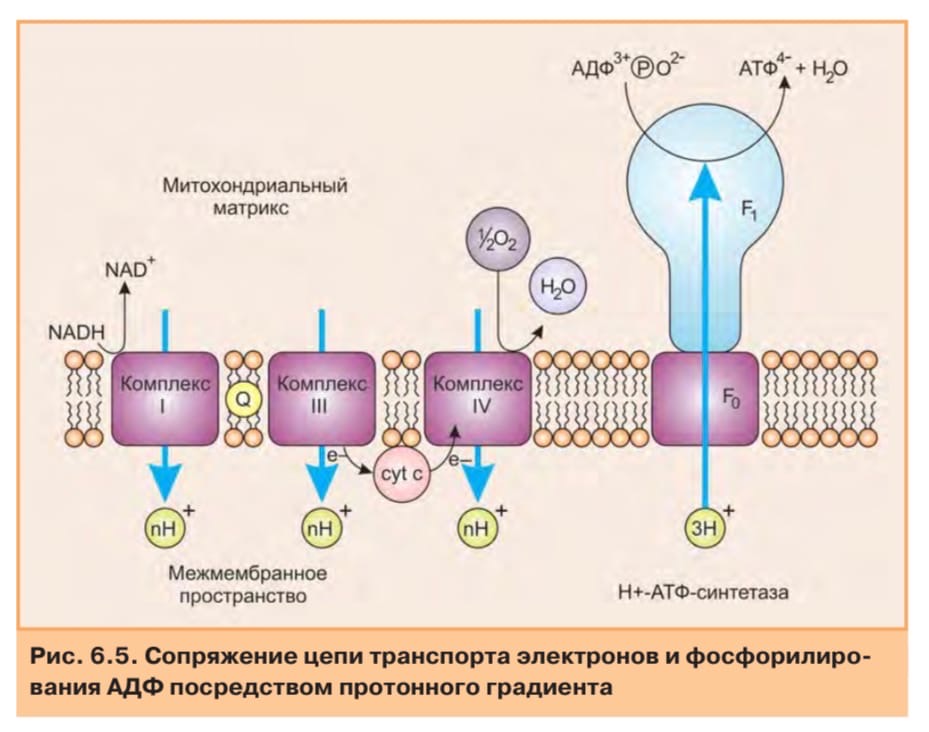
Сопряжение. Эндоэргический процесс выброса протонов из матрикса возможен за счет экзоэргических окислительно-восстановительных реакций дыхательной цепи. Перенос протонов приводит к возникновению разности концентрации Н+ с двух сторон митохондриальной мембраны: более высокая концентрация будет снаружи и более низкая - внутри. Митохондрия в результате переходит в «энергизованное» состояние, так как возникает градиент концентрации Н+ и одновременно разность электрических потенциалов со знаком плюс на наружной поверхности.
Электрохимический потенциал способен совершать «полезную» работу, он заставляет протоны двигаться в обратном направлении, но мембрана непроницаема для них кроме отдельных участков, называемых протонными каналами. Обратный перенос протонов в матрикс является экзоэргическим процессом, высвобождающаяся при этом энергия используется на фосфорилирование AДФ. Эту реакцию катализирует фермент Н+-АТР-синтетаза, располагающаяся в области протонных каналов на внутренней поверхности внутренней мембраны.
5. Пути утилизации кислорода. Характеристика высокоэнергетических субстратов, цикл АТФ-АДФ, использование АТФ, как
универсального источника энергии.
В живых организмах существует целая группа органических фосфатов, гидролиз которых приводит к освобождению большого количества свободной энергии. Такие соединения называют высокоэнергетическими фосфатами.
АТФ - молекула, богатая энергией, поскольку она содержит две фосфоангидридные связи (β, γ). При гидролизе концевой фосфоангидридной связи АТФ превращается в АДФ и ортофосфат Рi При этом изменение свободной энергии составляет -7,3 ккал/моль. При условиях, существующих в клетке в норме (рН 7,0, температура 37 °С), фактическое значение ΔG0' для процесса гидролиза составляет около -12 ккал/моль. Величина свободной энергии гидролиза АТФ делает возможным его образование из АДФ за счёт переноса фосфатного остатка от таких высокоэнергетических фосфатов, как, например, фосфоенолпируват или 1,3-бисфосфоглицерат; в свою очередь, АТФ может участвовать в таких эндергонических реакциях, как фосфорилирование глюкозы или глицерина. АТФ выступает в роли донора энергии в эндергонических реакциях многих анаболических процессов. Некоторые биосинтетические реакции в организме могут протекать при участии других нуклеозидтрифосфатов, аналогов АТФ; к ним относят гуанозинтрифосфат (ГТФ), уридинтрифосфат (УТФ) и цитидинтрифосфат (ЦТФ). Все эти нуклеотиды, в свою очередь, образуются при использовании свободной энергии концевой фосфатной группы АТФ. Наконец, за счёт свободной энергии АТФ совершаются различные виды работы, лежащие в основе жизнедеятельности организма, например, такие как мышечное сокращение или активный транспорт веществ.
Таким образом, АТФ - главный, непосредственно используемый донор свободной энергии в биологических системах. В клетке молекула АТФ расходуется в течение одной минуты после её образования. У человека количество АТФ, равное массе тела, образуется и разрушается каждые 24 ч.
Использование АТФ как источника энергии возможно только при условии непрерывного синтеза АТФ из АДФ за счёт энергии окисления органических соединений. Цикл АТФ-АДФ - основной механизм обмена энергии в биологических системах, а АТФ - универсальная "энергетическая валюта".
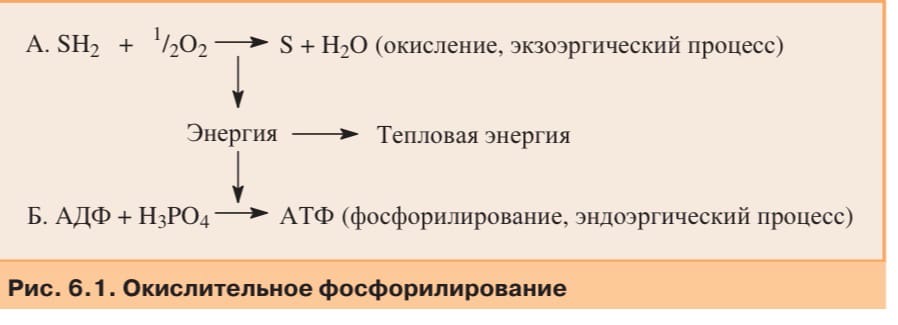
Катаболизм органических веществ в тканях сопровождается потреблением кислорода и выделением СО2. Этот процесс называют тканевым дыханием.
Кислород в этом процессе используется как акцептор водорода от окисляемых (дегидрируемых) веществ (субстратов), в результате чего синтезируется вода. Процесс окисления можно представить следующим уравнением: SH2 + 1/2 O2 S + H2O. Окисляемые различные органические вещества (S — субстраты), представляют собой метаболиты катаболизма, их дегидрирование является экзоэргическим процессом. Энергия, освобождающаяся в ходе реакций окисления, либо полностью рассеивается в виде тепла, либо частично тратится на фосфорилирование ADP с образованием АТР. Организм превращает около 40% энергии, выделяющейся при окислении, в энергию макроэргических связей АТР. Большинство организмов в биосфере использует этот способ или очень сходный с ним (в качестве терминального акцептора водорода может быть не кислород, а другое соединение) как основной источник энергии, необходимый для синтеза внутриклеточной АТР. Таким путем клетка превращает химическую энергию питательных веществ, поступивших извне, в утилизируемую метаболическую энергию. Реакция дегидрирования и способ превращения выделившейся энергии путем синтеза АТР — это энергетически сопряженные реакции. Целиком весь сопряженный процесс называется окислительным фосфорилированием ADP
Кислород участвует в транспорте электроно. Существуют промежуточные переносчики при транспорте электронов от исходного донора электронов SH2 к терминальному акцептору — О2. Полный процесс представляет собой цепь последовательных окислительно—восстановительных реакций, в ходе которых происходит взаимодействие между переносчиками. Каждый промежуточный переносчик вначале выступает в роли акцептора электронов и протонов и из окисленного состояния переходит в восстановленную форму. Затем он передает электрон следующему переносчику и снова возвращается в окисленное состояние. На последней стадии переносчик передает электроны кислороду, который затем восстанавливается до воды. Совокупность последовательных окислительно—восстановительных реакций называется цепью переноса (транспорта) электронов, или дыхательной цепью
Промежуточными переносчиками в дыхательной цепи у высших организмов являются коферменты: NAD+ (никотинамид—адениндинуклеотид), FAD и FMN (флавинадениндинуклеотид и флавинмононуклеотид), кофермент Q (CoQ), семейство гемсодержащих белков — цитохромов (обозначаемых как цитохромы b, С1, С, А, А3) и белки, содержащие негеминовое железо. Все участники этой цепи разделены на четыре окислительно—восстановительные системы, связанные убихиноном (CoQ) и цитохромом С. Процесс начинается с переноса протонов и электронов от окисляемого субстрата на коферменты NAD+ или FAD. Это определяется тем, является ли дегидрогеназа, катализирующая первую стадию, NAD — зависимой или FAD — зависимой. Если процесс начинается с NAD+ , то следующим переносчиком будет FMN.
Тип участвующей дегидрогеназы зависит от природы субстрата. Но каким бы ни был исходный субстрат, электроны и протоны от флавинов переносятся к коферменту Q, а дальше пути электронов и протонов расходятся. Электроны с помощью системы цитохромов достигают кислорода, который затем, присоединяя протоны, превращается в воду. NAD — зависимая дегидрогеназа катализирует реакции окисления непосредственно субстрата (первичная дегидрогеназа). NAD+ является коферментом и выполняет роль акцептора водорода.
FAD — зависимая дегидрогеназа также выполняет функцию первичной дегидрогеназы. Коферментом является FAD, который является акцептором водорода от субстрата. NADH — дегидрогеназа катализирует окисление NADH и восстановление убихинона (CoQ). Переносчиком водорода является кофермент — FMN (комплекс 1). В процессе реакции водород сначала присоединяется к FMN, соединенному с ферментом, а затем передается на убихинон. Флавиновые коферменты (FAD и FMN) прочно связаны с ферментом как простетические группы, поэтому ферменты, в состав которых они входят, называются флавопротеины. Флавинмононуклеотид (FMN), или рибофлавин фосфат, неразрывно связан с белковой частью фермента. Строго говоря, FMN не является нуклеотидом, так как флавиновая часть связана с рибитолом, а не с рибозой.
Убихинон (кофермент Q) — производное изопрена. Кофермент Q действует как переносчик электронов на цитохромы.
Цитохромы — это гемопротеины — белки, содержащие в качестве прочно связанной простетической группы гем.
Атом железа в геме может менять валентность, присоединяя или отдавая электроны.
В дыхательной цепи цитохромы служат переносчиками электронов и располагаются соответственно величине окислительно—восстановительного потенциала следующим образом: B, С1, С, а, а3.
Цитохромоксидаза включает комплекс цитохромов а и а3 (комплекс IV). Цитохромоксидаза кроме гема содержит ионы меди, которые способны менять валентность и таким способом участвовать в переносе электронов:
Цитохромоксидаза переносит электроны с цитохрома С на кислород. В переносе электронов участвуют сначала ионы железа цитохромов а и а3, а затем ион меди цитохрома а3.
Белки, содержащие негеминовое железо. Некоторое количество атомов железа в митохондриях связано не в геме цитохромов, а образует комплексы с другими белками. Эти белки называют также железосерными, так как атомы железа связаны с атомами серы цистеиновых остатков. Белки, содержащие негеминовое железо, участвуют в переносе электронов на нескольких стадиях, однако, не совсем ясны их локализация и механизм действия.
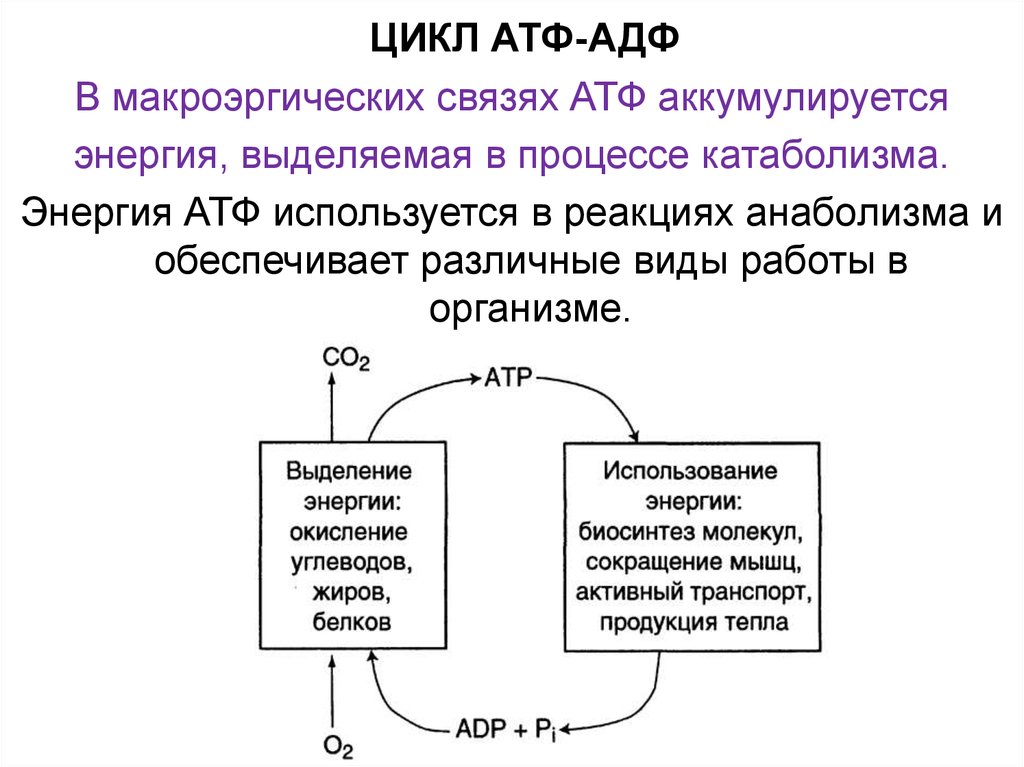
Энергию АТФ все клетки используют для процессов биосинтеза, движения, производство тепла, нервных импульсов, свечений (например, улюминисцентных бактерий), то есть для всех процессов жизнедеятельности. АТФ - универсальный биологический аккумулятор энергии.

6. Субстратное фосфорилирование: сущность, биологическое
значение процесса, примеры.
Синтез АТФ, протекающий помимо дыхательной цепи либо за счет окисления, либо за счет молекулярной перестройки субстрата, называют субстратным фосфорилированием.Синтез АТФ в значительно меньшем объеме может происходить и помимо дыхательной цепи за счет анаэробного окисления субстратов или их молекулярной перестройки – субстратное фосфорилирование.
Пример преобразование 2-фосфоглицериновой кислоты в пировиноградную кислоту:
1)отщепление молекулы воды енолазой с запасанием высвободившейся энергии в макроэргической связи с остатком фосфорной кислоты;
2)перефосфорилированиес АДФ;
Субстратное фосфорилирование участвует в анаэробном расщеплении глюкозы. За счет субстратного фосфорилирования 1 молекулы глюкозы синтезируется 6 молекул АТФ.
7. Окислительное фосфорилирование: сущность, биологическое значение процесса.
Энергия, образующаяся при прохождении потока электронов по дыхательной цепи, используется для сопряженного фосфорилирования АДФ. Эти два
процесса взаимозависимы: окисление не может протекать в отсутствие АДФ.
Соотношение окисления и фосфорилирования определяется коэффициентом
P/O, показывающим, какое количество Рi используется на образование АТФ
при превращении одного грамм-атома О2 в Н2О (количество моль фосфорилированного АДФ на 1/2 моль кислорода). Коэффициент Р/О называется коэффициентом окислительного фосфорилирования и зависит от точки вхождения восстановительных эквивалентов в цепь транспорта электронов. Например, для субстратов, окисляемых NAD-зависимой дегидрогеназой, Р/О=3, так как в дыхательной цепи есть три участка, где перенос электронов сопряжен с синтезом АTФ. Не все субстраты передают электроны и протоны на NAD, некоторые окисляются FAD-зависимыми дегидрогеназами, которые переносят протоны иэлектроны сразу на убихинон, минуя комплекс I. В этом случае Р/О=2. В действительности коэффициент фосфорилирования всегда меньше теоретической
величины, потому что часть энергии, высвобождающейся при транспорте электронов, расходуется не на синтез АТФ, а для переноса веществ через митохондриальную мембрану.
В сутки человек потребляет в среднем 27 моль кислорода. Основное его количество (примерно 25 моль) используется в митохондриях в дыхательной цепи.
Следовательно, ежесуточно синтезируется 125 моль АTФ или 62 кг (при расчетеиспользовали коэффициент Р/О=2,5, то есть среднее значение коэффициентафосфорилирования). Масса всей АТФ, содержащейся в организме, составляетпримерно 20–30 г. Итак, можно сделать вывод, что каждая молекула АTФ за сутки 2500 раз проходит процесс гидролиза и синтеза, что и характеризует интенсивность обмена АTФ.
8. Цепь переноса электронов (ЦПЭ), сопряжение дыхания и
синтеза АТФ в митохондриях, коэффициент окислительного
фосфорилирования. Ингибиторы и разобщители ЦПЭ.
Цепь переноса электронов (ЦПЭ)
Имеется два пути синтеза АТФ в клетке: 1) окислительное фосфорилирование и 2) субстратное фосфорилирование.
Окислительное фосфорилирование является главным путем синтеза АТФ из АДФ. С помощью этого механизма в клетках миокарда и скелетных мышц синтезируется около 90% АТФ. Реакция энергетически сопряжена с переносом электронов с восстановленных коферментов на кислород и требует наличия неповрежденной митохондриальной мембраны. Альтернативный путь синтеза АТФ из АДФ – субстратное фосфорилирование. В этом случае происходит перенос фосфата с высокоэнергетических фосфатов клетки на АДФ с образованием АТФ. Это происходит в ходе креатинкиназной реакции:
а) Креатинфосфат + АДФ → креатин + АТФ
и в ходе 2-х реакций гликолиза: фосфоглицераткиназной и пируваткиназной
б) 1,3-дифосфоглицерат + АДФ → 3-фосфоглицерат + АТФ
в) фосфоенолпируват + АДФ → пируват + АТФ
В этом случае механизм сопряжения не нуждается в наличии кислорода и неповрежденной митохондриальной мембраны.
Дыхательная цепь
Окисление субстратов в процессе дыхания можно представить как перенос электронов и протонов от органических веществ на кислород:
SH2+ ½O2®S+H2O
Перенос электронов на кислород происходит при участии системы переносчиков, встроенных во внутреннюю мембрану митохондрий и образующих цепь переноса
электронов (ЦПЭ) или дыхательную цепь. В состав ЦПЭ входят 4 ферментативных комплекса: НАДН-дегидрогеназа (I), сукцинатдегидрогеназа (II),Q·H2-дегидрогеназа, цитохромоксидаза (IV), а также 2 низкомолекулярных переносчика: гидрофобная молекула коферментаQи цитохром С – небольшой по размерам белок. Все компоненты ЦПЭ расположены в митохондриальной мембране в порядке возрастания редокс потенциала (окислительно-восстановительного потенциала); самый высокий редокс–потенциал у кислорода. Это обеспечивает последовательное перемещение электронов от НАДН на кислород, при этом происходит выделение энергии на каждом этапе ЦПЭ.
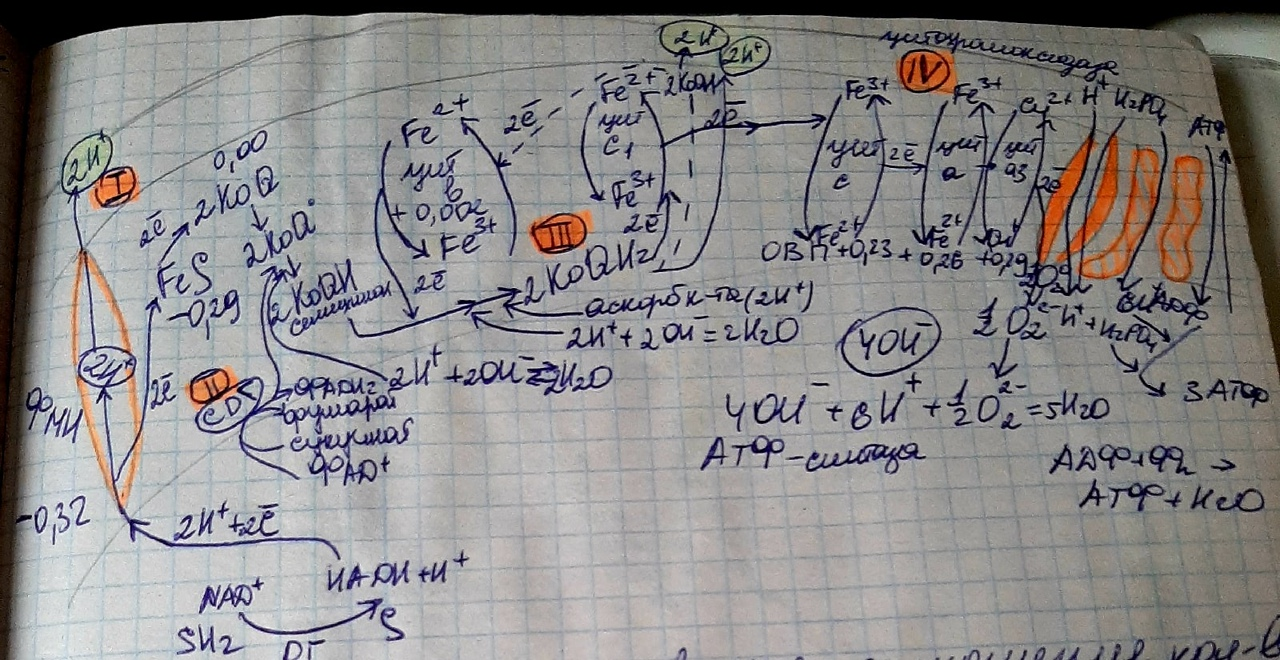
Рис. 1. Митохондриальная цепь переноса электронов.
Атомы водорода или электроны перемещаются по цепи от более электроотрицательных компонентов к более электроположительному кислороду. Изменение окислительно-восстановительного потенциала при переходе от системы НАД+/НАДН к системе О2/Н2О составляет 1,1 В.
Водород от первичных доноров вводится в дыхательную цепь с участием НАД-зависимых (цитрат, 2-оксоглутарат, малат, пируват, глутамат) или ФАД-зависимых дегидрогеназ (сукцинат, ацил-КоА, глицерол-3-фосфат). НАД-зависимые дегидрогеназы переносят водород на НАД+(с образованием НАДН·Н+), а ФАД-зависимые дегидрогеназы – на ФАД (с образованием ФАД·Н2). Далее с НАДН·Н+водород при участии НАДН-дегидрогеназы (Iкомплекса) передается на КоQс образованием КоQ·H2. НАДН-ДГ представляет собой ФМН-содержащий фермент. С ФАД·Н2водород при участии СДГ (IIкомплекс) также передается на КоQс образованием КоQ·H2. КоQили убихинон является компонентом митохондриальных липидов. Его содержание значительно превосходит содержание других компонентов дыхательной цепи, поэтому считается, что КоQявляется подвижным компонентом дыхательной цепи, который получает восстановительные эквиваленты от фиксированных флавопротеиновых комплексов и передает их на цитохромы. Цитохромы – это переносящие электроны белки, молекула которых содержит в качестве простетической группы гем. Цитохромы дыхательной цепи выстроены в порядке возрастания окислительно-восстановительного потенциала и обозначаются латинскими буквами:b,c1,c,aиa3. Терминальный цитохром а-а3, называемый также цитохромоксидазой, осуществляет перенос восстановительных эквивалентов на молекулярный кислород. Цитохромоксидаза содержит медь и имеет очень высокое сродство к кислороду, что позволяет дыхательной цепи функционировать с максимальной скоростью до тех пор, пока в ткани не будет практически исчерпан кислород:
О2+ 4e+ 4H+®2 Н2О
Дополнительным компонентом, находящимся в дыхательной цепи, является железо-серный белок, FeS(негемовое железо). Полагают, что он участвует в окислительно-восстановительном процессе, протекающем по одноэлектронному механизму.
Для объяснения механизма сопряжения окисления и фосфорилирования было выдвинуто несколько гипотез, из которых экспериментальное подтверждение получила только хемиосмотическая теория, предложенная Питером Митчеллом в 1961 году. Согласно этой теории первичным процессом в окислительном фосфорилировании является транслокация протонов (Н+) на наружную сторону внутренней митохондриальной мембраны. При этом предполагается, что мембрана непроницаема для ионов вообще и особенно для протонов, которые накапливаются на наружной стороне мембраны, создавая по обе стороны мембраны разность электрохимических потенциалов (Dmн+). Она складывается из химического потенциала (разность рН) и электрического потенциала. Разность электрохимических потенциалов обеспечивает действие локализованной в мембране АТФ-синтазы, которая в присутствии АДФ и Фн синтезирует АТФ.
Предполагается, что дыхательная цепь уложена в мембране в виде трех окислительно-восстановительных петель, каждая из которых состоит из переносчиков водорода и переносчиков электронов:
АТФ-синтаза по своей структуре похожа на гриб. При этом шляпка гриба, представляющая собой фосфорилирующие субъединицы (F1-субъединица), ответственные за образование АТФ, находятся на поверхности внутренней мембраны, обращенной в матрикс. А ножка гриба представляет собой канальную часть (Fo-субъединица) АТФ-синтазы, пронизывающей всю толщу внутренней мембраны. Электрохимический потенциал заставляет протоны двигаться с наружной поверхности внутрь, кF1-субъединице, обладающей каталитической активностью, т.е. способностью катализировать образование АТФ из АДФ и Фн (Н3РО4).
Коэффициент фосфорилирования
Оценка эффективности улавливания энергии интактными митохондриями показывает, что при окислении субстратов, идущем с участием НАД-зависимых дегидрогеназ и дыхательной цепи, происходит включение 3 молей неорганического фосфата в АДФ и образуется 3 моля АТФ на ½ моля потребленного кислорода. Отношение Р/О (коэффициент фосфорилирования) = 3. В то же время при окислении субстрата через флавопротеиновую дегидрогеназу образуется только 2 моля АТФ, т.е. Р/О = 2.
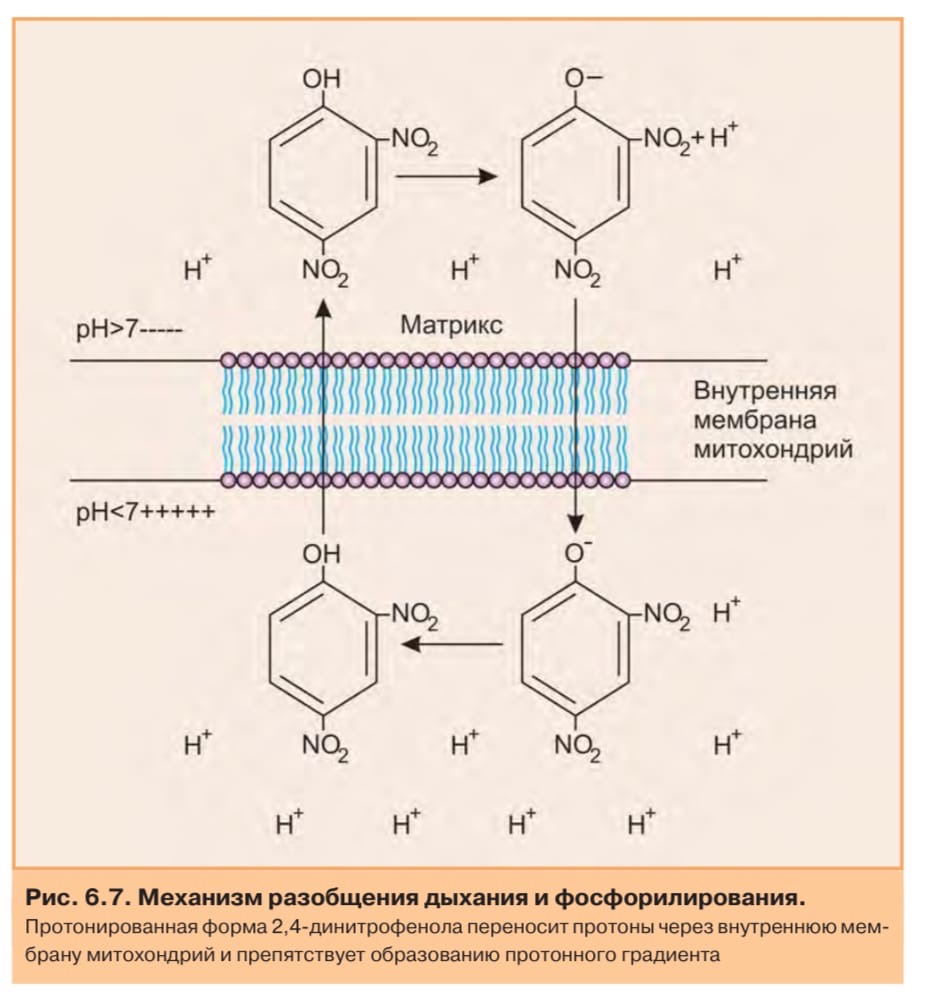
Ингибиторы тканевого дыхания
Ингибиторы окисления прерывают поток электронов на участках дыхательной цепи, блокируя одно из трех звеньев образования протонного потенциала, Первая группа препаратов блокирует поток электронов на участке между НАД и КоQ. К этим препаратам относятся барбитураты - амитал или барбамил (малые транквилизаторы), ротенон (инсектицид), пиерицидин (антибиотик).
Вторая группа ингибиторов окисления, к которым относится антимицин А (антибиотик) блокирует поток электронов на участке цит. b566-FeS-белок, т.е. на уровне второго звена сопряжения.
Третья группа ингибиторов окисления, к которым относятся цианиды, азиды, оксид углерода, сероводород блокируют цитохромоксидазу.
Ингибиторы фосфорилирования действуют на АТФ-синтазу, препятствуя использованию протонного потенциала для синтеза АТФ. К этим веществам относятся олигомицин и дициклокарбодиимид.
УЧЕБНИК
Цепь переноса электронов — ЦПЭ
Указанное выше уравнение для окислительно-восстановительной реакции
представляет собой обобщенную форму, так как изображает процесс окисления субстратов как прямое дегидрирование, причем кислород выступает в роли непосредственного акцептора водорода. На самом деле кислород получает электроны иным образом. Существуют промежуточные переносчики при транспорте электронов от исходного донора электронов SH2 к терминальному акцептору — О2. Полный процесс представляет собой цепь последовательных окислительно-восстановительных реакций, в ходе которых происходит взаимодействие между переносчиками. Каждый промежуточный переносчик вначале выступает в роли акцептора электронов и протонов и из окисленного состояния переходит в восстановленную форму. Затем он передает электрон следующему переносчику и снова возвращается в окисленное состояние. На последней стадии переносчик передает
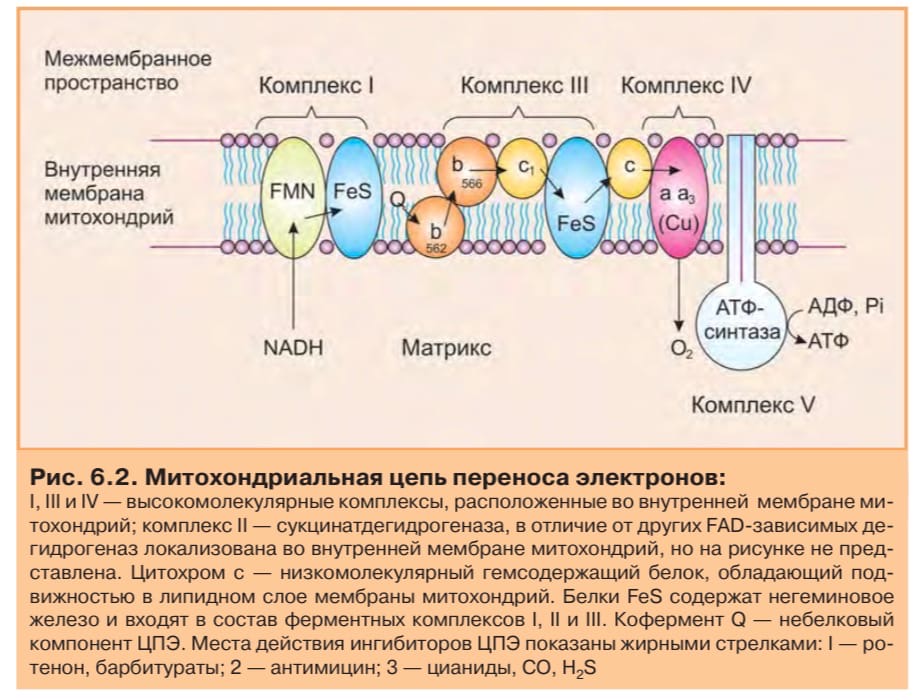
электроны кислороду, который затем восстанавливается до воды. Совокупность последовательных окислительно-восстановительных реакций называется цепью переноса (транспорта) электронов, или дыхательной цепью (рис. 6.2).
Промежуточными переносчиками в дыхательной цепи у высших организмов
являются коферменты: NAD+ (никотинамид-адениндинуклеотид), FAD и FMN(флавинадениндинуклеотид и флавинмононуклеотид), кофермент Q (CoQ), семейство гемсодержащих белков — цитохромов (обозначаемых как цитохромы b,c1, c, a, a3) и белки, содержащие негеминовое железо. Все участники этой цепи организованы в четыре окислительно-восстановительных комплекса (рис. 6.5), связанные убихиноном (CoQ) и цитохромом c.
Процесс начинается с переноса протонов и электронов от окисляемого
субстрата на коферменты NAD+ или FAD. Это определяется тем, является ли
дегидрогеназа, катализирующая первую стадию, NAD-зависимой или FADзависимой. NAD-зависимая дегидрогеназа катализирует реакции окисления непосредственно субстрата (первичная дегидрогеназа). NAD+ является коферментом и выполняет роль акцептора водорода (рис. 6.3). FAD-зависимая дегидрогеназа также выполняет функцию первичной дегидрогеназы. Кофермент FAD является акцептором водорода от субстрата. Если процесс начинается с NAD+, то следующим переносчиком будет NADH-дегидрогеназа, коферментом которой является FMN.

Тип участвующей дегидрогеназы зависит от природы субстрата. Но каким бы
ни был исходный субстрат, электроны и протоны от флавинов переносятся к
коферменту Q, а дальше пути электронов и протонов расходятся. Электроны с помощью системы цитохромов достигают кислорода, который затем, присоединяя протоны, превращается в воду. Чтобы разобраться в системе транспорта электронов, необходимо познакомиться с отдельными ее участниками.
Символ 2Н+ означает два протона, обычно переносимые в виде гидрида
иона. В этом случае вместо терминов «донор электронов» и «акцептор электронов» иногда используют термины «донор или акцептор водорода».
NADH-дегидрогеназа катализирует окисление NADH и восстановление
убихинона (CoQ). Переносчиком водорода является кофермент — FMN (комплекс I на рис. 6.5). Строение FMN представлено на рис. 6.3. В процессе реакции водород сначала присоединяется к FMN, соединенному с ферментом, а затем протоны поступают в межмембранное пространство, а электроны с помощью FeS-белков передаются на убихинон. Флавиновые коферменты (FAD и FMN) содержат производные витамина B2 и прочно связаны с ферментом, поэтому ферменты, в состав которых они входят, называются флавопротеинами. Акцептором электронов от комплекса I является убихинон (кофермент Q) — производное изопрена, его название возникло из-за повсеместной распространенности в природе.
Получая 2e из матрикса митохондрий, он восстанавливается в убихинол. Кофермент Q действует как переносчик электронов на цитохромы. Цитохромы — это гемопротеины, содержащие в качестве простетической группы гем, прочно связанный с белковой частью. Атом железа в геме может менять валентность, присоединяя или отдавая электроны:
В дыхательной цепи цитохромы служат переносчиками электронов и располагаются соответственно величине окислительно-восстановительного потенциала следующим образом: b, c1, c, а, а3. Гемовые группы цитохромов связаны сбелковой частью координационными связями между ионом железа и соответствующими аминокислотными остатками.
В цитохромах c и c1 дополнительные ковалентные связи формируются между тиоловыми группами цистеина и боковыми винильными группами гема. QН2-дегидрогеназа (комплекс III на рис. 6.5) представляет собой комплекс цитохромов b и c1. Этот фермент катализирует окисление восстановленногокофермента Q и перенос электронов на цитохром c. Электроны последовательно переносятся атомами железа цитохромов b и c1, а затем поступают на цитохром c. В то же время протоны за счет энергии, выделяющейся в процессе транспорта e- с цитохрома b на цитохром с, выделяются в межмембранное пространство. Цитохромоксидаза включает комплекс цитохромов а и а3 (комплекс IV на рис. 6.5). Цитохромоксидаза кроме гема содержит ионы меди, которые способны менять валентность и таким способом участвовать в переносе электронов:
Цитохромоксидаза переносит электроны с цитохрома c на кислород. В переносе электронов участвуют сначала ионы железа цитохромов а и а3, а затем ион меди цитохрома а3. Молекула кислорода связывается с железом в геме цитохрома а3. Следовательно, переход электронов на кислород с иона меди цитохромаа3 происходит на молекуле фермента. Каждый из атомов молекулы кислородаприсоединяет по два электрона и протона, образуя при этом молекулу воды.
9. Окислительное декарбоксилирование пировиноградной кислоты: схема процесса, связь с синтезом АТФ. Строение пируватдегидрогеназного комплекса: ферменты, коферменты, регуляция процесса.
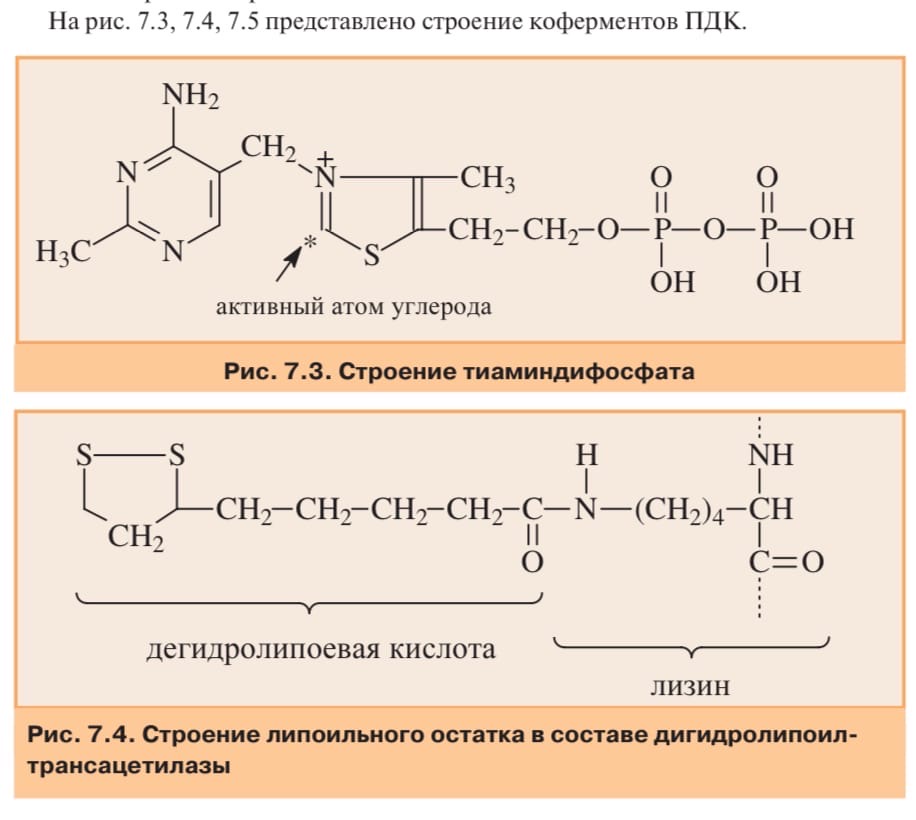
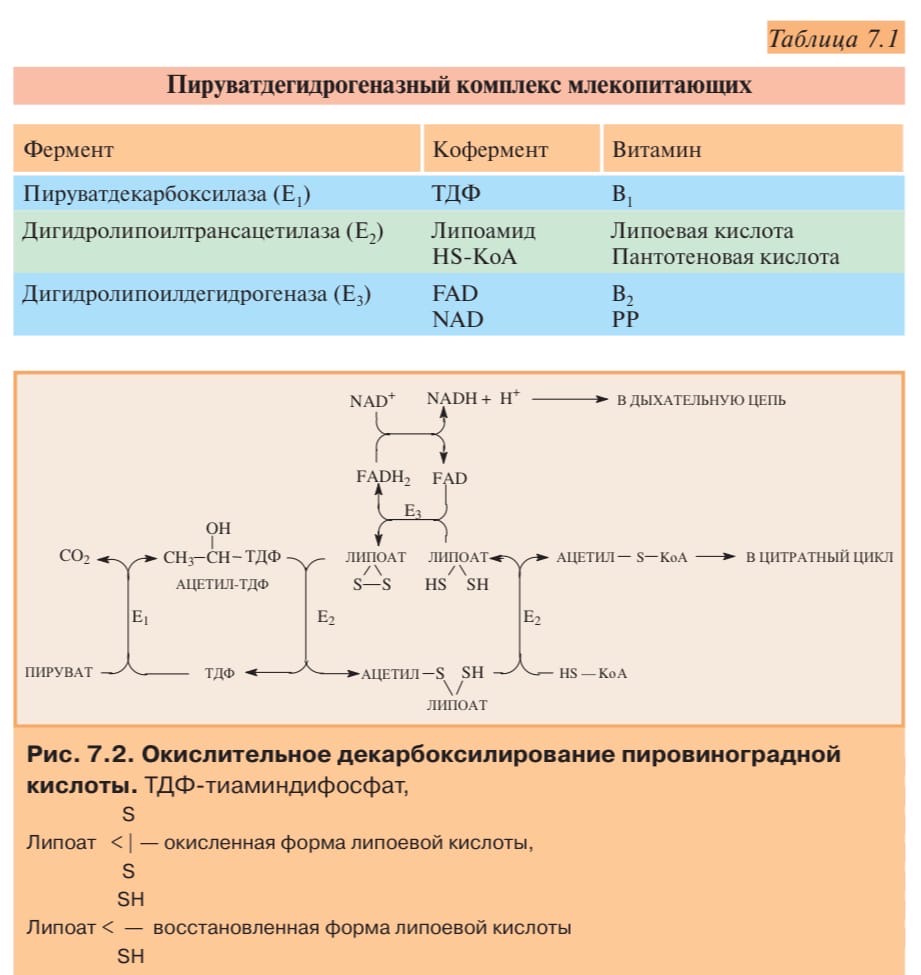
ОКИСЛИТЕЛЬНОЕ ДЕКАРБОКСИЛИРОВАНИЕ ПИРОВИНОГРАДНОЙ КИСЛОТЫ
Пировиноградная кислота (ПВК, пируват) является продуктом окисления глюкозы и некоторых аминокислот. Ее судьба различна в зависимости от доступности кислорода в клетке. В анаэробных условиях она восстанавливается домолочной кислоты. Ваэробных условиях происходит ееокислительное декарбоксилирование до уксусной кислоты, переносчиком которой служит коэнзим А.
Суммарное уравнение реакции отражает декарбоксилирование пирувата, восстановление НАД до НАДН и образование ацетил-S-KoA.
Превращение состоит из пяти последовательных реакций, осуществляется мультиферментным комплексом, прикрепленным к внутренней митохондриальной мембране со стороны матрикса. В составе комплекса насчитывают3 фермента и5 коферментов:
Пируватдегидрогеназа (Е1,ПВК-дегидрогеназа),ее коферментом являетсятиаминдифосфат, катализирует1-ю реакцию.
Дигидролипоат-ацетилтрансфераза(Е2), ее коферментом является липоевая кислота, катализирует2-юи3-юреакции.
Дигидролипоат-дегидрогеназа (Е3), кофермент –ФАД, катализирует4-юи5-юреакции.
Помимо указанных коферментов, которые прочно связаны с соответствующими ферментами, в работе комплекса принимают участие коэнзим А иНАД.
Суть первых трех реакций сводится к декарбоксилированию пирувата (катализируется пируватдегидрогеназой, Е1), окислению пирувата до ацетила и переносу ацетила на коэнзим А (катализируетсядигидролипоамид-ацетилтрансферазой,Е2).
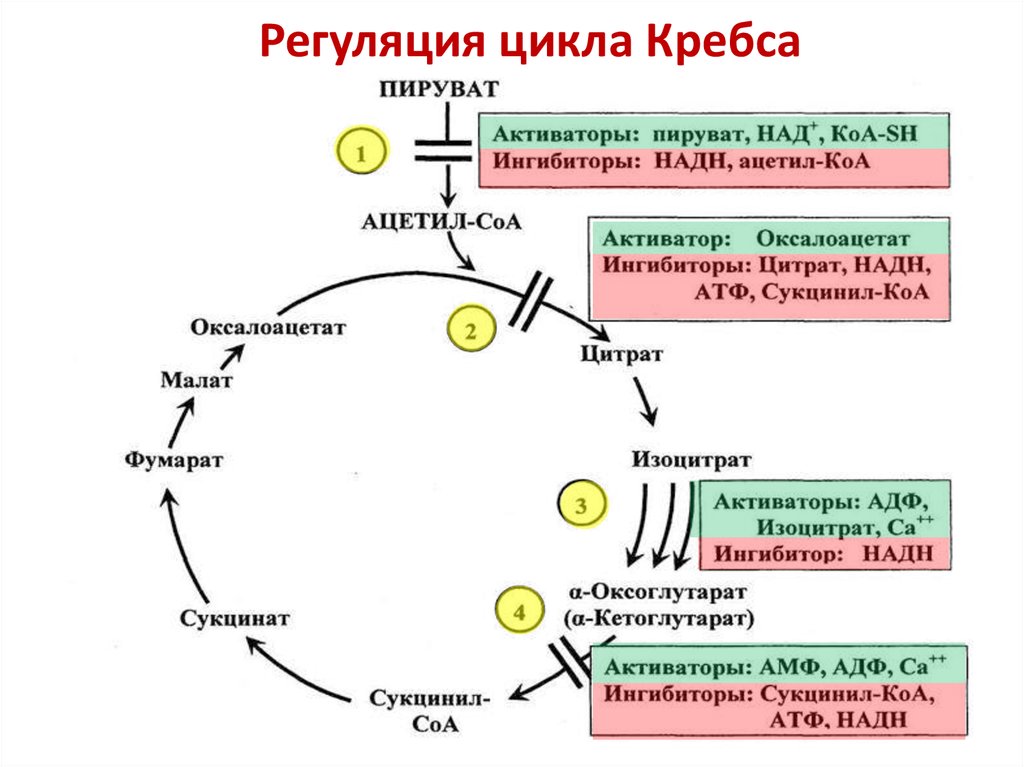
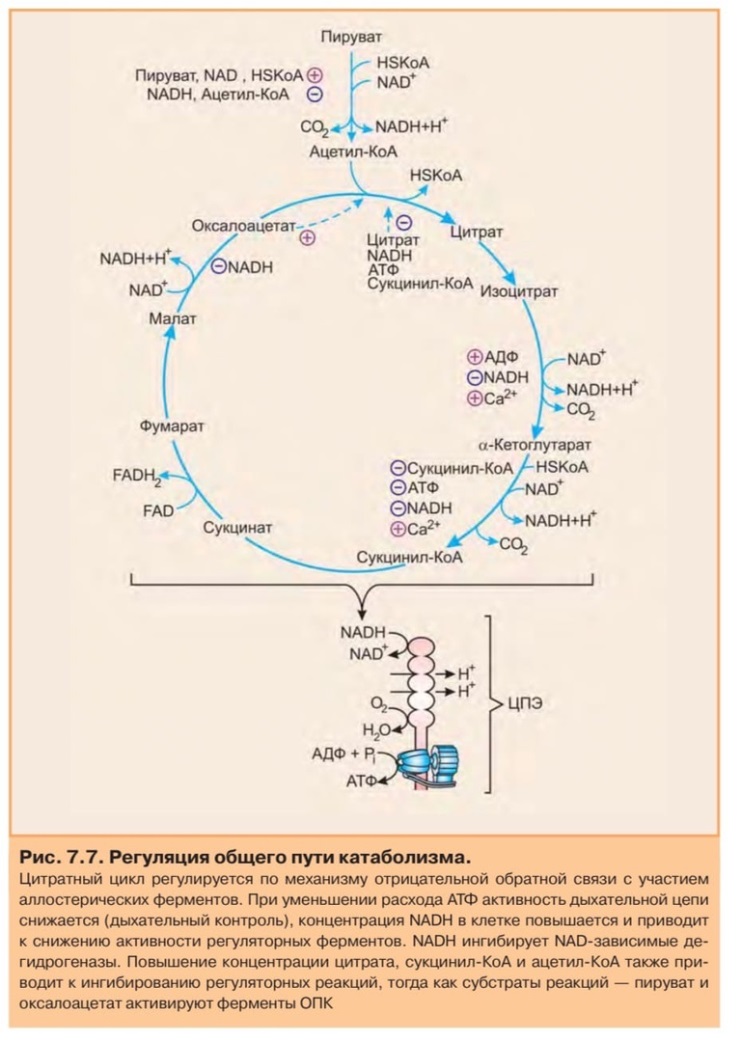
10. Цикл трикарбоновых кислот (ЦТК). Биологическая роль.
Цикл трикарбоновых кислот (цикл Кребса)
Цикл трикарбоновых кислот впервые был открыт английским биохимиком Кребсом. Он первым постулировал значение данного цикла для полного сгорания пирувата, главным источником которого является гликолитическое превращение углеводов. В дальнейшем было показано, что цикл трикарбоновых кислот является "фокусом", в котором сходятся практически все метаболические пути.
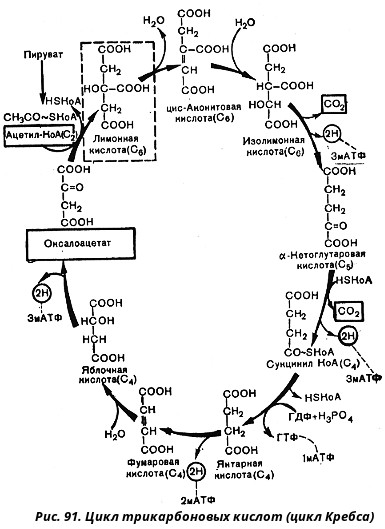
Итак, образовавшийся в результате окислительного декарбоксилирования пирувата ацетил-КоА вступает в цикл Кребса. Данный цикл состоит из восьми последовательных реакций (рис. 91). Начинается цикл с конденсации ацетил-КоА с оксалоацетатом и образования лимонной кислоты. (Как будет видно ниже, в цикле окислению подвергается собственно не ацетил-КоА, а более сложное соединение - лимонная кислота (трикарбоновая кислота).)
Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и дскарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса появляется оксалоацетат (четырехуглеродное соединение), т. е. в результате полного оборота цикла молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула оксалоацетата регенерируется. Ниже приводятся все восемь последовательных реакций (этапов) цикла Кребса.
В первой реакции, катализируемой ферментом цитратсинтазой, ацетил-КоА конденсируется с оксалоацетатом. В результате образуется лимонная кислота:
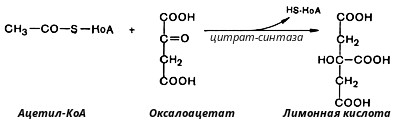
По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
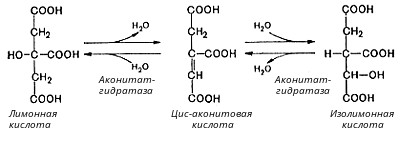
Во второй реакции цикла образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту. Катализирует эти обратимые реакции гидратации-дегидратации фермент аконитат-гидратаза:
В третьей реакции, которая, по-видимому, лимитирует скорость цикла Кребса, изолимонная кислота дегидрируется в присутствии НАД-зависимой изоцитратдегидрогеназы:
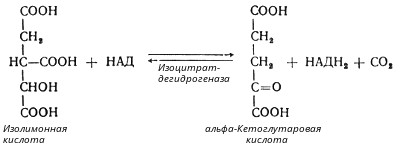
(В тканях существует два типа изоцитратдегидрогеназ: НАД- и НАДФ-зависимые. Установлено, что роль основного катализатора окисления изолимонной кислоты в цикле Кребса выполняет НАД-зависимая изоцитратдегидрогеназа.)
В ходе изоцитратдегидрогеназной реакции изолимонная кислота декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg2+ или Мn2+.
В четвертой реакции происходит окислительное декарбоксилирование α-кетоглутаровой кислоты до сукцинил-КоА. Механизм этой реакции сходен с реакцией окислительного декарбоксилирования пирувата до ацетил-КоА. α-Кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в ходе реакции принимают участие пять коферментов: TДФ, амид липоевой кислоты, HS-KoA, ФАД и НАД. Суммарно данную реакцию можно написать так:

Пятая реакция катализируется ферментом сукцинил-КоА-синтетазой. В ходе этой реакции сукцинил-КоА при участии ГДФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ1 за счет высокоэргической тиоэфирной связи сукцинил-КоА:
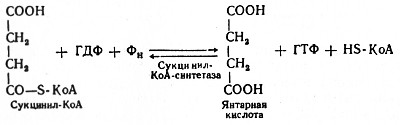
(Образовавшийся ГТФ отдает затем свою концевую фосфатную группу на АДФ, вследствие чего образуется АТФ. Образование высокоэргического нуклеозидтрифосфата в ходе сукцинил-КоА-синтетазной реакции - пример фосфорилирования на уровне субстрата.)
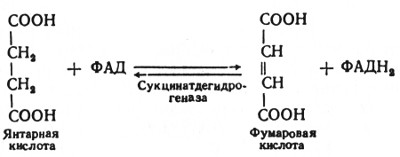
В шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком ковалентно связан кофермент ФАД:
В седьмой реакции образовавшаяся фумаровая кислота гидратируется под влиянием фермента фумаратгидратазы. Продуктом данной реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью, - в ходе данной реакции образуется L-яблочная кислота:

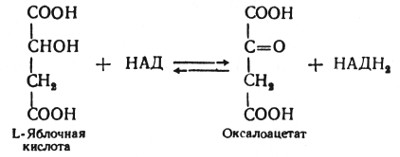
Наконец, в восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:
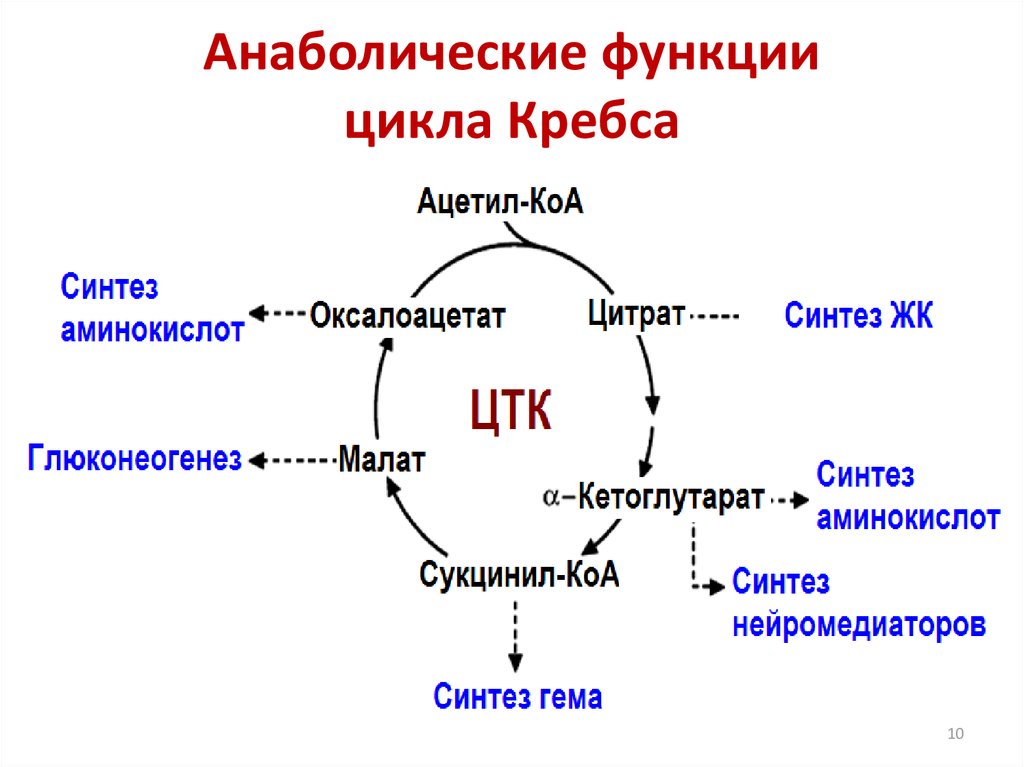
11. Регуляция и анаболическая функция ЦТК.