
- •1. Экзаменационные вопросы
- •Ферменты. Номенклатура. Классификация ферментов.
- •Уровни организации ферментов.
- •Механизм действия ферментов. Понятие об активном центре фермента, этапы ферментативного катализа.
- •Кинетика ферментативных реакций. Зависимость скорости ферментативной реакции от различных факторов. Уравнение Михаэлиса-Ментен, роль Кm и Vmax в характеристике фермен- тов.
- •Ингибиторы ферментов. Типы ингибирования. Графическое представление зависимости скорости ферментативной реакции от присутствия ингибиторов различных типов.
- •Механизмы регуляции активности ферментов. Примеры.
- •Аллостерические ферменты. Регуляция их активности. При- меры.
- •Введение в обмен веществ. Биологическое окисление
- •Важнейшие признаки живой материи. Особенности живых организмов, как открытых термодинамических систем.
- •1 Закон термодинамики:
- •2 Закон термодинамики:
- •Обмен углеводов
- •1 Схема-
- •2 Схема-
- •3 Этап оу – промежуточный обмен
- •Роль фосфорилазы при мобилизации гликогена
- •Обмен аминокислот, белков и нуклеотидов
- •Глюкозо-аланиновый цикл
- •Реакции глюкозо-аланинового цикла (выделен рамкой). Реакции, связанные с транспортными формами аммиака
- •Обмен липидов и липопротеидов
- •Гидролиз эфиров холестерина
- •Стеаторея
- •Процесс β- окисления: локализация, последовательность реакций, ферменты. Биологическое значение. Регуляция процесса β-окисления. Энергетический эффект окисления вжк (на примере пальмитиновой кислоты).
- •Этапы биосинтеза желчных кислот
- •Регуляция синтеза желчных кислот
- •Образование вторичных желчных кислот. Энтерогепатический цикл.
- •Метаболизм кетоновых тел при голодании
- •Биологические мембраны. Перекисное окисление липидов
- •1. Основные мембраны клетки и их функции.
- •2. Строение и состав мембран: структура и свойства липидов,белков, углеводов мембран. Общие свойства мембран и их функции.
- •3. Трансмембранный перенос малых молекул. Типы переноса веществ через мембрану. Трансмембранный перенос макромолекул и частиц. Механизмы мембранного транспорта
- •Проницаемость плазматической мембраны
- •Пассивный транспорт
- •Простая диффузия
- •Облегченная диффузия
- •Особенности облегченной диффузии
- •Активный транспорт
- •Ионные каналы
- •Эндоцитоз
- •Экзоцитоз
- •Функции биологических мембран
- •4. Механизмы трансмембранной передачи гормонального сигнала в клетку.
- •5. Активные формы кислорода (афк). Биологическое действие афк. Ферментативные и неферментативные системы, генерирующие афк.
- •6. Стадии свободно-радикального окисления липидов.
- •7. Повреждающее действие первичных и вторичных продуктов пероксидного окисления на мембраны и другие структуры клетки.
- •8. Ферментативные системы антирадикальной защиты. Катализируемые реакции.
- •9. Неферментативные системы антирадикальной защиты и их физиологическое значение.
- •10. Роль афк в механизме фагоцитоза. Кислородзависимые и кислороднезависимые механизмы фагоцитоза. Роль афк в антимикробной защите грудного молока.
- •11.Роль пероксидного окисления при гипоксии (ишемии). Факторы гипоксии, инициирующие пол. Понятие о «кислородном» и «кальциевом» парадоксах.
- •12. Простагландины и лейкотриены: схема синтеза и их биологические функции.
- •Гормоны. Гормональная регуляция метаболических процессов
- •Регуляция синтеза и секреции
- •Механизм действия
- •Мишени и эффекты
- •Патология Гипофункция
- •Биохимия питания и печени. Нервная, мышечная и соединительная ткани. Биохимия крови
- •Метаболизм скелетных мышц ( поперечно-полосатые мышцы)
- •Метаболизм скелетных мышц ( поперечно-полосатые мышцы)
- •Двойственная роль креатинфосфата
- •Пути генерации атф и восстановление атф в мышечных клетках миокарда
- •Механизм мышечного сокращения
- •Этапы цикла мышечного сокращения
- •Миозиновая регуляция сокращения
- •Сравнение актин-миозинового взаимодействия в 2-х видах мышц
- •Механизм расслабления поперечнополосатого мышечного волокна
- •Метаболические нарушения при инфаркте миокарда
- •Лабораторная диагностика инфаркта миокарда
- •Обмен железа: основные функции, пул железа в организме, всасывание в жкт, «ферритиновый блок».
- •Поступление экзогенного железа в ткани из кишечника
- •Нарушение метаболизма железа
Этапы биосинтеза желчных кислот
Синтез желчных кислот идет в эндоплазматическом ретикулуме печени при участии: цитохрома Р450, кислорода, НАДФН и аскорбиновой кислоты. В процессе синтеза жёлчных кислот холестерол подвергается гидроксилированию, восстановлению двойной связи в положении 5 и окислению боковой цепи. Образуется 2 типа первичных желчных кислот: холевая (гидроксильные группы в положениях 3, 7, 12 и хенодезоксихолевая (гидроксильные группы в 3, 7 положениях).
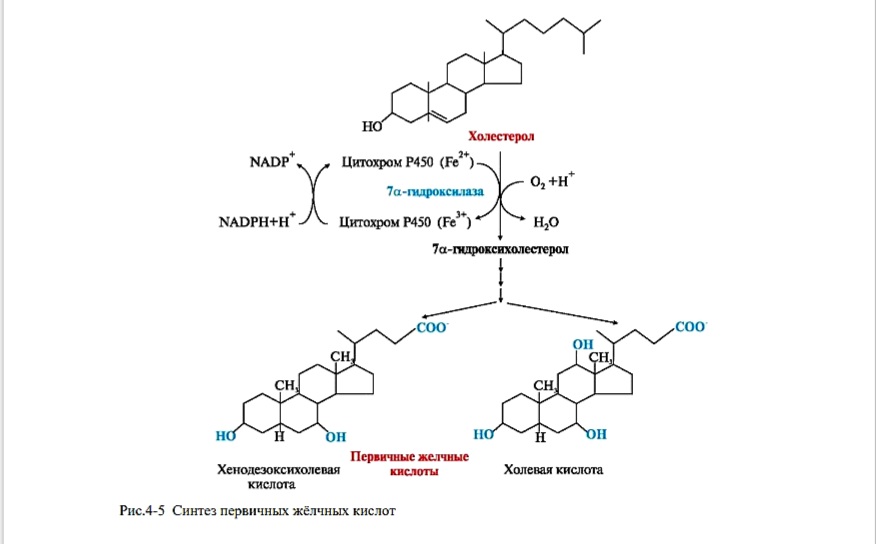
Рис.4-5 Синтез первичных жёлчных кислот
За сутки образуется 200-600 мг желчных кислот. Перед секрецией в просвет канальцев первичные желчные кислоты подвергаются конъюгации - связыванию с глицином и таурином. Это увеличивает их амфифильные и эмульгирующие свойства и снижает их цитотоксическое действие. Конъюгация начинается с образования активной формы жёлчных кислот - производных КоА. Затем присоединяется таурин или глицин, и в результате образуется 4 варианта конъюгатов: таурохолевая и таурохенодезоксихолевая, гликохолевая или гликохенодезоксихолевая кислоты.
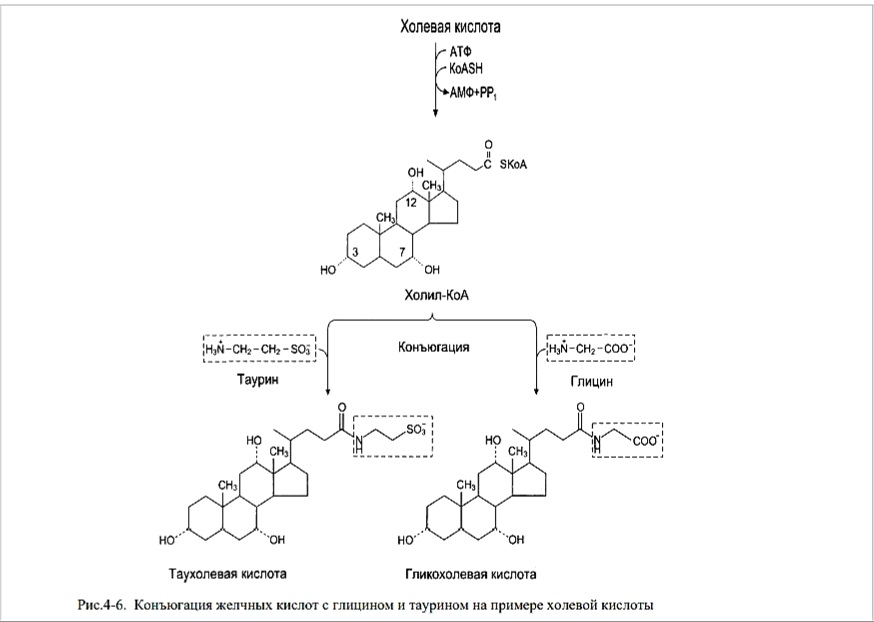
Рис.4-6. Конъюгация желчных кислот с глицином и таурином на примере холевой кислоты
Конъюгатов с глицином образуется в 3 раза больше, чем с таурином, так как количество таурина ограничено. Кислоты образуют натриевые или калиевые соли. В желчных протоках формируются мицеллы желчи состоящие из: желчных кислот, фосфолипидов, и холестерола в соотношении 12,5:2,5:1.
Регуляция синтеза желчных кислот
Ключевым ферментом процесса является 7а-гидроксилаза, которая катализирует первую реакцию синтеза желчных кислот.
Активность 7а-гидроксилазы регулируется:
• фосфорилированием/дефосфорилированием и
• на уровне экспрессии гена:
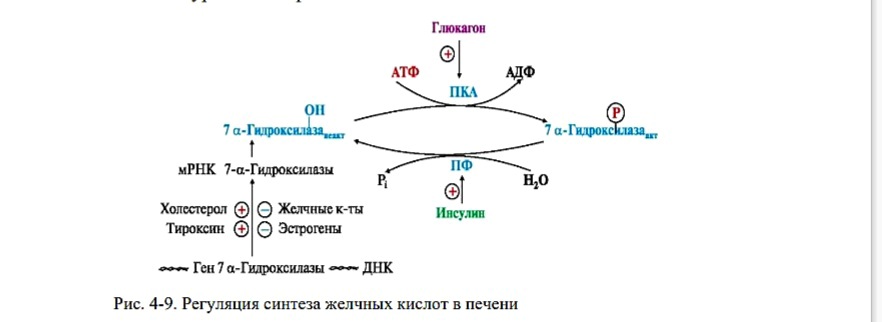
Рис. 4-9. Регуляция синтеза желчных кислот в печени
Гормон глюкагон взаимодействует с мембранными рецепторами аденилатциклазной системы и активирует фермент протеинкиназу А (ПКА), который фосфорилирует и активирует 7а-гидроксилазу. Возрастает скорость ключевой реакции процесса. Таким образом, глюкагон в постабсорбтивный период стимулирует синтез желчных кислот. Гормон инсулин в абсорбтивный период, взаимодействуя с рецепторами, активирует протеинфосфатазу, которая катализирует дефосфорилирование 7агидроксилазы и ее инактивацию.
Холестерол, его производные - желчные кислоты, эстрогены, а также гормон щитовидных желез тироксин регулируют количество фермента. Молекулы этих веществ связываются с определенными регуляторными зонами ДНК - энхансерами или сайленсерами, поэтому усиливают (+) или подавляют (- экспрессию гена 7агидроксилазы, соответственно изменяется количество этого фермента в клетке.
Желчные кислоты депонируются в желчном пузыре, из которого изливаются в двенадцатиперстную кишку после стимуляции кишечным гормоном холецистокинином во время приема пищи.
Образование вторичных желчных кислот. Энтерогепатический цикл.
В кишечнике большая часть желчных кислот под действием ферментов бактерий теряет глицин, таурин, ОН-группу в положении 7 и превращается во вторичные желчные кислоты литохолевую и дезоксихолевую. Отщепление полярных групп приводит к снижению растворимости кислот и затруднению их всасывания клетками кишечника.
Образование вторичных желчных кислот.
Далее желчные кислоты метаболизируются по одному из трех вариантов:
• выводятся с калом (0,3-0,5 г, 5-10%),
• всасываются в кишечнике и возвращаются в печень (большая часть)
• превращаются во вторичные кислоты (незначительно): литохолевую и дезоксихолевую кислоты под действием ферментов бактерий кишечника.
Каждая образованная молекула желчной кислоты проходит энтерогепатический круг 6-8 раз, прежде чем выведется из организма.
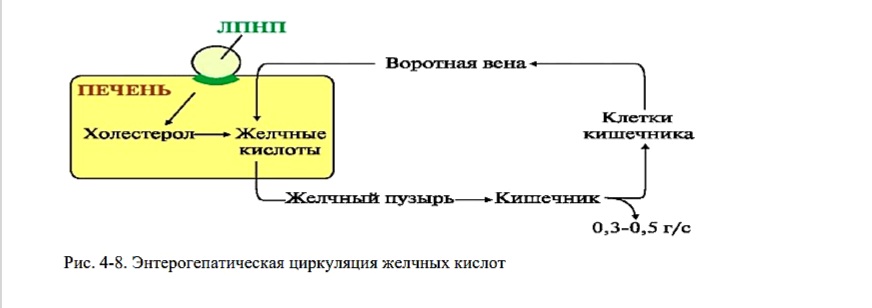
Рис. 4-8. Энтерогепатическая циркуляция желчных кислот
Биологическое значение и структуры кетоновых тел. Синтез кетоновых тел в печени; регуляция синтеза. Представление о кетонемии, кетонурии и кетоацидозе.
У здоровых нормально питающихся людей кетоновые тела синтезируются только в митохондриях гепатоцитов в незначительном количестве из АсКоА, который может либо поступить в ЦТК, либо превратиться в кетоновые тела: ацетон, ацетоацетат, β-гидроксибутират.
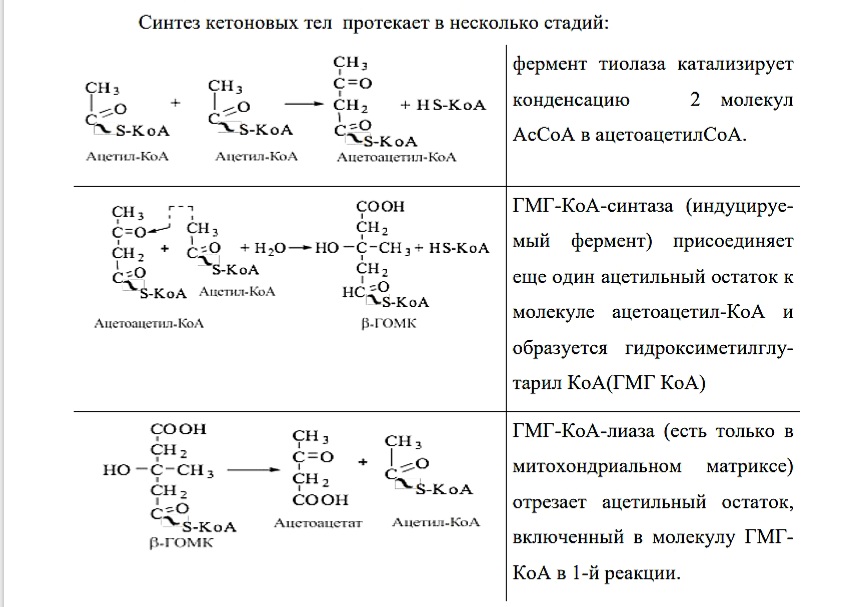
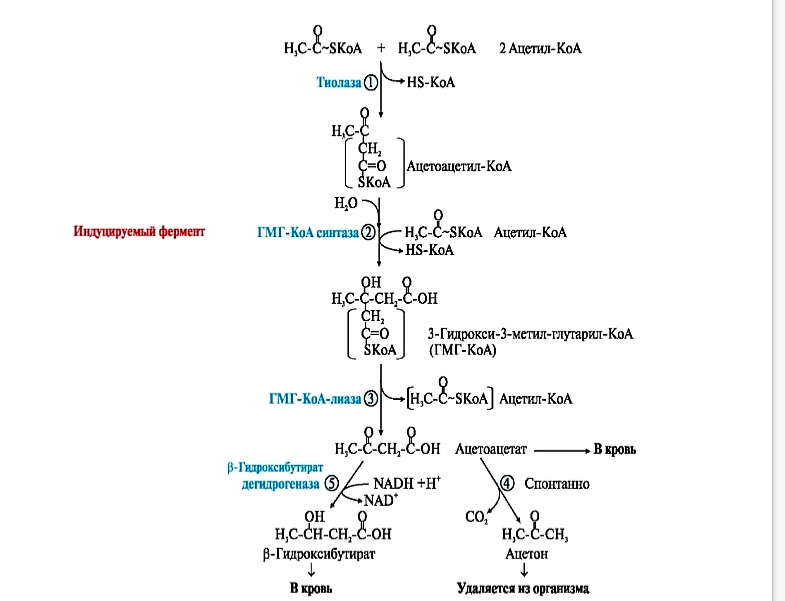
Синтез кетоновых тел протекает в несколько стадий:
фермент тиолаза катализирует конденсацию 2 молекул АсСоА в ацетоацетилСоА. ГМГ-КоА-синтаза (индуцируемый фермент) присоединяет еще один ацетильный остаток к молекуле ацетоацетил-КоА и образуется гидроксиметилглутарил КоА(ГМГ КоА) ГМГ-КоА-лиаза (есть только в митохондриальном матриксе) отрезает ацетильный остаток, включенный в молекулу ГМГКоА в 1-й реакции.
Образованный ацетоацетат может выходить в кровь и использоваться в других тканях в качестве источника энергии. В клетках печени при активном β-окислении создаётся высокая концентрация NADH, поэтому большая часть ацетоацетата превращается в β-гидроксибутират. Эта реакция легко обратима и относительные количества образующихся ацетоацетата и β-гидроксибутирата зависят от соотношения NADH/NAD в матриксе митохондрий.
В норме в сыворотке крови соотношение β-гидроксибутирата к ацетоацетату приблизительно равно 1:1. При высокой концентрации ацетоацетата часть его неферментативно декарбоксилируется с образованием ацетона, который полностью удаляется из организма с потом, мочой и выдыхаемым воздухомУ здорового человека ацетон образуется в очень малых количествах.
Синтез кетоновых тел
Регуляторный фермент синтеза кетоновых тел – гидроксиметилглутарилКоА синтаза (ГМГ-КоА синтаза). Это индуцируемый фермент, синтез которого увеличивается при повышении концентрации жирных кислот в крови. Это происходит при увеличении мобилизации жиров из жировой ткани под действием глюкагона, адреналина, секреция которых усиливается при голодании или физической нагрузке. Синтез ГМГ-КоА-синтазы репрессируется (выключается) при высоких концентрациях в клетке СоАSН.
Регуляция синтеза кетоновых тел осуществляется гормонами и зависит от поступления ВЖК в печень.
Активация синтеза кетоновых тел. У лиц, получающих сбалансированную пищу главным «топливом» для мозга является глюкоза. В противоположность этому сердечная и скелетная мышцы, корковый слой почек предпочтительно используют в качестве «топлива» ацетоацетат, а не глюкозу.
При голодании и диабете мозг начинает активно использовать ацетоацетат. Установлено, что в условиях длительного голодания 75 % потребности мозга в «топливе» удовлетворяется за счет ацетоацетата.
Синтез кетоновых тел активируется при физиологических состояниях:
– голодании,
– длительной физической нагрузке,
– сахарном диабете,
- употреблении жирной пищи,
- алкогольном отравлении.
Синтез кетоновых тел активируется при: повышении концентрации Ас-СоА и при увеличении активности ГМГ синтазы.
АсСоА накапливается, когда его образование превышает потребление. Повышение образования АсКоА при голодании, усиленных физических нагрузках, инсулинзависимом сахарном диабете объясняется тем, что в крови увеличивается уровень гормонов: адреналина и глюкагона и снижается уровень инсулина.
Активируются: - липолиз и повышается концентрация ВЖК (адреналин и глюкагон – активаторы ТАГ-липазы),
- β-окисление (ВЖК – активаторы карнитин-ацилтрансферзы I), снижается уровень НSСоА (используется в данном процессе).
Снижается потребление АсКоА за счет замедления скорости процессов:
- ЦТК: из-за снижения концентрации оксалоацетата, который расходуется на глюконеогенез и повышения уровня NADH и FADH2, (ускорено β-окисление)
- ингибиторов регуляторных ферментов ЦТК. - биосинтеза ВЖК: адреналин, глюкагон, ВЖК – ингибируют малонилкарбоксилазу.
Индуцируется синтез ГМГ-синтазы, поскольку повышается уровень ВЖК (индукторы) и снижается концентрация НSCoA (репрессор). Эти процессы приводят к активации синтеза кетоновых тел и глюконеогененза в период голодания, физической нагрузки и нелеченном сахарном диабете.
