
Учебное пособие 800463
.pdf
38
TdS dU dL |
(83) |
Соотношение (83) называют термодинамическим тождеством. Для необратимых циклов:
dQ |
0 . |
(84) |
|
|
|||
T |
|||
|
|
Пусть цикл состоит из необратимого процесса abc и обратимого cda (см. рис.).
|
dQ |
|
|
dQ |
` |
|
|
dQ |
0 или |
|||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
T |
abc |
T |
cda T |
|
|||||||||
|
|
|
|
dQ |
|
|
|
|
dQ |
. |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
abc |
|
T |
|
adc |
|
T |
|
|
|
|||||||
Так как для обратимого процесса: |
|
|||||||||||||||
|
|
dQ |
Sc |
|
Sa |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
adc |
|
T |
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
то |
|
|
|
dQ |
|
Sc |
Sa - значение интеграла меньше, чем изменение |
|||||||||
|
|
|
|
|
|
|
|
|||||||||
|
abc |
T |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
энтропии для необратимого процесса.
В дифференциальной форме это утверждение имеет вид:
dQ |
dS . |
|
|
||
T |
||
|
Обобщая это выражение для обратимых и необратимых процессов можно записать:
|
|
|
|
dQ |
dS . |
(85) |
|
|
|
|
|
||
|
|
|
|
T |
||
|
|
|
|
|
|
|
Для |
изолированной замкнутой |
системы (предоставленной самой себе): |
||||
dQ 0 |
и |
dS |
0 . |
|
|
|
Для обратимых процессов dS 0 |
и S1 S2 , а для необратимых: |
|||||
dS |
0 |
и S2 |
S1 (увеличивается). |
|||
Энтропия адиабатно замкнутой системы никогда не может уменьшаться. При этом энтропия отдельных тел системы может и уменьшаться и увеличиваться и оставаться без изменения под влиянием процессов, происходящих в системе.
Математическая формулировка второго закона термодинамики: |
|
dS 0 . |
(86) |
3.1.Изменение энтропии в процессах.
Запишем термодинамическое тождество TdS dU dL для реального газа при переменных V и T.
TdS |
U |
dT |
U |
dV pdV |
U |
dT |
U |
p dV . |
(87) |
|||
|
|
|
|
|
|
|||||||
T v |
V T |
T |
V |
|||||||||
|
|
|
v |
T |
|
|||||||
Используем вторую формулу первого закона термодинамики:
dQ dH Vdp или TdS dH Vdp , которая для реального газа при переменных Р и Т может быть записана:
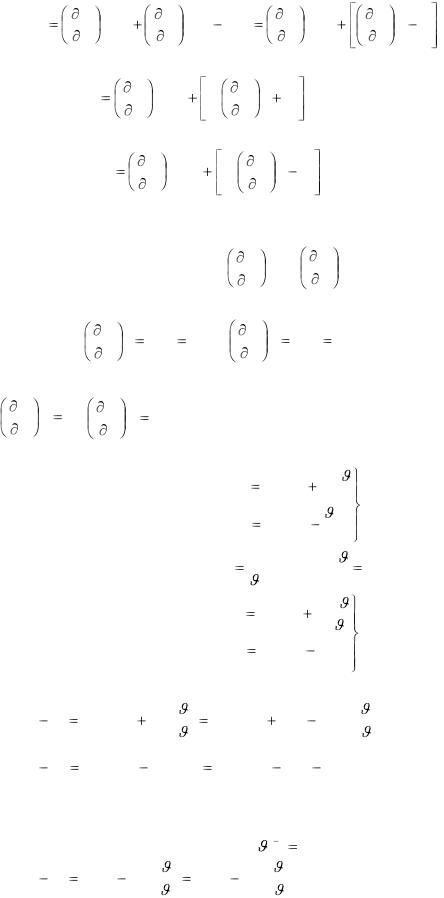
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
39 |
|
|
|
TdS |
H |
dT |
|
H |
dp |
|
Vdp |
|
|
H |
|
|
dT |
H |
V dp . |
(88) |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
T p |
|
|
p |
|
|
T |
|
p |
p |
||||||||||||||||||||
|
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
T |
|
|||||||||||
Из этих уравнений находим dS: |
|
|
|
|
|
|
|
|
|||||||||||||||||||||
|
dS |
|
U |
|
|
dT |
|
1 |
|
|
|
U |
|
|
|
p |
|
dV , |
|
|
(89) |
||||||||
|
|
T v |
|
T |
|
|
T |
|
|
|
V |
T |
|
T |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
dS |
|
|
H |
|
|
|
dT |
|
|
1 |
|
|
H |
|
|
|
V |
dp . |
|
|
(90) |
||||||
|
|
|
|
|
T |
|
p |
|
T |
|
|
T |
|
|
p |
|
T |
|
T |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
Изменение энтропии реального газа в процессах может быть вычислено путем интегрирования, если известны величины:
U |
,… |
H |
. |
|
|
|
|||
T |
p |
|||
v |
T |
Для идеального газа задача значительно упрощается, так как
U |
|
dU |
Cv |
; |
H |
|
dH |
C p . |
|
|
|
|
|
|
|
||||
T |
v |
dT |
p |
p |
dT |
||||
|
|
|
|||||||
|
|
|
|
|
|
|
Поскольку в совершенном газе нет межмолекулярного взаимодействия, то:
U |
0 ; |
H |
0 . |
|
|
|
|||
V |
p |
|||
Т |
Р |
С учетом сказанного для 1 кг идеального газа уравнения (1) и (2) примут вид:
|
dS |
|
Cv |
|
|
dT |
|
|
|
pd |
|
|
|
|||||||||
|
|
|
|
T |
|
|
|
T |
|
|
||||||||||||
|
|
dS |
|
C p |
|
|
dT |
|
|
|
|
dp . |
(91) |
|||||||||
|
|
|
|
|
T |
|
|
|
|
T |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Из уравнения состояния |
p |
|
R |
|
|
|
|
или |
|
|
|
|
|
|
R |
|
||||||
T |
|
|
|
|
|
|
|
T |
p |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
dS |
Cv |
dT |
|
R |
d |
|
|
|
|||||||||||||
|
|
T |
|
dp . |
(92) |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
dS |
C p |
|
dT |
|
R |
|
|||||||||||||||
|
|
|
T |
|
|
p |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
Теплоемкости Ср и Сv |
есть постоянные, а поэтому (92) легко интегрируется: |
||||||||||||||||||||
S2 |
S1 |
Cv |
ln |
T2 |
|
R ln |
2 |
|
Cv ln |
T2 |
|
(C p |
Cv ) ln |
|
2 |
, |
(93) |
||||
T1 |
1 |
|
T1 |
|
1 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
S2 |
S1 |
C p |
ln |
T2 |
|
R ln |
|
p2 |
C p ln |
T2 |
(C p |
Cv ) ln |
p2 |
. |
(94) |
||||||
T1 |
|
|
p1 |
T1 |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
p1 |
|
|||||||
Уравнения (93) и (94) определяют изменение энтропии в основных процессах
идеального газа. |
|
|
|
|
|
|
Для политропного процесса T n 1 |
|
|
const . |
|||
S2 S1 Cv (n k) ln |
1 |
Cv (k n) ln |
|
2 |
, |
(95) |
|
|
|
||||
2 |
|
|
1 |
|
|
|
т.е.

40
|
|
|
|
|
|
n 1 |
|
|
|
|
|
|
|
|
|
n 1 |
|
|
|
S2 |
S1 Cv ln |
1 |
|
|
(C p |
Cv ) ln |
|
2 |
Cv ln |
1 |
|
|
(C p Cv ) ln |
1 |
|
||||
2 |
|
|
1 |
2 |
|
|
2 |
(96) |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
C |
(n 1) ln |
1 |
|
(C |
|
C |
) ln |
1 |
C |
(n 1 k 1) ln |
1 |
. |
|
|
|||||
|
p |
|
|
|
|
||||||||||||||
v |
|
|
|
|
|
v |
|
|
v |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
||
Используя зависимости между параметрами газа в политропном процессе, можно записать:
S2 |
S1 |
Cv |
n |
k |
ln |
P2 |
|
Cv |
k |
п |
ln |
P1 |
, |
|
|
(97) |
|||
n |
|
P1` |
|
n |
P2 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
S2 |
S1 |
Cv (k |
n) ln T1 |
|
n 1 |
|
Cv |
k |
n ln T1 . |
(98) |
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
n |
1 |
|
T |
|
||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
2 |
|
|
||||
Для адиабатного процесса n=k из уравнений (95) – (98) следует: |
|
||||||||||||||||||
S2 S1 |
0 ; |
S2 |
S1 ; |
|
S |
|
const. |
|
|
|
|
|
|
|
|
||||
Таким образом, обратимый процесс протекает без изменения энтропии, поэтому обратимый адиабатный процесс называется изоэнтропным.
3.2. Т – S диаграмма.
На T – S диаграмме каждая точка характеризует равновесное состояние тела, каждая кривая – термодинамический процесс.
Бесконечно малая площадь abcda равна TdS, но
TdS dq .
Интегрируя это соотношение по всему пути процесса от точки 1 до точки 2, получим:
|
2 |
|
q |
TdS F12341 . |
(99) |
|
1 |
|
Рис.11
Площадь F12341 равна количеству теплоты, подводимой (отводимой) в процес-
се. Поэтому ТS диаграмму называют тепловой диаграммой в отличие от рабочей диаграммы p .
Так как dq и dS имеют одинаковые знаки, то увеличение энтропии показывает, что в процессе теплота подводится к газу извне – процесс идет от т.1 к т. 2. Уменьшение энтропии характеризует процесс с отводом тепла от рабочего тела в окружающую среду – процесс идет от т. 2 к т. 1.
Проведем касательную к кривой процесса в точке а. Из треугольника Аdc
имеем: tg |
dT |
. Для политропного процесса (любого): |
|
dS |
|||
|
|

|
|
|
41 |
|
|
dq |
TdS |
и dq |
C dT |
|
|
|
откуда |
|
C |
TdS |
T . |
|
|
|
|
dT |
tg |
|
Рис.12. |
Рис 13. |
Из рисунка имеем C = cd |
- подкасательная кривой процесса в точке А. |
Положительному значению tg соответствует положительное значение теплоемкости; отрицательному – отрицательное.
соответствует положительное значение теплоемкости; отрицательному – отрицательное.
Цикл на TS диаграмме изображается замкнутой кривой. Если направление процессов в цикле по ходу движения часовой
стрелки, т.е. по пути abcda, то Fabcefa=q1
(теплота подведенная к газу), а
Fadcefa=q2 (отведенная теплота).
Теплота эквивалентна работе газа в цикле
Lц=q1-q2=Fabcefa – Fadcefa = Fabcda
Отсюда термический кпд
|
q1 q2 |
|
Fabcda |
. |
(100) |
t |
|
|
|||
q1 |
|
Fadcefa |
|
||
|
|
|
|||
3.3.Изображение на Ts диаграмме основных процессов
За начало принята т. 0 и через нее проведены кривые исследуемых процессов. Для ЖРД характерны политропные 







 процессы при показателе политропы
процессы при показателе политропы
1<n<k. В этих процессах работа газа положительна. Эти процессы идут выше адиабаты (PV-диаграмма). Из
Ts-диаграммы следует, что эти про-
цессы идут с увеличением энтропии.
Теплоемкость этих процессов отрицательна, tg <0.
<0.
Рис 14

42
Цикл Карно наТS-диаграмме
Цикл Карно имеет вид прямоугольника 12341 на Тsдиаграмме.
Рис. 15.
Рис.16. |
|
|
|
|
|
|
|
|
|||
|
q1 |
F12561 |
T1 (S2 |
S1 ) -подведенное тепло. |
|||||||
q2 |
|
F43564 T2 (S1 |
S2 ) - отведенное тепло. |
||||||||
lц |
q1 |
q2 |
(T1 |
T2 )(S2 |
S1 ) - работа цикла. |
||||||
|
|
(T1 |
T2 )(S2 |
S1 ) |
|
T1 |
T2 |
1 |
T2 |
- термический кпд. |
|
t |
|
|
|
|
|
|
|
|
|
||
|
|
|
T1 (S2 |
S1 ) |
|
|
T1 |
|
T1 |
||
Совершенство произвольного обратимого цикла определяется тем, насколько t этого цикла близок к t цикла Карно, осуществляемого между крайними температурами рассматриваемого цикла. Если сравнить произвольный цикл, вписанный в цикл Карно на TS-диаграмме, то площадь вписанного цикла меньше, чем площадь цикла Карно. Отношение этих площадей называют коэффициент заполнения. Чем больше коэффициент заполнения, тем ближе приближаются к
наиболее эффективному преобразованию теплоты в работу.
Этот процесс совершенствования циклов машин называют карнотизацией.
Повышение средней температуры подвода теплоты
И понижение средней температуры отвода теп-
T2ср  abc
abc
T2ср  cda
cda
Tds
s |
|
|
|
Tds |
лоты |
эквива- |
|
|
|||
s |
|||
|
|
лентно увеличению коэффициента заполнения цикла.
Цикл Карно имеет максимальный
в заданном интервале температур |
||
t k |
|
|
(T1 T2), но можно подобрать циклы, |
||
для которых |
tобр |
(обр - обрати- |
|
tk |
|
мый) Такие циклы называют
обобщенными циклами Карно.
Рис. 17.
Практически возможно отнимаемую от газа теплоту не отводить, а передавать газу – теплота циркулирует в газе. Это процесс регенерации теплоты. Цикл, в котором реализуется регенерация теплоты, называют регенеративным. Для регенеративных циклов необходим аккумулятор теплоты (воспринимает от охла-

43
жденного и отдает теплоту нагреваемому). Для цикла Карно требуется всего два источника теплоты (q1 и q2).
3.4. HS-диаграмма для газов и продуктов сгорания (ПС)
Применение TS-диаграммы для расчетов неудобно, так как количество теплоты по диаграмме определяется измерением площадей.
Для расчетов чаще применяется энтропийная диаграмма, в которой коорди-
ната Т заменена координатой энтальпии Н= СрТ |
|
|
||||
Так |
как |
теплоемкость |
газов |
зависит |
от |
температуры |
c c0 |
at bt 2 |
dt3 ..., то разбивка |
оси ординат неравномерная - расстояние |
|||
между изотермами при одном и том же повышении температуры делаются больше из-за увеличения теплоемкости с ростом температуры.
Адиабаты в этой диаграмме остаются вертикальными линиями. Изобары и изохоры идеального газа остаются эквидистантными кривыми, но несколько меняют свой вид из-за увеличения расстояния между изотермами. Они строятся по точкам, перенесенным из Тs-диаграммы.
Использование HS-диаграммы основано на следующем. Из уравнения dQ=dH-Vdp (1-ый закон) для адиабатного процесса (dq=0) dH=Vdp. После интегрирования в пределах от начального состояния газа 1 до конечного (после расширения) 2
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H 2 |
|
H1 |
Vdp . |
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
После замены знаков |
H1 |
|
H 2 |
Vdp . |
(102) |
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
Интеграл Vdp - техническая работа, полученная в машине(F12341). |
|
|||||||||||||||||||||||||||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
Рис. 18 |
|
|
|
|
|
Рис 19. |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|

44
Таким образом, H1-H2=Lтехн. Техническая работа при адиабатном расширении определяется изменением энтальпии газа в процессе расширения. H1 - начальная энтальпия на входе в машину (турбину). Н2- конечная энтальпия газа на выходе после адиабатного расширения. Н0=Н1-Н2 – располагаемый теплоперепад – убыль энтальпии, которая превращена в работу 1 моль газа.
Лютц и Вольф предложили универсальную НS диаграмму для воздуха и ПС различного состава. По предложенному ими способу строятся HS продуктов сгорания.
Для примера приведем общий вид HS диаграммы продуктов разложения водных растворов перекиси водорода (Н2О2) (Однокомпонентный газогенератор работает на продуктах разложения Н2О2)
Центральная часть диаграммы Нккал/моль и Sккал/моль град. представляет собой НS диаграмму продуктов разложения 100% Н2О2. На диаграмме нанесена сетка изобар, изохор и изотерм.
В правой части НS диаграммы приведена энтальпия для различной концен-
трации %(100…70) Н2О2
Для определения величины Н, соответствующей Р1,Т1 (Рк,Тк) – точке 1 на диаграмме, нужно спроектировать точку 1 на ординату Н и по наклонной линии (Н=const) дойти до вертикали, соответствующей заданной концентрации и затем на оси Н прочесть величину Н.
В левой части HS – диаграммы нанесены линии, определяющие форму линий S= const для продуктов разложения Н2О2 различной концентрации. Для получения этих линий, от левой ординаты для каждой Т отложена S продуктов разложения 100% Н2О2 и продуктов разложения Н2О2 концентрации .
Таким образом для продуктов разложения Н2О2 любой можно пользоваться изобарами, изотермами и изохорами основной диаграммы, но адиабаты проводить эквидистантно линиям а – а.
Применение НS – диаграмм удобно в таких случаях, когда одноэлементное рабочее тело, например, Н2, получает теплоту от внешнего источника в ЯРД (ядерных РД).
Преимущество НSдиаграмм – простота операций как при определении температуры в камере сгорания, так и расчете процесса расширения в сопле.
Но каждая диаграмма справедлива только для данного топлива с одним определенным коэффициентом избытка окислителя ок. переход к другому ок требует наличия большого числа диаграмм.
Диаграмма целесообразна, если длительное время ведут расчеты ЖРД не меняя компонентов топлива.
4.Течение газов
Предполагается отсутствие трения, т. е. процесс изменения состояния газа обратимый. Течение стационарное – оно описывается уравнением неразрывности, энергии (первого закона термодинамики) и состояния.

|
|
|
|
|
45 |
Течение теплоизолированное, а так как нет трения, то оно является изоэн- |
|||||
тропным, а состояние газа меняется по закону адиабаты. |
|||||
Располагаемая работа газа |
|
|
|||
dl0 |
dV 2 |
VdV |
dP . |
|
|
|
2 |
|
|
|
|
При адиабатном течении, без подвода тепла |
|||||
dl0 |
dV 2 |
2 |
dP |
dh . |
(103) |
|
|||||
|
|
|
|
|
|
Из уравнения (1) видно, что dV и dP имеют обратные знаки, т. е. при обрати- |
|||||
|
|
|
мом процессе увеличение скорости всегда связано |
||
|
|
|
с уменьшением давления. |
||
|
|
|
Если dP=0, то dl0=0 l0=0 и V1=V2, или l0=const |
||
|
|
|
|
P2 |
|
|
|
|
l0 |
|
dP - располагаемая работа в виде пло- |
|
|
|
|
P1 |
|
|
|
|
щади, ограниченной кривой процесса, линиями Р1, |
||
|
|
|
Р2 и осью ординат. |
||
Рис. 20 |
|
|
|
|
|
|
|
|
Работа расширения: |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l |
|
Pd |
- площадь под кривой процесса. |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Определим располагаемую работу для адиабатического процесса P K |
const . |
||||||||||||||||||||||||||||||||
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Так как |
|
P k |
|
, то |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
1 |
|
|
|
1k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
P1 |
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k 1 |
|
|
|
|
dP |
|
|
k |
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
P2 |
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|||||||||||||
l |
P k |
|
|
|
|
(P |
|
|
P |
) |
|
|
|
|
|
P |
|
1 |
|
(104) |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
0 |
1 |
1 |
|
|
|
|
|
|
|
|
1 |
1 |
2 |
2 |
|
|
|
|
|
|
|
1 |
1 |
|
|
|
|
|
|
|||
|
1 |
|
|
|
|
k |
|
1 |
|
|
k |
1 |
|
P1 |
|
|
|
|
|||||||||||||||
|
P2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
P k |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
Работа расширения для адиабатного процесса: |
|
|
|
|
|
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
P2 |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
(105) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l |
|
|
P |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
1 1 1 |
|
|
P |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
Сравнивая l и l0,получим |
l0 |
|
kl |
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
Из уравнения (103) видно, что располагаемая работа газа может быть определена и через энтальпию газа (для адиабатного процесса!)

|
|
|
|
|
46 |
|
|
|
h2 |
|
|
|
|
|
|
l0 |
dh |
h1 |
h2 |
h0 -располагаемый |
теплоперепад. |
Располагаемая |
работа |
|
h1 |
|
|
|
|
|
|
|
|
|
|
равна располагаемому теплоперепаду |
|
||
|
|
|
|
|
Как видно из вышесказанного, работа га- |
||
|
|
|
|
за в потоке является функцией процесса. |
|||
|
Рис.21 |
|
|
|
|
||
4.1.Скорость истечения и расход газа
Проинтегрируем (103) при условии,что параметры газа на входе равны p1, 1,T1, а на выходе p2, 2,T2.
|
|
2 |
1 |
|
|
|
l |
|
Vdv |
V 2 |
V 2 |
- располагаемая работа, |
|
0 |
|
|||||
|
|
2 |
2 |
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
где V1,V2 – скорость газа в начале и конце процесса.
Если V1<<V2 (что характерно для камер ЖРД), то скорость истечения V=V2 равна
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
1 |
|
|
|
|
|
|
|
k |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P2 |
|
|
|||
|
V |
2l0 |
2 |
|
|
|
|
P1 1 1 |
|
|
k |
(106) |
|||
|
|
k |
1 |
P |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
или |
V |
2 h1 |
h2 |
|
2h0 . |
|
|
|
(107) |
||||||
Скорость истечения определяется состоянием газа на входе в сопло и его конечным давлением на выходе (P2) или разностью энтальпий h0 на входе и выходе из сопла.
При истечении в вакуум (Р2=0) скорость истечения будет максимальной
V |
2 |
|
k |
|
P |
|
. |
(108) |
|
|
|
|
|||||
|
|
|
|
|||||
max |
|
k |
|
1 1 |
1 |
|
|
|
Массовый расход газа через сопло определим из уравнения неразрывности:
|
|
|
|
m |
F2V |
, |
(m= |
VF) |
(109) |
|
|
|
|
|
2 |
||||||
|
|
|
|
|
|
|
|
|
|
|
F2 – площадь выходного |
сечения |
сопла; 2 – удельный объем, равный: |
||||||||
|
|
1 |
|
|
|
|
|
|
|
|
|
P |
|
k |
. |
|
|
|
|
|
(110) |
|
1 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
2 1 P |
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
Из уравнения адиабаты: |
P |
k |
P |
k . |
||||||
|
|
|
|
|
|
|
1 |
1 |
2 |
2 |

47
После подстановки в m выражений для V и |
|
: |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
1 |
|
|
|
|
|
2 |
|
|
|
k 1 |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
1 P |
|
|
|
k |
|
|
|
k |
|
|
|
|
|
|
P |
|
k |
|
|
|
|
k P P k |
|
P |
|
k |
|||||||||||||||||||
m F |
|
|
|
|
|
2 |
2 |
|
|
|
|
|
|
|
P |
1 |
|
2 |
|
|
|
|
F |
2 |
|
|
1 |
2 |
|
|
2 |
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
2 |
|
1 |
|
|
P |
|
|
|
|
|
|
k 1 |
1 1 |
|
|
|
P |
|
|
2 |
|
k 1 |
1 |
|
P |
|
P |
|
|
|
|
||||||||||||||||
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
1 |
|
|
1 |
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
k |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
F2 |
|
|
|
|
|
P |
2 |
|
k |
|
P |
k |
P |
|
k |
. |
|
|
|
|
|
|
|
|
|
|
(111) |
||||||||||||||||||||
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
k |
1 |
|
|
|
|
P |
|
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Т.о. расход газа зависит от площади выход- |
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ного сечения сопла, параметров газа на входе |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T1,R1 |
и давления в выходном сечение со- |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
пла (Р2). |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4.2 Истечение из суживающихся сопел |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
Рис. 22 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Пусть в баллоне, размеры которого достаточно |
|||||||||||||||||||||||||||
большие, находится газ, вытекающий через суживающееся сопло. Параметры газа из-за размеров баллона не меняются во времени. При этом V1=0.
На срезе сопла имеем P2, 2,T2,V2.
Давление внешней среды, куда происходит истечение, равно Ра. Рассмотрим расчетный режим истечения, при котором Р2=Ра. Если истече-
ние газа является обратимым и адиабатным, то скорость V и расход m можно определить по формулам (106) и (111).
Значение максимального расхода m определяется давлением Р2. Для определения максимального расхода возьмем первую производную
|
|
|
2 |
|
|
|
k 1 |
|
||
|
|
P2 |
|
|
P2 |
|
|
|
|
|
по Р2 |
от |
|
|
k |
|
|
|
k |
и приравняем нулю. |
|
P1 |
|
P1 |
|
|
|
|||||
|
|
|
|
|
|
|
||||
|
|
2 |
1 |
|
|
|
|
k 1 |
1 |
|
|
|
|
1 |
|
2 k |
|||
2 |
|
P2 |
k 1 |
P2 |
|
k |
|
2 |
|
P2 |
|
k |
|||||||
|
|
|
|
k |
|
|
|
|
; |
|
|
|
|
k |
|
||||
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|||
k |
|
P |
k |
P |
k 1 |
P |
|
|
|||||||||||
|
|
|
|
|
|
|
|||||||||||||
|
1 |
|
|
|
|
|
1 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
||||
|
|
|
|
|
|
P2 |
|
|
||||
|
|
|
|
|
|
|
|
|
k |
|
|
|
2 |
|
k |
|
|
|
P |
; |
|||||
|
|
|
|
1 |
|
2 k |
||||||
|
|
|
|
|
|
|
|
|
|
|||
k |
|
k |
1 |
|
|
|
|
|
|
|
|
|
|
|
P2 |
|
|
||||||||
|
|
|
|
|
|
|
|
|
k |
|
|
|
P
1
k 1 |
k |
|
2 |
|
|
P2 |
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
k |
. Отсюда |
|
|
|
|
k 1 |
. |
||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
k 1 |
|
P |
|
|
P |
|
k 1 |
|
|
||||||
|
|
|
1 |
|
|
1 |
|
|
|
|
|
|
||||
Отношение |
P2 |
|
-называется критическим (соответствующее m мах) |
|||||||||||||
P1 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
