
Учебное пособие 800463
.pdf
18
Давление, соответствующее нормальному атмосферному на уровне моря,
называют физической (нормальной) атмосферой равной 1,0332 |
кг |
2 . |
|
см |
|
1ат=105 Па =100 кПа=0,1 МПа, где кПа=103 Па ; МПа=106 Па |
|
|
Для измерения давления применяют пьезометры; манометры для измерения избыточного давления; барометры для измерения атмосферного давления; вакуумметры – для измерения вакуума.
Удельный объем – это объем, занимаемый единичной массой вещества
|
V |
, |
|
м3 |
, |
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
m |
|
кг |
|
|
|
|
|
|
|
|
|
|
|||
где V – объем, м3 ; m – масса вещества, кг. |
|
|
|
|||||||||||||
Обратная величина удельного объема называется массовой плотностью. |
||||||||||||||||
|
|
|
m |
|
|
1 |
, кг |
|
3 . |
|
|
|
|
|
||
|
|
|
V |
|
м |
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
В технической системе единиц МКГСС |
кГ |
с2 |
. |
|||||||||||||
м4 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Для воздуха |
1,25 |
кг |
0,125 |
кГс2 |
. |
|
|
|
||||||||
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
м3 |
|
|
м4 |
|
|
|
||
В практических приложениях о массе вещества m судят по его весу. Вес единицы объема вещества называют удельным весом.
|
G |
, где G – вес вещества (кг). |
|
|
|
|
||||
|
V |
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
Размерность удельного веса в системе СИ - |
н |
3 , В МКГСС - кГ |
м |
3 . |
||||||
|
|
|
|
|
|
|
м |
|
|
|
Плотность и удельный вес связаны между собой отношением |
|
|
||||||||
|
|
|
G |
|
mg |
g , |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
V |
|
V |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где g – ускорение свободного падения, равное 9,78 9,83 м с 2 .
В отличии от плотности 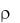 удельный вес
удельный вес  не является только физикохимической характеристикой вещества, так как зависит от значения g в месте измерения.
не является только физикохимической характеристикой вещества, так как зависит от значения g в месте измерения.
1.3.Уравнение состояния газа
Термодинамическое состояние тела однозначно определяется тремя независимыми параметрами: Р, Т, . Это означает, что для каждого вещества сущест-
вует определенная функция |
|
F(Р, Т, ) = 0, |
(1) |
которая характеризует состояние тела и называется уравнением состояния. Графическое изображение уравнения (1) в координатах р - ; р - Т; - Т называют диаграммами состояния. Для каждого тела диаграмма состояния имеет свой определенный вид.
В термогазодинамике различные термодинамические состояния реальных газов представляют физической моделью – идеальный газ.

19
Модель реальной системы отражает наиболее существенные, характерные свойства реальной системы.
Идеальный газ – газ, в котором отсутствуют межмолекулярные силы и объ-
ем молекул значительно меньше объема газа Vмолекул<<Vгаза.
Все реальные газы при высоких Т (Т>>Ткип) и малых Р полностью подходят под модель идеального газа.
Уравнение равновесного состояния для 1 кг идеального газа, полученное Клапейроном путем объединения уравнений Бойля-Мариотта и Гей-Люссака, имеет вид
|
|
|
|
|
|
Р |
= RT, |
(2) |
||||||
где R – удельная газовая постоянная (отнесенная к 1 кг массы газа). В СИ |
||||||||||||||
|
|
|
|
|
|
|
|
|
н |
|
м3 |
|
|
|
|
|
|
|
|
|
P |
|
|
м2 кг |
Дж |
||||
|
|
|
R |
|
|
|
|
|
|
|
|
|
К |
кг К |
|
|
|
T |
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||
Для массы m кг уравнение состояния имеет вид |
|
|||||||||||||
|
|
PV = mRT, |
|
|
|
|
|
(3) |
||||||
где V – объем газа, м3 . |
|
|
|
|
|
|
|
|
|
|
|
|||
Для М кмоль газа (1кмоль = |
кг вещества, где |
- молекулярная масса) |
||||||||||||
|
|
PV = М RT, |
|
|
|
(4) |
||||||||
где R – универсальная газовая постоянная, одинаковая для всех газов и рав- |
||||||||||||||
на в СИ 8314,3 |
|
Дж |
|
. |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|||||
кмоль К |
|
|
|
|
|
|
||||||||
Газовая постоянная |
1 кг любого газа при известной молекулярной массе |
|||||||||||||
определяется |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
R |
|
8314,3 |
, |
Дж |
|
, |
|
|
(5) |
|||
|
|
|
|
кг к |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где - молекулярная масса.
Пример: определить значение газовой постоянной в СИ для окиси углерода СО и СО2
|
|
|
|
|
|
|
8314,3 |
|
|
|
|
|
|
|
Дж |
|
|
||||||
СО = 12+16=28, |
|
|
R |
|
|
|
|
|
|
|
296,9 |
|
|
|
; |
|
|
||||||
|
|
28 |
|
|
|
|
кг град |
|
|
||||||||||||||
СО2 =12+32=44, |
|
|
R |
|
|
8314,3 |
188,96 |
|
Дж |
. |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
44 |
|
|
|
|
кг град |
|
|||||||||||||||
На практике используют уравнение для определения |
и |
||||||||||||||||||||||
|
РТ0 |
; |
|
|
|
|
|
Р0Т |
, |
|
|
|
|
|
|
|
(6) |
||||||
0 |
Р |
0 |
Т |
|
|
|
|
0 |
Р Т 0 |
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
где “0” – параметры |
газа |
при |
|
нормальном |
физическом состоянии |
||||||||||||||||||
(Р0=760мм.рт.ст.=1физ.атм.=101325 |
Н |
м |
2 |
; Т0=0 С=273 К). При этих условиях: |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
, кг |
|
|
; |
|
|
|
|
|
|
|
22,4 |
, м3 |
. |
|
|||
|
|
|
0 |
22,4 |
|
м3 |
|
|
|
|
|
0 |
|
|
|
|
|
кг |
|
|
|||
Для реальных газов (при больших плотностях) могут быть использованы уравнения Ван-дер-Ваальса:

20
а
Р 2 ( b) RT
или уравнения состояния газа в виде: p zRT ,
zRT ,
где константы а и b определяются по критическим параметрам:
а 27b2 P ; b |
1 |
|
RTkp |
, |
|
|
|
||
kp |
8 |
|
Pkp |
|
|
|
|
(7)
(8)
водород: |
Тк=33 К, |
Рк=12,8 атм; |
кислород: |
Тк=154,8 К, |
Рк=50,1 атм; |
z-координата сжимаемости (для идеального газа z=1) определяется по графи-
кам z= f ( , ) , здесь |
P |
; |
|
T |
-приведенные параметры. |
||||||||
|
|
|
|||||||||||
|
|
|
Pkp |
Tkp |
|
|
|
|
|
|
|
||
Для Т=273К: |
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 3 Зависимость координаты сжимаемости z от давления Р для кислорода и водорода
1.4.Газовые смеси
Продукты сгорания (ПС) представляют собой газовые смеси.
Газовая смесьэто смесь отдельных газов, не вступающих между собой ни в какие химические реакции.
Каждый отдельный газ, входящий в смесь, подчиняется уравнению состояния идеального газа.
Давление, которое имел бы каждый газ, при условии, что он один и в том же количестве, том же объеме и той же температуре что и в смеси, называют парциальным (частичным).
Сумма парциальных давлений отдельных газов, входящих в смесь, равна общему давлению смеси (закон Дальтона):
|
n |
|
Р |
Рi . |
(9) |
1

21
Для продуктов сгорания топлива Ож+Нж имеем смесь О, Н, Н2О, Н2, О2, ОН;
Р=Р0+РН+РОН+ РН |
О РН |
2 |
РО (n=6); в камере сгорания Р=РК. |
2 |
|
2 |
Газовая смесь может быть задана массовыми g i и объемными долями ri . Массовой долей называется отношение массы каждого газа к общей массе:
|
gi |
mi |
|
, |
(10) |
|
m |
|
|||
|
|
|
|
|
|
где mi - масса i-го газа; |
|
|
|
|
|
|
n |
|
|
|
|
m |
mi - общая масса смеси. |
|
|||
|
1 |
|
|
|
|
Всегда |
gi |
|
1 |
(11) |
|
Если газы в смеси приведены к давлению в смеси (каждый газ как бы сжат до давления смеси при Т=const), то новый объем i-го компонента будет определяться по формуле:
Vi |
V |
Pi |
|
|
|
|
P |
; |
(12) |
||||
|
|
|||||
V |
|
Vi , |
|
|
||
где Vi –парциальный приведенный объем i-го газа.
Объемная доля-это отношение парциального объема каждого газа к общему объему смеси:
ri |
Vi |
|
Рi |
(13) |
V |
|
Р |
||
|
|
|
|
n |
Всегда |
ri 1 |
|
1 |
Поскольку для одинаковых Р и Т объемные моли любых газов одинаковы, то мольный состав одинаков с объемным:
Vi
ni |
M i |
|
|
|
|
i |
|
Vi |
ri , |
(14) |
|||
M |
|
|
|
V |
|
|
V |
|
|||||
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
n |
|
где Мi-число молей i-го газа, М |
М i |
-число молей всей смеси. |
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
V |
м3 |
|
|
|
|
|
||||
|
|
|
M |
кмоль |
|
|
|||||||
|
|
|
|
|
|
|
|
||||||
(V-объем, М-число молей вещества).
а) Если задан объемный или мольный состав смеси, то кажущуюся еѐ молекулярную массу определяют по формуле:
n |
n |
ri i |
ni i . |
1 |
1 |
(15)
Так же определяется и плотность смеси:

|
22 |
n |
n |
ri i |
ni i . |
1 |
1 |
(16)
После этого определяется газовая постоянная смеси:
R 8314,3 .
(17)
Парциальные давления определяются по формуле:
Pi ri P ni P |
(18) |
б) Если задан массовый состав смеси, то определяется газовая постоянная:
|
n |
R |
gi R i , |
|
1 |
(19)
а после этого находят молекулярную массу:
8314,3 .
R
(20)
Парциальные давления газов определяются по формуле:
P |
g |
|
R i |
P . |
(21) |
|
|
||||
i |
|
i |
R |
|
|
Перерасчет газовой смеси из объѐмного состава в массовый и обратно ведется по формулам:
ri |
|
|
gi |
i |
||||
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
gi |
|
i |
|||
|
|
1 |
|
|
|
|
|
|
g |
i |
|
ri i |
|
|
|
ri i |
. |
|
n |
|
|
|
||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
ri |
i |
||||
|
|
1 |
|
|
|
|
|
|
1.5.Теплоемкость – калорический параметр
Теплоемкость-количество теплоты, необходимое для нагрева тела на 1 градус.
Если теплоемкость отнесена к единице массы, то она называется массовой или просто теплоемкостью-с (массовая удельная теплоемкость).
Если теплоемкость отнесена к единице объема, то она называется объемной теплоемкостью С (объемная удельная теплоемкость).
Очевидно, что С=с .
Теплоемкость газовой смеси определяется по формуле:

23
|
n |
Ссм |
Сi gi . |
|
1 |
В зависимости от характера процесса подвода тепла, различают изобарную теплоемкость Сp и изохорную Сv . Для идеального газа эти теплоемкости связаны уравнением Майера:
Сp-Сv=R.
Отношение удельных теплоемкостей к=Сp/Сv называют показателем адиабаты.
Массовые с и объемные С удельные теплоемкости связаны с мольной теплоемкостью С (отнесенная к 1 кмолю газа) следующими соотношениями:
с |
|
с |
v |
, |
|
кДж |
; |
|
с р |
|
|
с р |
, |
кДж |
; |
|
|||||
|
|
|
|
кг |
К |
|
|
|
|
кг К |
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Сv |
|
с |
v |
, |
кДж |
; |
С |
|
|
с р |
|
, |
кДж |
. |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
22,4 |
м3 |
К |
р |
|
|
|
|
|
К |
||||||||||||
|
|
|
|
|
|
|
22,4 м3 |
|
|||||||||||||
Так как теплоемкости газа являются функциями температуры, то истинные
их значения определяются по формуле: |
|
|
|
|
|
|
|
|
|
с=с0+аt+bt 2 +… |
|
|
|
|
|
|
|
|
|
Например, истинные мольные теплоемкости |
С р для водорода: |
|
|||||||
С р =29,1-0,000209t+2,324 10 |
6 t |
2 , |
|
|
кДж |
(24) |
|||
|
|
|
|
|
|||||
кг град |
|||||||||
|
|
|
|
|
|||||
для кислорода: |
|
|
|
|
|
|
|
|
|
С р =28,97+0,0106t-3,55 10 6 t |
2 , |
|
кДж |
(25) |
|||||
|
|
|
|
|
|
||||
|
кг |
град |
|||||||
|
|
|
|
||||||
Для средней теплоемкости в пределах температур t1и t2:
Сtt2 |
C0t2 t2 |
C0t1 t1 |
(26) |
|
|
t1 |
|||
1 |
t |
2 |
|
|
где C0t1 иC0t2 -берут из справочников.
1.5.1.Зависимость теплоемкости от температуры.
Средняя теплоемкость.
В общем случае теплоемкость для температуры t :
с с0 аt вt 2 dt3 ...
с0 – теплоемкость при t=0 0 C; а,в,d – постоянные коэффициенты, в, d~0, а поэтому с=с0+аt.
Расход теплоты для одинакового повышения температуры неодинаков – с ростом t надо израсходовать большее количество теплоты для одинакового t .
Найдем расход теплоты для нагрева газа от t1 до
t2.
При нагреве от 0 до t2 |
q |
2 |
F |
|
ct2 t |
2 |
. |
|||||
|
|
|
|
|
|
01340 |
0 |
|
|
|||
При нагреве от 0 до t1 |
q |
|
F |
|
ct1 t . |
|
||||||
|
|
|
|
|
1 |
01250 |
0 |
1 |
|
|||
q |
2 |
q |
F |
F |
|
ct2 t |
2 |
ct1 t . |
|
|||
|
1 |
01340 |
|
01250 |
0 |
0 |
1 |
|
||||

24
t1, t2 – заданы, а с0t2 , c0t1 - находят по таблицам. Средняя теплоемкость в пределах t1 t2 :
ctt2 |
c0t2 t2 |
c0t1 t1 |
, |
|
|
|
|||
1 |
t |
2 |
t1 |
|
|
|
|
|
|
где c0t2 , c0t1 - средние теплоемкости от 0 до t2 и от 0 до t1.
1.6.Модели рабочего тела.
При высоких температурах рабочее тело представляет собой многокомпонентную смесь индивидуальных веществ ПС в газообразном и конденсированном (жидком или твердом) состояниях. Смесь, состоящая только из газов – гомогенная; Смесь из газов и веществ в конденсированном состоянии – гетерогенная.
При высоких температурах возникает термическая диссоциация и ионизация компонентов ПС. При диссоциации за счет увеличения внутренней энергии молекул (вращательной и колебательной) и возбуждения электронов вследствие повышения температуры – происходит преодоление сил притяжения между атомами. Двухатомная молекула распадается на атомы. Трех или многоатомная молекула – на более простые молекулы и атомы. Всѐ это требует затраты части энергии, выделяющейся при химических реакциях и уменьшает температуру рабочего тела.
Процессу разрушения молекул соответствует обратный процесс рекомбинации (восстановления) атомов и осколков молекул. Воссоединение молекул возможно только для осколков с достаточной энергией (эффективные столкновения). Процесс рекомбинации идет с выделением теплоты, равной по количеству поглощенной при диссоциации.
Реакции диссоциации и рекомбинации являются реакциями обратимыми, т.е. идут одновременно в двух направлениях. Если их скорости одинаковы Wпр Wобр , то на-
ступит динамическое равновесие. Химический состав ПС, соответствующий этому состоянию, называют химически равновесным. Состав и свойства ПС в состоянии химического равновесия определяют Т и Р.
С ростом Т увеличивается интенсивность диссоциации. При этом устойчивость различных молекул против диссоциации различна (см. рис.).
nд= число молей, подвергшихся диссоциации - степень исходное число молей
диссоциации.
Моль – (грамм – молекула) – количество однородного вещества, масса которого выражается в граммах, равна его молекулярной массе.

25
При увеличении давления, согласно принципу смещения равновесия, происходит снижение числа молекул в смеси – рекомбинация. Рост давления уменьшает диссоциацию ПС.
Если обратимые реакции протекают без изменения числа молекул, в них участвующих, то равновесие таких реакций не зависит от Р.
Модель рабочего тела в которой сохраняется химическое равновесие наиболее широко используется при упрощающих допущениях :
1)Для гомогенной и гетерогенной смеси принимают, что они состоят из индивидуальных веществ в идеальном состоянии. К отдельным газам, в том числе и ионам, а также к смеси в целом применимо уравнение состояния идеального
газа.
Уравнение состояния идеального газа впервые полученное Клапейроном путем объединения уравнений, характеризующих газовые законы Бойля – Мариотта и ГейЛюссака:
p |
RT |
(1). |
Уравнение (1) записано для газа 1кг и содержит удельную газовую постоянную R, отнесенную к массе 1кг. В системе СИ:
|
p |
|
Н |
|
м3 |
|
|
R |
|
|
|
|
|
К Дж кг К |
|
|
|
м2 |
|
|
|||
|
T |
|
|
кг |
|
||
Идеальный газ есть предельный случай реального газа при |
, р 0 . |
||||||
При р 0 межмолекулярные взаимодействия перестают играть роль и свойства
газа определяются только числом молекул в едином объеме. Уравнение (1) представляют в следующих модификациях: Для 1кг газа: p RT
RT
Для 1кмоль газа: pV  RT - уравнение Клапейрона-Менделеева.
RT - уравнение Клапейрона-Менделеева.
Для m кг газа: |
pV mRT . |
Здесь V - молярный объем газа; V
- молярный объем газа; V  - объем газа массой m кг.
- объем газа массой m кг.
Удельная газовая постоянная: R  R
R
`- молярная масса.
8314 Дж .
кг К
Универсальная газовая постоянная вычисляется при нормальных физических ус-
м3
ловиях: Р=101325 Па; Т=273,15 К; V =22,4 кмоль - для любого газа.
=22,4 кмоль - для любого газа.
R  pV
pV T 101325
T 101325 22,4
22,4 273,15 8313 Дж
273,15 8313 Дж кг
кг  К .
К .
2) Конденсированные вещества не образуют между собой и с газовой фазой растворов, т.е. рассматривают различные составляющие среды, каждая со своими значениями параметров. В ряде случаев полагают, что конденсированные вещества образуют идеальный раствор (изменение энтальпии при смешении равно нулю).
При известном массовом содержании различных конденсированных веществ в смеси miф , объем занимаемый фазой при отсутствии растворимости конденсата, со-
ставляет Vф |
|
miф |
ki , где ki - |
плотность вещества конденсированной фазы. Ис- |
|||
пользуя понятие массовых долей: |
zi miф m , находим отношение объема конденси- |
||||||
рованной фазы к общему объему смеси: |
|||||||
V |
|
V |
|
zi |
, здесь |
- плотность смеси. В большинстве случаев (z=0,2-0,3) |
|
p |
|
|
|||||
|
|
|
|
|
|
|
|
ki

26
Vp  V ~ 10 3 , поэтому объемом конденсированных веществ в смеси можно пренеб-
V ~ 10 3 , поэтому объемом конденсированных веществ в смеси можно пренеб-
речь. Уравнение состояния газа гетерогенной смеси записывают в том же виде, что и для гомогенной:
p RT
RT .
.
- молекулярная масса смеси, равная |
г (1 z) . |
Если топливо состоит из m химических элементов, то в ПС входит m атомарных и l индивидуальных молекулярных веществ, т.е. всего (m+ l ) веществ. В число l следует включать все вещества, состоящие из m химических элементов, для которых имеется необходимая информация о термодинамических функциях в рассматриваемом диапазоне температур и которые в заметном количестве присутствуют в ПС.
Например, для топлива, содержащего 2 химэлемента От и Нт (m=2) ПС будут содержать 2 атомарных газа О и Н и 4 молекулярных газа Н2, О2, Н2О, ОН ( l =4). Таким образом, ПС содержит 6 компонент (m+ l =2+4=6).
2. Основные законы термодинамики, используемые при изучении внутрикамерных процессов
2.1.Первый закон термодинамики
Первый закон термодинамики (первое начало термодинамики)-выражение закона сохранения и превращения энергии. Количество энергии неизменно, энергия переходит из одной формы в другую (ХЭ→ТЭ→КЭ).
Уравнение первого закона термодинамики выражает количество те изменения, которые вызываются в рабочем теле при подводе к нему некоторого количества энергии.
Энергия –это скалярная величина, являющаяся единой мерой различных форм движения. Виды энергии: механическая, внутренняя, химическая, электромагнитная и т.п.
Работа-это разность энергии в двух состояниях: L=E1-E2. Энергия в состоянии перехода называется теплотой: Q= E
Рассмотрим первый закон термодинамики для частного случая, когда преобразование энергии происходит только в форме теплоты и механической работы. Рабочее тело неподвижное.
Пусть телу массой m подводится количество теплоты dQ. Эта теплота меняет состояние тела (изменяется V иT). При этом изменится внутренняя энергия тела dU (кинетическая энергия молекул и силы взаимодействия между молекулами)
и совершится работа против внешних сил dL, т.е. |
|
||||||
dQ=dU+dL=dU+pdV |
|
(27) |
|||||
Деформационная работа газа равна dL=pdV |
|
||||||
Для 1 кг рабочего тела уравнение примет вид: |
|
||||||
|
dq=du+pd |
, |
|
|
(28) |
||
так как Q=mq; U=mu; V=m . |
|
|
|
|
|
||
Полный дифференциал внутренней энергии: |
|
||||||
du |
u |
dT |
u |
d . |
(29) |
||
|
|
|
|
||||
T |
|
T |
|||||
|
|
|
|
|
|||
|
|
|
|
|
|
|
|

27
Подставим (29) в (28):
|
|
|
|
Сx dT |
|
u |
dT |
u |
|
P d |
|||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
T |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
откуда: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C x = |
|
u |
|
u |
|
P |
d |
|
||
|
|
|
|
|
|
T |
|
|
dT |
||||||
|
|
|
|
|
|
|
|
|
|
|
T |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Здесь |
|
u |
, |
u |
, Р |
- определяют состояние тела; |
|||||||||
|
|
|
|||||||||||||
|
T |
|
|||||||||||||
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ddT -процесс изменения состояния.
В процессе =const d =0, удельная теплоемкость:
u Cx Cv T
(30)
(31)
(32)
Для идеального газа, у которого внутренняя энергия зависит только от Т ча-
стная производная совпадает с полной производной |
u |
|
du |
и |
||||
T |
|
dT |
||||||
|
|
|
|
|
|
|
||
C |
|
|
du |
, |
|
|
|
(33) |
v |
|
|
|
|
|
|||
|
|
dT |
|
|
|
|
||
|
|
|
|
|
|
|
||
В этом случае первый закон термодинамики имеет вид: |
|
|||||||
dq=CvdT+Pd |
|
|
|
(34) |
||||
или в интегральной форме (пологая Сv=const): |
|
|
|
|
||||
|
|
2 |
|
|
|
|
||
q Cv (T2 |
T1 ) Pd . |
|
|
|
(35) |
|||
|
|
1 |
|
|
|
|
||
Уравнение первого закона термодинамики модно представить в другом виде.
Добавим и отнимем к (27) |
VdP |
тогда: |
|
dQ dU PdV VdP VdP |
d(U |
PV ) VdP |
(36) |
т.к. U PV
Н=Н (р, Т).
Энтальпией удобно пользоваться в тех случаях, когда в качестве независимых переменных, определяющих состояние системы, выбирают Р и Т.
Энтальпия в данном состоянии есть сумма внутренней энергии и работы, которую необходимо затратить, чтобы тело объемом V ввести в окружающую среду, имеющую давление Р и находящуюся с телом в равновесном состоянии.
Энтальпия - функция состояния, т.е. |
Н |
Н 2 |
Н1 . |
||||||||
Для 1 кг рабочего тела |
|
dq |
|
dh |
dP. |
|
(37) |
||||
Полный дифференциал dh: |
|
|
|
|
|
|
|
||||
|
dh |
|
h |
dT |
h |
dP . |
(38) |
||||
|
|
|
|
|
|
||||||
|
|
T p |
P |
||||||||
|
|
|
|
|
|
T |
|
||||
Подставим dh в (37): |
|
|
|
|
|
|
|
|
|
|
|
Сx dT |
h |
dT |
|
h |
|
|
dp |
(39) |
|||
|
|
|
|
|
|
||||||
T |
|
p T |
|
|
|||||||
|
|
|
|
|
|
|
|
|
|||
