- •Лекция №38
- •1,3 Дикетоны. , - Непредельные альдегиды и кетоны. Ароматические альдегиды и кетоны
- •Кислотность и енолизация
- •Образование солей
- •Взаимодествие с электрофильными реагентами.
- •Взаимодействие с нуклеофильными реагентами.
- •Соединения этого ряда могут быть представлены структурой
- •Методы получения
- •Структурные особенности , - ненасыщенных карбонильных соединений
- •Химические свойства
- •Ароматические альдегиды и кетоны
- •Классификация и номенклатура
Лекция №38
1,3 Дикетоны. , - Непредельные альдегиды и кетоны. Ароматические альдегиды и кетоны
План.
Химические свойства 1,3 дикетонов.
, - Непредельные альдегиды и кетоны.
Ароматические альдегиды и кетоны.
Хиноны
1,3-Дикетоны
1,3–дикарбонильные соединения обладают высокоподвижным атомом водорода при центральном углероде. Как следствие, эти соединения легко подвергаются енолизации.
Енольная и кето-формы, а также енолят-анион являются ключевыми частицами, ответственными за реакции этих соединений.
К наиболее важным химическим свойствам 1,3-дикарбонильных соединений относятся:
Кислотность и енолизация
1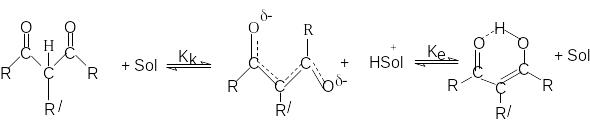 ,3
– дикетоны проявляют кислотные свойства,
причем за кислотность отвечают две
формы – кето– и енольная. Равновесие
между этими таутомерными формами
устанавливается через промежуточное
образование енолят – аниона.
,3
– дикетоны проявляют кислотные свойства,
причем за кислотность отвечают две
формы – кето– и енольная. Равновесие
между этими таутомерными формами
устанавливается через промежуточное
образование енолят – аниона.
Дикарбонильняя форма является С-Н-кислотой, а енольная – ОН–кислотой. Каждая из форм имеет свою константу кислотности: Кк и Ке. Чтобы оценить Кк и Ке, необходимо знать соотношения таутомерных форм, т.е константу таутомерного равновесия, Кт.
Кт = [E]/[K] , где [E] и [K] – концентрации таутомерных форм.
Можно показать, что Кт = Кк / Ке (1)
Из соотношения (1) видно, что доминирующей таутомерной формой является та, которая имеет меньшую кислотность. Так, для ацетилацетона рКк = 8,9, а рКе = 8,2 , откуда следует, что Кт = 0,2, что соответствует содержанию енола 16,5%. На соотношение констант кислотности таутомеров влияют растворитель и структура соединения.
Влияние растворителя
В общем случае растворитель по-разному влияет на кислотность таутмерных форм, поэтому при переходе от одного растворителя к другому меняется соотношение таутомерных форм. Например, в водном растворе для ацетилацетона Кт = 0,2, а в растворе метанола Кт = 2,6 (72% енола). Такой результат можно обосновать с точки зрения различия в кислотностях воды и метанола. Так, вода, обладающая более высокой кислотностью, чем метанол, образует более прочные водородные связи с кето–формой ацетилацетона. В то же время кислотность растворителя не играет такой существенной роли в сольватации циклической енольной формы, так как в последней потенциал карбонильного атома кислорода использован для образования внутримолекулярной водородной связи. Как следствие, в воде более выгодной становится существенно сольватированная кето–форма.
2. Влияние структуры дикетона
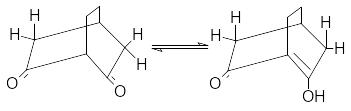
Структура дикетонов в общем случае по–разному влияет на относительную устойчивость кето- и енольной форм. Так, шестичленные циклические транс– фиксированные -дикетоны сильно енолизированы, так как у енольной формы идеально соблюдается условие компланарности для сопряжения, а, следовательно, стабилизации.
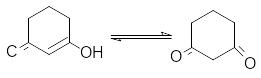
100% енола
В то же время такие условия отсутствуют у бициклических 1,3–дикетонов с центральным атомом углерода в голове моста.