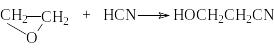- •Простые эфиры
- •Диалкиловые эфиры
- •Изомерия и номенклатура
- •Способы получения диалкиловых эфиров
- •Физические свойства и строение
- •Химические свойства
- •Алкилвиниловые эфиры. Методы получения
- •Химические свойства алкилвиниловых эфиров
- •Циклические эфиры
- •Эпоксиды (оксираны)
- •Химические свойства
- •Краун – эфиры
Циклические эфиры
Циклические эфиры – производные алкандиолов, в которых эфирная связь образована внутримолекулярно.
Циклические эфиры подразделяются на несколько групп в зависимости от величины цикла и числа кислородных атомов в цикле. Их часто называют оксидами.
В этом плане различают:
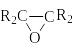
Эпоксиды (этиленоксиды, оксираны)
Триметиленоксиды (оксетаны)
Тетраметиленоксиды (тетрагидрофураны, оксоланы)
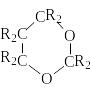
Диоксаны
1,3 - диоксан
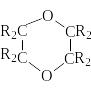
1,4 - диоксан
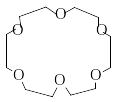
Макроциклические эфиры (краун – эфиры)
Эпоксиды (оксираны)
Основу названия этих соединений составляет наименование углеводорода, а на присутствие кислородного мостика указывает приставка "эпокси". Для простейших соединений сохраняется название этиленоксид и пропиленоксид. Используется также номенклатура гетероциклических соединений "оксираны". Например,
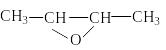
2,3 – эпоксибутан
2,3 – диметилоксиран
Методы получения.
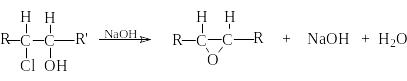
дегидрогалогенирование галогеналканолов (галогенгидринов)
О
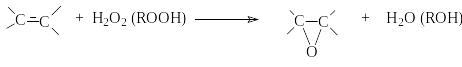 кисление
(эпоксидирование) алкенов (реакция
Прилежаева)
кисление
(эпоксидирование) алкенов (реакция
Прилежаева)
cat
В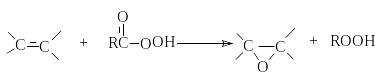 качестве катализаторов используют
кислые соли вольфрамовой кислоты (Н2О2)
и соединений молибдена (ROOH).
Реакцию можно осуществлять некаталитически,
если в качестве эпоксидирующего агента
использовать органические надкислоты.
качестве катализаторов используют
кислые соли вольфрамовой кислоты (Н2О2)
и соединений молибдена (ROOH).
Реакцию можно осуществлять некаталитически,
если в качестве эпоксидирующего агента
использовать органические надкислоты.
Первый член гомологического ряда этиленоксид, в промышленности получают парофазным окислением кислородом или воздухом.

200 – 3000С
Химические свойства
Химическое поведение оксиранов определяется тремя факторами: поляризацией связей С О с образованием частичного положительного заряда на углероде оксидного цикла, электронодонорными свойствами атома кислорода и напряженностью оксидного цикла. Поэтому наиболее характерными реакциями оксиранов являются реакции нуклеофильного присоединения по положительно заряженному углероду цикла, сопровождающиеся разрывом связи СО цикла, облегчаемым протонированием кислородного атома под действием протонодонорного агента.
Совместное действие этих факторов отчетливо проявляется в некаталитической реакции этиленоксида с водой
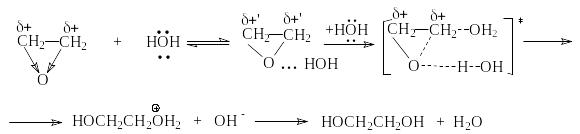
и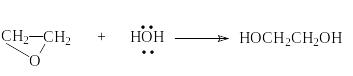 ли
суммарно:
ли
суммарно:
Эта реакция протекает медленно, поскольку вода является слабым протонодонорным агентом. Для ускорения этой реакции необходимо использовать высокую температуру и давление.
Другие более сильные нуклеофилы (NH3, RNH2, RMgX) реагируют более легко.
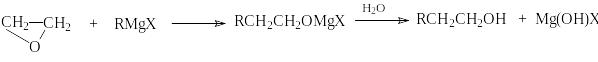
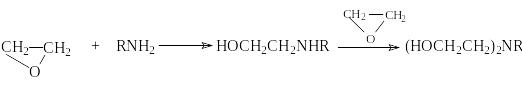
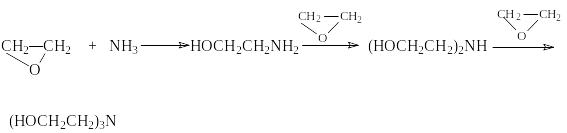
Приведенные реакции имеют важное препаративное и промышленное значение. Получаемый гидратацией этилена этиленгликоль являются антифризом и исходным веществом для синтеза лавсана, этаноламины используются в качестве абсорбентов для извлечения кислых примесей из газов. Оксиэтилирование реактивов Гриньяра – важный способ увеличения длины углеродной цепи органических соединений на два углеродных атома.
Если в реакциях нуклеофильного замещения оксиранов участвуют нуклеофилы HNu, обладающие слабой нуклефильной активностью и слабой кислотностью (H2O, H2S, RSN), то для эффективного проведения этих реакций используют кислотный или основной катализ. Например, кислотно–каталитическая реакция со спиртами связана с эффективным протонированием оксирана, приводящим к увеличению положительного заряда на его углеродных атомах и делающим атаку нуклеофила более эффективной:
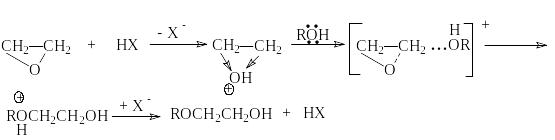
И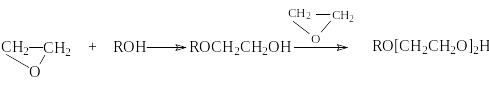 ли
суммарно
ли
суммарно
алкилцеллозольв алкилкарбитол
Образующиеся в этих реакциях целлозольвы и карбитолы – универсальные растворители.
При основном катализе под действием основания продуцируется более эффективный нуклеофил, например, в реакциях с ROH, RSH, H2S, HCN, эффективно атакующий углеродный атом оксиранового цикла:
![]()
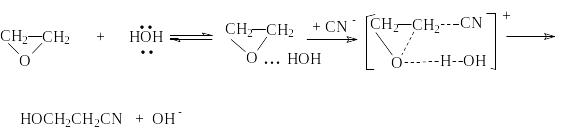
или суммарно: