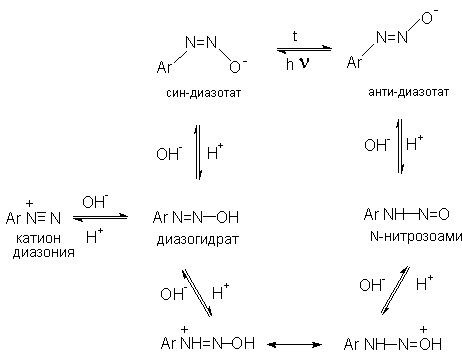- •Лекция №47-48 диазосоединения
- •Ароматические диазосоединения Классификация и номенклатура
- •Соединения, содержащие ионную связь (соли диазония):
- •Методы получения солей арендиазония
- •Механизм реакции диазотирования
- •Условия проведения реакции диазотирования
- •Физические свойства и строение
- •Химические свойства
- •1. Равновесия между различными формами диазосоединений в водных растворах. Образование и строение диазотатов
- •2. Реакции солей арендиазония
- •Замещение диазогруппы на иод
- •Реакции, идущие без выделения азота
- •Строение и физические свойства
- •Методы получения
- •Химические свойства
- •Реакции с протонными кислотами
- •2. Реакции с карбонильными соединениями
- •Реакции биполярного присоединения
- •Фотохимическое и термическое разложение
Физические свойства и строение
Соли арендиазония – бесцветные кристаллические вещества. Хлориды, гидросульфаты и нитраты хорошо растворимы в воде и используются в основном в виде водных растворов. В твердом виде они неустойчивы и взрываются от трения и от нагревания. Соли арендиазония с некоторыми комплексными анионами (PF6-, SbF6-, BF4-) нерастворимы в воде и достаточно стабильны при хранении их в сухом виде в течение длительного времени.
В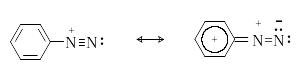 целом соли арендиазония гораздо
устойчивее алифатических аналогов, что
обусловлено стабилизирующим влиянием
-системы ароматического
ядра, которое участвует в делокализации
положительного заряда.
целом соли арендиазония гораздо
устойчивее алифатических аналогов, что
обусловлено стабилизирующим влиянием
-системы ароматического
ядра, которое участвует в делокализации
положительного заряда.
Э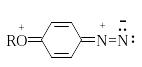 лектронодонорные
заместители в о- и п-положениях
обеспечивают дополнительную стабилизацию
арендиазониевого катиона.
лектронодонорные
заместители в о- и п-положениях
обеспечивают дополнительную стабилизацию
арендиазониевого катиона.
Сама диазониевая группа может быть представлена набором из двух резонансных структур.
Н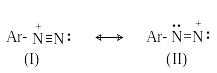 аибольший
вклад в резонанс вносит структура (I).
По данным рентгеноструктурного анализа
связь азот-азот по длине соответствует
тройной (0,11 нм). ИК-спектры содержат
полосу поглощения в области 2100-2300 см-1,
что соответствует валентным колебания
связи NN. Второй атом
азота несет частичный положительный
заряд (структура (II)) и является
электрофильным центром в реакциях
диазониевых солей.
аибольший
вклад в резонанс вносит структура (I).
По данным рентгеноструктурного анализа
связь азот-азот по длине соответствует
тройной (0,11 нм). ИК-спектры содержат
полосу поглощения в области 2100-2300 см-1,
что соответствует валентным колебания
связи NN. Второй атом
азота несет частичный положительный
заряд (структура (II)) и является
электрофильным центром в реакциях
диазониевых солей.
Диазониевая группа является сильнейшим электроноакцептором и превосходит в этом отношении нитрогруппу.
Химические свойства
1. Равновесия между различными формами диазосоединений в водных растворах. Образование и строение диазотатов
Форма существования диазосоединений в растворе зависит от рН. Катионы диазония могут существовать в кислой среде и в средах, близких к нейтральной. При обработке растворов солей диазония щелочью образуются диазотаты.
ArN2+X- + 2NaOH Ar-N=N-O- Na+ + NaX + H2O
Процесс протекает в две стадии. Сначала катион диазония, как кислота Льюиса, взаимодействует с гидроксид-ионом с образованием диазогидроксида, который, будучи кислотой Бренстеда, быстро реагирует с еще одним эквивалентом щёлочи с образованием диазотат- аниона
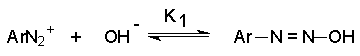
![]()
Для приведенных выше равновесий К2>К1, поэтому концентрация диазогидрата в водном растворе очень мала.
Д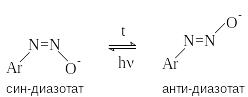 иазотат-анионы
существуют в анти-
и син-формах.
При взаимодействии катиона арендиазония
со щелочью первоначально образуется
менее стабильный син-диазотат,
который медленнно изомеризуются в более
стабильную анти-форму.
Изомеризацию ускоряет нагревание и
присутствие в бензольном кольце
электроноакцепторных групп. Обратная
изомеризация наблюдается только при
УФ облучении.
иазотат-анионы
существуют в анти-
и син-формах.
При взаимодействии катиона арендиазония
со щелочью первоначально образуется
менее стабильный син-диазотат,
который медленнно изомеризуются в более
стабильную анти-форму.
Изомеризацию ускоряет нагревание и
присутствие в бензольном кольце
электроноакцепторных групп. Обратная
изомеризация наблюдается только при
УФ облучении.
Диазотат-ионы являются амбидентными ионам с двумя нуклеофильными центрами - кислородом и азотом. анти-Диазотат протонируется исключительно по атому азота с образованием N-нитрозоамина.
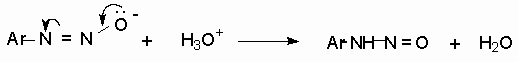
Далее N-нитрозоамин в кислой среде медленно превращается в катион арендиазония, как это было описано ранее в соответствии со стадиями (2 - 6) при обсуждении механизма диазотирования.
син-Диазотаты при протонировании образуют диазогидраты в результате протонирования по кислороду. Диазогидрат далее очень быстро превращается в кислой среде в катион арендиазония.
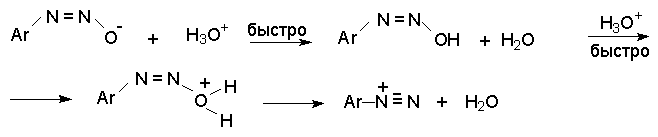
Общую схему протолитических превращений ароматических диазосоединений в водном растворе можно представить следующим образом.