
- •Лекция №47-48 диазосоединения
- •Ароматические диазосоединения Классификация и номенклатура
- •Соединения, содержащие ионную связь (соли диазония):
- •Методы получения солей арендиазония
- •Механизм реакции диазотирования
- •Условия проведения реакции диазотирования
- •Физические свойства и строение
- •Химические свойства
- •1. Равновесия между различными формами диазосоединений в водных растворах. Образование и строение диазотатов
- •2. Реакции солей арендиазония
- •Замещение диазогруппы на иод
- •Реакции, идущие без выделения азота
- •Строение и физические свойства
- •Методы получения
- •Химические свойства
- •Реакции с протонными кислотами
- •2. Реакции с карбонильными соединениями
- •Реакции биполярного присоединения
- •Фотохимическое и термическое разложение
Лекция №47-48 диазосоединения
План
Ароматические диазосоединения.
Алифатические диазосоединения.
Диазосоединения содержат группу N2, причем один атом азота связан с органическим радикалом, а другой - с гетероатомом. Ароматические и алифатические диазосоединения сильно различаются по строению, стабильности и реакционной способности.
Ароматические диазосоединения Классификация и номенклатура
Ароматические диазосоединения имеют общую формулу ArN2X. В зависимости от типа связи между фрагментами ArN2 и X различают следующие типы диазосоединений.
Соединения, содержащие ионную связь (соли диазония):
ArN2+X-
X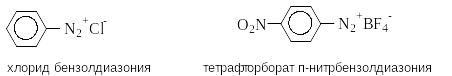 -
– анион
сильной кислоты с низкой нуклеофильностью,
в том числе комплексный ион (Cl-,
Br-
HSO4-,
BF4-,
SbF6-,
PF6-),
например:
-
– анион
сильной кислоты с низкой нуклеофильностью,
в том числе комплексный ион (Cl-,
Br-
HSO4-,
BF4-,
SbF6-,
PF6-),
например:
Соединения, содержащие ковалентную связь:
Ar-N=N-X
X= -CN, -OCOCH3, -I, -SO3H, -OH, -OAr, -NH-Ar
Например:
C6H5-N=N-CN C6H5-N=N-OH C6H5-N=N-O- Na+
бензолдиазоцианид бензолдиазогидроксид бензолдиазотат натрия
Основной тип ароматический диазосоединений – соли арендиазония.
Методы получения солей арендиазония
Основной метод получения солей арендиазония – диазотирование. Процесс диазотирования выражается следующим суммарным уравнением.
ArNH2 + NaNO2 + 2 HX ArN+=N X - + NaX + 2 H2O
(X= Cl, HSO4, BF4 и др.)
Механизм реакции диазотирования
Механизм включает cтадии нитрозирования амина. Нитрозирующими агентами являются соединения общей формулы O=N-X. Сама азотистая кислота (X=OH) является слишком слабым электрофильным реагентом, поэтому для ускорения процесса требуется присутствие сильной кислоты, в водном растворе которой азотистая кислота частично протонируется с образованием очень активного электрофильного агента - нитрозацидий-катиона:
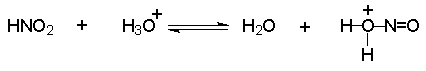
Этот катион гораздо быстрее реагирует с неорганическими анионами, присутствующими в растворе, чем с амином. В результате образуются новые нитрозирующие реагенты: азотистый ангидрид, хлористый или бромистый нитрозил.

В разбавленных водных растворах серной, фосфорной, хлорной и других кислот с малонуклеофильными анионами нитрозирующим агентом является азотистый ангидрид N2O3 . При диазотировании в растворах HCl и HBr электрофильными агентами являются соответственно NOCl и NOBr. В сильно кислой среде активной частицей является, вероятно, катион H2NO2+. Наиболее активный нитрозирующий агент - нитрозилсерная кислота получается при взаимодействии нитрита натрия с концентрированной серной кислотой.
2 H2SO4 + NaNO2 --- O=N-OSO3H + NaHSO4 + H2O
Диазотирование всегда проводят в кислой среде, где протолитическое равновесие сильно смещено вправо.
![]()
Тем не менее диазотированию подвергается амин в виде свобoдного основания.
Механизм диазотирования включает образование нитрозамина, таутомерное превращение его в диазогидроксид, протонированная форма которого отщепляет молекулу воды с образованием катиона диазония.
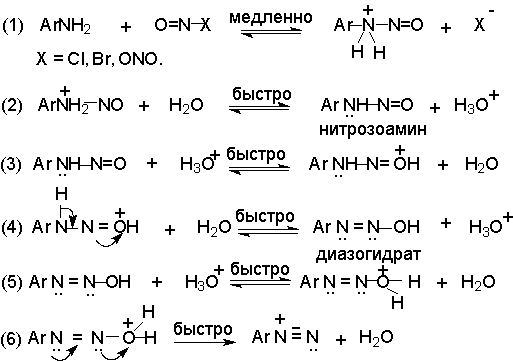
Лимитирующей стадией процесса является образование катиона N-арилнитрозоаммония. Далее следует ряд быстрых протолитических равновесий. На стадии (4) происходит отщепление протона от азота или кислорода, поскольку исходный катион формально является аналогом аллильного катиона. Депротонирование кислорода приводит к исходному субстрату - нитрозамину, тогда как депротонирование азота ведет к образованию конечного продукта - соли арендиазония.
