
- •Растворы электролитов
- •Вывод и анализ закона разведения Оствальда для электролита валентного типа 1:1. влияние концентрации и температуры на константу диссоциации и степень диссоциации слабых электролитов.
- •Теория электролитической диссоциации Аррениуса.
- •Проводники электрического тока I и II рода. Удельная, молярная и эквивалентная электрические проводимости, связь между ними. Зависимость удельной и молярной электрических проводимостей от концентрации.
- •Кондуктометрическое титрование.
- •Числа переноса в растворе данного электролита, их связь с электрической проводимостью ионов. Эстафетный механизм переноса электрического тока ионами гидроксила и гидроксония.
- •Природа сил торможения при движении ионов в растворах сильных электролитов. Электрофоретический и релаксационный эффекты снижения электропроводности в растворах сильных электролитов.
- •Методы определения молярной электрической проводимости раствором сильных и слабых электролитов при бесконечном разведении.
- •Зависимость подвижности иона от его заряда и размеров.
- •Теория Дебая-Хюккеля.
- •Активность и коэффициент активности.
- •Растворимость и произведение растворимости малорастворимых соединений.
- •ЭДС гальванических элементов
- •Классификация электродов.
- •Водородный электрод
- •Хлоридсеребряный электрод
- •Окислительно-восстановительные электроды
- •Элемент Даниэля-Якоби
- •Нормальный элемент Вестона
- •Классификация электрохимических цепей
- •Концентрационные гальванические элементы
- •Формальная кинетика
- •Скорость, константа скорости, основной постулат химической кинетики
- •Кинетические кривые
- •Порядок реакции
- •Интегральные методы нахождения порядка реакции.
- •Дифференциальные методы определения порядка реакции.
- •Влияние температуры на скорость химической реакции
- •Кинетика сложных реакций
- •Обратимые реакции первого порядка
- •Параллельные реакции первого порядка
- •Последовательные реакции первого порядка
- •Метод квазистационарных концентраций
- •Теории кинетики, цепные и фотохимические реакции, катализ.
- •Теория активных соударений
- •Мономолекулярные газовые реакции. Схема Линдемана
- •Теория переходного состояния (теория активированного комплекса)
- •Кинетика реакций в растворах
- •Клеточный эффект.
- •Кинетика медленных реакций в растворах.
- •Влияние растворителя на скорость реакций
- •Цепные реакции
- •Основные стадии цепной реакции
- •Кинетическое уравнение для неразветвленной цепной реакции
- •Нахождение длины цепи неразветвленной цепной реакции
- •Разветвленные цепные реакции
- •Кинетическое уравнение для разветвленной цепной реакции
- •Пределы воспламенения
- •Фотохимические реакции

этом концентрации всех промежуточных веществ в данной точке пространства остаются постоянными, т. е. скорости образования и расходования веществ равны и постоянны во времени.
Теории кинетики, цепные и фотохимические реакции, катализ.
Теория активных соударений
ТАС позволяет рассчитать величину предэкспоненциального множителя А. Основные положения ТАС:
1)реакция происходит в результате столкновения реагирующих частиц;
2)протекание химической реакции не приводит к нарушению максвелл-больцмановского распределения молекул по скоростям;
3)в первом приближении не накладывается никаких ограничений на форму реагирующих молекул и предпочтительность их ориентации относительно друг друга.
Уравнение для расчета общего числа соударений между разнотипными молекулами А и В может быть получено из молекулярно-кинетической теории газов:
N AB=nA nB d 2 π |
|
8 kБ T 1/ 2 |
, где NAB – число столкновений в единице объема в единицу |
||
|
|
|
|||
(π μ AB ) |
|||||
|
|
||||
времени; nA, nB – количество молекул в единице объема; d – расстояние наибольшего сближения сталкивающихся частиц, сумма их радиусов: d = rA + rB [м]; kБ — константа
Больцмана; T – температура [K]; μAB – приведенная масса, |
μ AB= |
ma mB |
[кг]. |
mA+mB |
Если выразить число соударений через моль вещества, получим:
|
|
|
|
|
8 RT π (M +M |
) |
1 /2 |
|||
N AB=nA nB d 2( |
|
A |
B |
) |
, где R – универсальная газовая постоянная. |
|||||
|
M A M B |
|
||||||||
Для однотипных молекул A-A уравнение принимает вид: |
||||||||||
|
|
2 |
2 |
|
|
8 R T π |
1 /2 |
|
|
|
|
( |
) . |
|
|
|
|||||
N AA=√2 n Ad |
|
M A |
|
|
|
|||||
Для того, чтобы при столкновении реакция произошла, необходимо, чтобы сталкивающиеся молекулы обладали некоторой избыточной энергией. Столкновения, при которых реакция произошла, называют эффективными соударениями. Чтобы найти число эффективных соударений, необходимо умножить число общих соударений на долю молекул, обладающих нужной избыточной энергией. Долю можно найти по максвелл-больцмановскому распределению:
nE* |
−E* |
−E * |
|
8 R T π (M A+M B) |
1/ 2 −E* |
||
=e RT ; nE *=N AB e RT =nA nB d 2 |
( |
) |
e RT . |
||||
|
M A M B |
||||||
N AB |
|
|
|||||
Согласно исходному постулату этой теории, других ограничений, кроме энергетических, не накладывается, поэтому скорость реакции должна совпадать с числом эффективных соударений в единице объема в единицу времени:
r=− dcdta =−dcdtB =nE *
Основной постулат химической кинетики:
|
r |
|
r |
|
|
8 π R T (M A +M B) |
1 /2 |
|
−E* |
3 |
|
|
|
|
2 |
( |
) |
|
RT |
|
м |
||||
r=k[ A][B] k = |
|
= |
|
=d |
|
e |
|
,[ |
|
] |
||
[ A][B] |
nA nB |
M A M B |
|
молек с |
||||||||
Перейдем к привычным единицам измерения константы скорости:
|
8 |
π RT (M +M |
) |
1 /2 |
−E* |
|
|
|
k=103 N A d 2 ( |
) |
e RT ,[ |
л |
|
] |
|||
|
A |
B |
|
|||||
|
M A M B |
|
моль |
с |
||||
Прологарифмируем это уравнение и возьмем производную по температуре:
ln k=ln const+ ln T |
− |
E* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
RT |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
d ln k |
= |
|
1 |
|
+ |
E* |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
dT |
2T |
RT 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
d ln k |
|
|
Ea |
|
|
|
|
|
|
|
|
* |
|
RT |
|
* |
|
|
|||||
Уравнение Аррениуса: |
|
|
|
|
= |
|
|
|
E |
|
=E |
+ |
|
|
|
|
≈E |
|
. |
|
||||||||||||||||
|
|
dT |
|
RT |
|
|
2 |
|
|
|||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
A |
|
|
|
|
|
|
|
|
|
|
|||||||
−E * |
|
− Ea |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
e RT =e RT e1/ 2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1/2 |
|
−Ea |
|
|
|
|
|
|
− Ea |
|
|
|
|
|||||
|
3 |
|
|
2 |
( |
8 π RT (M +M |
) |
) |
|
|
|
|
1/ |
2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
k=10 |
|
N A d |
|
|
|
|
|
A |
|
B |
|
e |
RT e |
|
|
|
= Ae RT |
, где A – предэкспоненциальный |
||||||||||||||||||
|
|
|
|
|
|
M A M B |
|
|
|
|
|
|
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 / 2 |
|
|
|
|
|
|
−Ea |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
2 |
( |
8 π RT (M +M |
|
) |
) |
|
|
1 /2 |
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
множитель, |
|
A=10 |
|
N A d |
|
|
|
A |
|
|
B |
e |
|
|
= Ae RT . |
|||||||||||||||||||||
|
|
|
|
|
M A M B |
|
|
|
|
|
|
|||||||||||||||||||||||||
Как видно, A = f(T) ~ T1/2.
ТАС исключает из рассмотрения все особенности молекул, кроме их масс и размеров, поэтому рассчитанные значения А не совпадают с экспериментальными. Различия между реальным значением А и рассчитанным по ТАС устраняются путем введения стерического
фактора p: |
p= |
Aэксп |
|
−8 |
. Чем сложнее структура молекулы, тем меньше p. |
|||||||||||||||||||
|
=1÷10 |
|||||||||||||||||||||||
AТАС |
||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1/ 2 |
|
− Ea |
|
|
||
|
|
|
3 |
|
2 |
( |
8 π R T (M +M |
B |
) |
) |
1 / 2 |
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||||
k= p |
10 |
|
|
N A d |
|
|
|
A |
|
|
|
e |
e RT . |
|
|
|||||||||
|
|
|
|
|
M A M B |
|
|
|
|
|
|
|||||||||||||
Для одинаковых молекул А-А: |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
1 / 2 |
|
|
|
|
|
−Ea |
|
|
|
1 dcA |
|
|
|
√2 |
|
|
|
|
|
|
8 π R T |
|
|
|
|
|
|
|
|
|
|||||||
|
|
3 |
|
|
2 |
( |
) |
|
1 /2 |
|
|
RT |
|
|
|
|
||||||||
k= p |
2 |
|
|
10 N A d |
|
M A |
e |
|
|
e |
|
, т. к. r=−ν |
|
;ν =2 . |
||||||||||
|
|
|
|
|
|
dt |
||||||||||||||||||
Мономолекулярные газовые реакции. Схема Линдемана
Распад сложных молекул в газовой фазе возможен, когда уровень запасенной колебательной энергии превзойдет некоторое пороговое значение.
Распадающаяся молекула накапливает колебательную энергию за счет столкновений с другими молекулами:
1)A + A → k1 → A + A*
2)A* + A → k2 → A + A
3)A* → k3 → продукты

Мономолекулярная реакция в схеме Линдемана рассматривается как комбинация двух бимолекулярных процессов и одного мономолекулярного.
Метод квазистационарных концентрация:
dcпрод =k [ A* ]
dt 3
d[ A* ]=k1 [ A]2−k2 [ A* ][ A]−k3 [ A*]=0 dt
[ A* ]= |
k1 [ A]2 |
|
k2 [ A]+k 3 |
||
|
r= dcпрод = k1 k3 [ A]2 dt k2 [ A]+k3
При малых давлениях, когда промежуток времени между столкновениями превосходит время жизни молекул A*, можно считать, что k2[A] << k3. В таком случае:
r= dcпрод = k 1 k3 [ A]2 |
=k1 [ A]2 - второй порядок. |
|
dt |
k 3 |
|
Если давление высокое, высокая концентрация реагентов или добавлен инертный газ, то время жизни молекул А* становится очень малым и можно считать, что k2[A] >> k3. Тогда:
r= dcпрод = k 1 k3 [ A]2 |
= |
k1 k3 |
[ A] - первый порядок. |
|
|
||||
dt |
k2 [ A] |
|
k2 |
|
Теория переходного состояния (теория активированного комплекса)
Эта теория позволяет рассчитать абсолютные скорости химических реакций на основании фундаментальных свойств реагирующих молекул, таких как геометрическая конфигурация, межъядерное расстояние, силовые постоянные связи и т. д.
Основные идеи теории:
В любой элементарной химической реакции начальная конфигурация атомов переходит в конечную путем непрерывного изменения межъядерных расстояний, силовых постоянных и валентных углов. При этом всегда существует некоторая промежуточная конфигурация, достижение которой связано с преодолением минимального энергетического барьера.
Путь, по которому сближаются молекулы, соответствующий минимальным энергетическим затратам, называется координатой реакции.
Состояние, отвечающее наибольшей энергии при движении вдоль координаты реакции, называется переходным, или состоянием активированного комплекса. Оно соответствует ситуации, когда связи между реагентами уже ослаблены, но еще не разорваны до конца. Одновременно связи между продуктами уже образовались, но еще недостаточно сильны, чтобы отделиться от сопряжения с реагентами: X-Y + Z → X...Y...Z → X + Y-Z.
Поскольку образование активированного комплекса связано с преодолением максимума потенциальной энергии, оно отвечает возникновению неустойчивого состояния. Вместе с этим данное состояние отвечает минимальному из всех возможных энергетических барьеров, поэтому активированный комплекс устойчивее, чем любое другое состояние, не соответствующее координате реакции. Для нахождения координаты реакции пользуются методами квантовой химии.
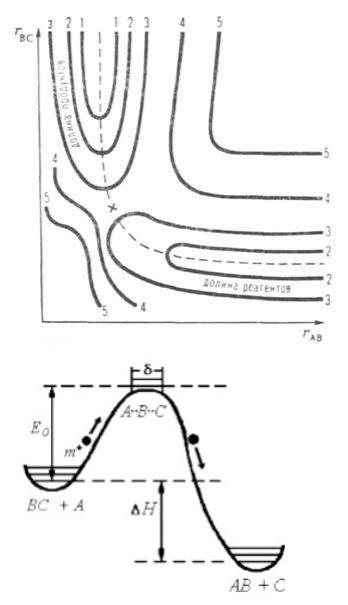
В основе этой теории лежит понятие многомерной поверхности потенциальной энергии (ППЭ). Простейшая двумерная ППЭ показана на рисунке. Реагентам и продуктам соответствуют области относительно небольшой потенциальной энергии (долины), разделенные областью повышенной энергии — потенциальным барьером. Кривая пунктирная линия, проходящая по дну долин через барьер — координата реакции. Крестиком отмечена седловая точка, или точка перевала. Часто используют одномерные схемы, изображающие сечение ППЭ, развернутое вдоль координаты реакции (след. рисунок).
E0 отвечает изменению внутренней энергии системы, которое сопровождает образование активированного комплекса из исходных веществ при абсолютном нуле температур.
E0 – разница между нулевыми энергиями активированного комплекса и исходных веществ.
E0 – истинная энергия активации. Она не зависит от температуры и не является энергией активации Ea.
Ea – избыточная энергия по сравнению со средней, необходимая для образования активированного комплекса, она зависит от температуры.
Постулаты теории:
1)активированный комплекс находится в состоянии термодинамического равновесия с исходными веществами: A + B <=> kc≠ <=> [≠]
2)активированный комплекс необратимо распадается на продукты реакции: [≠] → k≠ → прод
k ≠ = |
|
[ ≠] |
|
[≠]=k ≠ [ A][ B] |
|||||||
[ |
A][ B |
] |
|||||||||
c |
|
|
|
|
c |
|
|||||
|
dcпрод |
|
≠ |
|
≠ |
≠ |
|
||||
r= |
|
|
=k |
|
|
[≠ ]=k |
|
k c |
[ A][B ] |
||
dt |
|
|
|
|
|||||||
При постоянной температуре k≠, kc≠ = const, k≠kc≠ = kr. r=kr [ A][ B]
Константа скорости мономолекулярного распада активированного комплекса равна обратной
величине от средней продолжительности жизни активированного комплекса: |
k ≠= |
1 |
. |
≠ |
|||
|
|
t |
|
С использованием методов статистической термодинамики можно получить выражение для
расчета этой константы: k |
≠ |
= |
1 |
= |
kБ T |
, h – постоянная Планка. |
|
|
|
|
|
|
|
|
|||
|
t |
≠ |
h |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Энергия колебательного движения одной молекулы: E=k |
|
T =hν = |
h |
=hk |
≠ |
k |
≠ |
= |
k Б T |
. |
|||||||
Б |
t≠ |
|
|
h |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
k≠ зависит только от температуры и не зависит от типа реакции.
Кинетическая индивидуальность различных реакций в рамках данной теории обусловлена концентрацией молекул акт. комплекса, которая зависит от типа реакции и природы исходных веществ:
|
|
|
|
kr= |
k Б T |
kc≠ |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
атм л |
|
|||||||||
|
|
|
|
|
|
h |
|
|
|
|
||||||
≠ |
≠ |
̃ |
−Δν |
̃ |
|
|
|
|
||||||||
kc |
=k p |
( RT ) |
, R=0,082 |
|
|
|
|
|
|
|||||||
моль К |
, где Δυ — разность моль продуктов и акт. комплекса. |
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
r GT0 |
|
|
|
|
|
|
|
− |
r GT0 |
|
|||||
|
=−R T ln k p k p=e |
RT |
|
|
||||||||||||
|
|
|
r GT0 = r H T0 −T r ST0 |
|
|
|
|
|||||||||
|
|
k Б T |
̃ |
−Δν |
− |
S ≠ |
|
− |
|
H ≠ |
|
|||||
|
|
R |
|
|
RT |
|
|
|||||||||
|
kr= |
|
|
(R T ) |
e |
e |
|
|
|
|
||||||
|
|
h |
|
|
|
|
||||||||||
Взаимосвязь опытной энергии активации с энтальпией и внутренней энергией активации:
Уравнение Аррениуса: |
dlnk |
= |
Ea |
|
||||||||||
|
dT |
RT 2 |
||||||||||||
|
|
|
|
|
|
|
|
|||||||
|
k Б T |
̃ |
|
|
|
|
|
|
S ≠ |
|
H≠ |
|||
|
|
|
−Δν |
|
− |
R |
− RT |
|||||||
kr= |
|
|
(R T ) |
|
e |
|
|
|
e |
|||||
|
h |
|
|
|
|
|||||||||
ln k r =ln const+ln T 2− |
|
H ≠ |
|
|||||||||||
|
RT |
|||||||||||||
|
|
d ln k |
2 |
|
|
H ≠ |
||||||||
|
|
|
|
|
|
|
||||||||
|
|
|
= |
|
+ RT 2 |
|
|
|
||||||
|
|
dT |
T |
|
|
|
||||||||
Ea=2RT+ |
|
H ≠ - бимолекулярные реакции |
||||||||||||
Ea =RT + H ≠ - мономолекулярные реакции
H ≠ − U ≠=Δν ≠ RT
H ≠ − U ≠=−RT - бимолекулярные реакции
H ≠− U ≠ =0 - мономолекулярные реакции
Ea = U ≠+ RT
Предэкспоненциальный множитель, энтропия активации и молекулярная неупорядоченность активированного комплекса:
H ≠ =Ea −2RT
|
k Б T |
̃ |
−Δν |
− |
S ≠ |
|
−Ea+2RT |
k Б T |
̃ |
−Δν |
− |
S ≠ |
|
2 |
− |
Ea |
− |
Ea |
||||||||
|
R |
|
|
|
RT |
|
|
R |
|
RT |
RT |
|||||||||||||||
k r = |
|
( RT ) |
e |
|
e |
|
|
= |
|
|
(R T ) |
|
|
e |
|
e |
|
e |
= Ae |
|||||||
h |
|
|
|
h |
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
k |
Б T |
|
̃ |
|
|
|
− |
S ≠ |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
−Δν |
|
R |
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
A= |
|
|
(R T ) |
e |
|
|
e |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
h |
|
|
|
|
|
|
|
|
|
|
|
|||||||||
Уравнение ТПС включает в себя частотный фактор kБT/h, который является аналогом фактора, учитывающий общее число соударений в ТАС, и энтропийный фактор — индивидуальную характеристику реакции.
Энтропию активации очень трудно вычислить, т. к. обычно нет данных о пространственном строении активированного комплекса, поэтому ее находят по обратной задаче через kr и Ea.
