
- •Растворы электролитов
- •Вывод и анализ закона разведения Оствальда для электролита валентного типа 1:1. влияние концентрации и температуры на константу диссоциации и степень диссоциации слабых электролитов.
- •Теория электролитической диссоциации Аррениуса.
- •Проводники электрического тока I и II рода. Удельная, молярная и эквивалентная электрические проводимости, связь между ними. Зависимость удельной и молярной электрических проводимостей от концентрации.
- •Кондуктометрическое титрование.
- •Числа переноса в растворе данного электролита, их связь с электрической проводимостью ионов. Эстафетный механизм переноса электрического тока ионами гидроксила и гидроксония.
- •Природа сил торможения при движении ионов в растворах сильных электролитов. Электрофоретический и релаксационный эффекты снижения электропроводности в растворах сильных электролитов.
- •Методы определения молярной электрической проводимости раствором сильных и слабых электролитов при бесконечном разведении.
- •Зависимость подвижности иона от его заряда и размеров.
- •Теория Дебая-Хюккеля.
- •Активность и коэффициент активности.
- •Растворимость и произведение растворимости малорастворимых соединений.
- •ЭДС гальванических элементов
- •Классификация электродов.
- •Водородный электрод
- •Хлоридсеребряный электрод
- •Окислительно-восстановительные электроды
- •Элемент Даниэля-Якоби
- •Нормальный элемент Вестона
- •Классификация электрохимических цепей
- •Концентрационные гальванические элементы
- •Формальная кинетика
- •Скорость, константа скорости, основной постулат химической кинетики
- •Кинетические кривые
- •Порядок реакции
- •Интегральные методы нахождения порядка реакции.
- •Дифференциальные методы определения порядка реакции.
- •Влияние температуры на скорость химической реакции
- •Кинетика сложных реакций
- •Обратимые реакции первого порядка
- •Параллельные реакции первого порядка
- •Последовательные реакции первого порядка
- •Метод квазистационарных концентраций
- •Теории кинетики, цепные и фотохимические реакции, катализ.
- •Теория активных соударений
- •Мономолекулярные газовые реакции. Схема Линдемана
- •Теория переходного состояния (теория активированного комплекса)
- •Кинетика реакций в растворах
- •Клеточный эффект.
- •Кинетика медленных реакций в растворах.
- •Влияние растворителя на скорость реакций
- •Цепные реакции
- •Основные стадии цепной реакции
- •Кинетическое уравнение для неразветвленной цепной реакции
- •Нахождение длины цепи неразветвленной цепной реакции
- •Разветвленные цепные реакции
- •Кинетическое уравнение для разветвленной цепной реакции
- •Пределы воспламенения
- •Фотохимические реакции
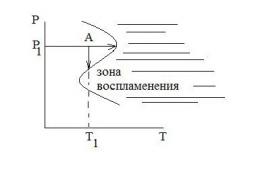
Пределы воспламенения
Существует нижний и верхний пределы воспламенения. Это объясняется тем, что ниже нижнего предела p1 количество радикалов, адсорбирующихся на стенке, превышает количество зарождающихся радикалов, и система находится в стационарном режиме. При достижении нижнего предела p1 количество толкновений радикалов возрастает и реакция становится неуправляемой. Однако при достижении верхнего предела p2 квадратичный обрыв цепи становится все более заметным и скорость реакции падает, в результате чего система вновь переходит в
стационарное состояние.
Фотохимические реакции
В ходе фотохимической реакции активация реагентов происходит в результате поглощения видимого или УФ излучения. К фотохимическим реакциям относятся реакции фоторазложения, большинство реакций в атмосфере, большинство цепных реакций.
По механизму ФХР делятся на 3 группы:
1)в результате поглощения излучения молекулы переходят в возбужденное состояние без ее разложения;
2)в результате поглощения излучения происходит образование активных частиц в результате фотодиссоциации;
3)если реагирующая молекула не может поглотить излучение в данной области спектра, в реакционную смесь вводятся вещества, способные к поглощению и которые затем испускают излучение в той области спектра, в которой реагирующие вещества могут его поглощать. Такие процессы называются фотосенсибилизационными.
Пример такой реакции:
(UO2)2+ → 250-450нм → (UO2)2+* (COOH)2 → (UO2)2+* → CO + CO2 + H2O
Все дальнейшие превращения относятся к вторичным ФХ процессам. При поглощении излучения происходит возбуждение молекулы и переход электронов из основного состояния в возбужденное. При этом изменяется энергия связи в возбужденной молекуле (как правило, становится меньше). Возможен разрыв связи с образованием радикалов или более простых устойчивых молекул.
Поглощенная молекулой энергия может пойти на следующие процессы:
1)флуоресценция — излучательный переход возбужденной молекулы из самого нижнего синглетного колебательного уровня в нормальное состояние;
2)фосфоресценция — такой же переход, но через промежуточный уровень. Вероятность намного выше;
3)в результате столкновения с другими молекулами поглощенная энергия может перейти в энергию теплового движения.
Основные законы фотохимии:
1.Закон Гроттгуса-Дрепера — эффективным для фотохимического процесса является только то излучение, которое поглощается данным веществом.

2.Закон Вант-Гоффа — количество фотохимически преобразованного вещества пропорционально количеству поглощенной энергии, инициирующей реакцию.
3.Закон квантовой активации Штарка-Эйнштейна — на первичной стадии ФХ процесса молекула активируется при поглощении одного кванта ЭМИ.
Квантовый выход
Ф= N
N кв
Квантовый выход — это отношение числа молекул, превращенных в продукты, к количеству поглощенных квантов излучения.
Nкв = hEν
Вобычных реакциях, когда в продукты превращаются возбужденные молекулы, Ф < 1.
Вслучае, если возбужденные частицы принимают участие во вторичных процессах, Ф > 1.
Вцепных реакциях Ф = 10-106.
Величина Ф зависит от ряда факторов, таких как давление компонентов, присутствие посторонних веществ, материал сосуда и соотношение площади поперечного сечения в объему.
Отличительные черты фотохимических реакций.
Вотсутствие фотохимической активации происходит термическая активация молекулы, т. е. в реакцию вступают те молекулы, у которых энергий выше.
ВФХР поглощенное излучение существенно больше, поэтому концентрация активных частиц гораздо выше.
ФХР протекают гораздо быстрее, чем термически активируемые частицы.
Если, несмотря на ФХ активацию, скорость реакции сопоставима со скоростью термически активированной реакции, то это означает, что лимитирующей стадией реакции является вторичная физико-химическая реакция.
Температура практически не оказывает влияние на скорость фотохимической реакции, т. к. энергия ЭМИ гораздо выше энергии теплового движения.
