
- •Растворы электролитов
- •Вывод и анализ закона разведения Оствальда для электролита валентного типа 1:1. влияние концентрации и температуры на константу диссоциации и степень диссоциации слабых электролитов.
- •Теория электролитической диссоциации Аррениуса.
- •Проводники электрического тока I и II рода. Удельная, молярная и эквивалентная электрические проводимости, связь между ними. Зависимость удельной и молярной электрических проводимостей от концентрации.
- •Кондуктометрическое титрование.
- •Числа переноса в растворе данного электролита, их связь с электрической проводимостью ионов. Эстафетный механизм переноса электрического тока ионами гидроксила и гидроксония.
- •Природа сил торможения при движении ионов в растворах сильных электролитов. Электрофоретический и релаксационный эффекты снижения электропроводности в растворах сильных электролитов.
- •Методы определения молярной электрической проводимости раствором сильных и слабых электролитов при бесконечном разведении.
- •Зависимость подвижности иона от его заряда и размеров.
- •Теория Дебая-Хюккеля.
- •Активность и коэффициент активности.
- •Растворимость и произведение растворимости малорастворимых соединений.
- •ЭДС гальванических элементов
- •Классификация электродов.
- •Водородный электрод
- •Хлоридсеребряный электрод
- •Окислительно-восстановительные электроды
- •Элемент Даниэля-Якоби
- •Нормальный элемент Вестона
- •Классификация электрохимических цепей
- •Концентрационные гальванические элементы
- •Формальная кинетика
- •Скорость, константа скорости, основной постулат химической кинетики
- •Кинетические кривые
- •Порядок реакции
- •Интегральные методы нахождения порядка реакции.
- •Дифференциальные методы определения порядка реакции.
- •Влияние температуры на скорость химической реакции
- •Кинетика сложных реакций
- •Обратимые реакции первого порядка
- •Параллельные реакции первого порядка
- •Последовательные реакции первого порядка
- •Метод квазистационарных концентраций
- •Теории кинетики, цепные и фотохимические реакции, катализ.
- •Теория активных соударений
- •Мономолекулярные газовые реакции. Схема Линдемана
- •Теория переходного состояния (теория активированного комплекса)
- •Кинетика реакций в растворах
- •Клеточный эффект.
- •Кинетика медленных реакций в растворах.
- •Влияние растворителя на скорость реакций
- •Цепные реакции
- •Основные стадии цепной реакции
- •Кинетическое уравнение для неразветвленной цепной реакции
- •Нахождение длины цепи неразветвленной цепной реакции
- •Разветвленные цепные реакции
- •Кинетическое уравнение для разветвленной цепной реакции
- •Пределы воспламенения
- •Фотохимические реакции

Энергий активации, которая находится из уравнения Аррениуса для сложных реакций является функций энергий активации элементарных реакций, составляющих сложную реакцию. Эта энергия называется эффективной энергией активации.
Кинетика сложных реакций
При рассмотрении кинетики сложных реакций делается допущение о независимом протекании элементарных стадий, т. е. что величина константы скорости элементарной химической реакции не зависит от того, протекают ли в данной системе одновременно другие элементарные реакции.
Обратимые реакции первого порядка
Обратимые элементарные реакции первого порядка состоят из прямой и обратной элементарных реакций первого порядка: A <=> B. k1 – константа скорости прямой реакции, k2
– обратной.
Скорость обратимой реакции равна разности скоростей прямой и обратной реакций:
w=w1−w2=k1 cA−k 2 cB , где cA, cB – концентрации веществ A и B в момент времени t.
Пусть cA = a – x, cB = b+ x, где x — убыль вещества A за время t с момента начала реакции, a, b - начальные концентрации веществ A и B. Тогда:
dxdt =k 1 (a− x)−k 2 (b+x)=(k1 +k2 )( k1 a−k2 b −x)
При наступлении равновесия скорости прямой и обратной реакции равны, а концентрация веществ не изменяется:
dx |
=0=(k1+k 2)( |
k1 a−k2 b |
− x) x= |
k1 a−k 2 b |
=x∞ |
, где x∞ - равновесная убыль |
|
dt |
k1+k 2 |
k 1+k2 |
|||||
|
|
|
|
концентрации, т. е. то изменение концентрации, которое произойдет от начала реакции до наступления равновесия. Тогда перепишем уравнение:
dxdt =(k1 +k2 )( x∞− x)
k |
+k |
= |
1 ln |
x∞ |
|
x∞− x |
|||||
1 |
2 |
|
t |
k1 > k2 |
k1 = k2 |

k1 < k2
Параллельные реакции первого порядка
К параллельным реакциям относятся химические превращения, когда взятое для реакции вещество претерпевает одновременное изменение в двух и более направлениях:
A →k1→ B, A →k2→ D.
Скорость расходования вещества А находится как сумма скоростей обеих реакций с учетом правила знаков:
w=−w1−w2=− |
dcA |
|
=k1 cA+k2 cA=(k1+k2 )cA |
|
, a – начальная концентрация вещества А. |
||||||||||||||||||||||
dt |
|
|
|||||||||||||||||||||||||
|
|
cA=a e−(k1+k 2)t |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
Найдем концентрации веществ B и D: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||
|
dc B |
|
|
|
−(k |
1+ k2)t |
|
|
|
|
|
|
k1 a |
|
|
−(k1+k 2)t |
|
|
|
|
|
|
|||||
|
|
=k1 cA dc B=k |
1 a e |
|
dt cB= |
|
|
|
|
|
|
(1−e |
|
|
) |
|
|
|
|
||||||||
|
dt |
|
|
k1+k2 |
|
|
|
|
|||||||||||||||||||
|
dcD |
|
|
|
−(k |
1+k2)t |
|
|
|
|
|
|
k 2 a |
|
|
|
−(k 1+k2)t |
|
|
|
|
|
|
||||
|
dt |
=k2 cA dc B=k |
2 ae |
|
dt cD= |
|
|
|
|
(1−e |
|
|
) |
|
|
|
|
||||||||||
|
|
k1+k 2 |
|
|
|
|
|
||||||||||||||||||||
|
|
|
|
|
|
|
Для нахождения констант скоростей каждой реакции можно |
||||||||||||||||||||
|
|
|
|
|
|
|
воспользоваться следующей системой уравнений: |
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
−(k1+ k2)t |
|
|
|
|
|
|
1 |
a |
|||||||||
|
|
|
|
|
|
|
c A=a e |
|
|
|
|
ln cA=ln a−(k 1+k2 )t k1+k 2= t ln |
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
cA |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
cB |
= |
k 1 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
cD |
k 2 |
|
|
|
||
|
|
|
|
|
|
|
Итак, зная концентрации всех веществ в текущий момент |
||||||||||||||||||||
|
|
|
|
|
|
|
времени, а также начальную концентрацию исходного |
||||||||||||||||||||
|
|
|
|
|
|
|
вещества, константы скоростей каждой из реакций находятся |
||||||||||||||||||||
|
|
|
|
|
|
|
путем решения системы уравнений: |
|
|
||||||||||||||||||
|
|
k1 > k2 |
|
|
|
|
|
k1 |
= |
cB |
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
k2 |
cD |
|
|
a |
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
k |
+k |
|
|
|
= 1 ln |
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
cA |
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
{1 |
|
|
2 |
|
t |
|
|
|
|
|
|
|
|
|
||||||
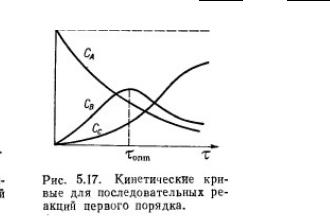
Последовательные реакции первого порядка
В последовательных реакциях промежуточные вещества, которые образуются в одной стадии, расходуются в последующей:
A → k1 → B → k2 → D
Обозначим концентрации веществ в различные промежутки времени: t = 0: cA = a, cB = 0, cD = 0
t:cA = a-x, cB = x-y, cD = y
t = t∞: cA = 0, cB = 0, cD = a
x – убыль вещества A, y – увеличение количества вещества D. Вещество А расходуется на реакцию k1:
−d (a−x ) |
=k1 |
(a− x) d (a− x) |
=−k 1 dt a−x=ae−k1 t |
dt |
|
a− x |
|
Вещества B образуется в результате реакции k1 и расходуется на реакцию k2:
|
d ( x− y ) |
|
|
|
k 1 a |
−k1 t |
−k2 t |
|
|
− |
|
=−k1 |
(a−x)+k2 |
( x− y) x− y= |
|
(e |
−e |
) |
|
dt |
k 2−k1 |
||||||||
|
|
|
|
|
|
|
Вещество D образуется в результате реакции k2:
−dydt =−k 2 ( x− y) y=a (1− k 2k−2k 2 e−k1 t + k2k−1k 2 e−k2 t )
Время от начала реакции, когда достигается максимум концентрации промежуточного вещества, можно рассчитать, зная, что производная в этой точке равна 0:
|
|
|
|
|
|
|
ln |
k 2 |
|
|
||
− |
d ( x− y ) |
=0 t |
|
|
= |
k 1 |
|
|||||
|
|
|
|
|||||||||
dt |
max |
k 2−k 1 . |
||||||||||
|
|
|
|
|||||||||
|
( x− y )max=a(kk |
12 ) |
|
k2 |
||||||||
|
k1−k2 |
|
||||||||||
В это же время на кинетической кривой продукта
реакции наблюдается перегиб.
Период индукции — время от начала реакции до того момента, когда становится заметно отличие от нуля скорости реакции. Период индукции можно рассчитать, проведя касательную к кривой вещества D в точке перегиба и найти ее пересечение с осью времени.
Чем больше отношение k2 к k1, тем левее и ниже будет находиться максимум концентрации промежуточного вещества.
Метод квазистационарных концентраций
Метод применяется в том случае, когда в ходе реакции образуются неустойчивые промежуточные вещества. Если скорость распада этих веществ намного превышает скорость их образования, то их концентрация в любой момент времени очень мала. В этом случае скорость образования этих веществ можно принять за ноль. Этот метод позволяет выражать концентрацию промежуточных веществ через концентрации исходных веществ, что значительно упрощает анализ сложных реакций.
Стационарный режим протекания реакции может установиться в открытой системе. При
