
Praktikum-BH-1
.pdfс денатурацией; коагуляция без денатурации; денатурация без коагуляции?
Что такое адсорбционная пептизация?
Как используется в медицине реакция адсорбционной пептизации?
Материал для самоподготовки: I а)1. с.19-74, 662-565. II, III.
РАЗДЕЛ II. ФЕРМЕНТЫ
Занятие № 4
ТЕМА. СТРОЕНИЕ И ОСНОВНЫЕ СВОЙСТВА ФЕРМЕНТОВ
Цель занятия: 1.Повторить материал по физико-химическим свойствам белков.
2.Ознакомиться с современными представлениями о структуре ферментов, изучить их характерные свойства.
Исходный уровень знаний:
-строение и физико-химические свойства белков;
-понятие о катализаторах.
Содержание занятия. I.2. Понятие о катализе.
Химическая природа ферментов. Свойства ферментов.
Строение ферментов (функциональные центры, их строение). Факторы, определяющие активность ферментов.
Витамины как коферменты. Понятие об изоферментах.
Мультимолекулярные ферментные системы.
II.1.Работа № 1.ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА АКТИВНОСТЬ АМИЛАЗЫ СЛЮНЫ
Принцип метода и химизм.
Амилаза слюны ( -1,4-гликозидаза) катализирует гидролиз -1,4-гликозидной связи крахмала и гликогена до дисахарида мальтозы с промежуточным образованием декстринов различного размера. Нерасщепленный крахмал с йодом дает синее ок-
21
рашивание, амилодекстрины - фиолетовое, эритродекстрины - красно-бурое, ахродекстрины и мальтоза - желтое (цвет вод-
ного раствора йода, т.е. окрашивания с йодом не дают). Конечные продукты гидролиза крахмала - мальтоза и глюкоза - имеют свободную альдегидную группу и могут быть обнаружены реакцией Троммера, в основе которой лежит окислительновосстановительная реакция. При нагревании альдегидная группа окисляется до глюконовой кислоты, а медь гидрата окиси меди (голубого цвета) - восстанавливается в гидрат закиси меди (желтого цвета). При дальнейшем нагревании образуется красная закись меди:
 H
H  O
O
C=O + 2CuSO4 + 5NaOН C–O–Na + 2CuOH + 2Na2SO4 + 2H2O 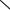 R
R  R
R
Одним из характерных свойств ферментов является термолабильность, т.е. чувствительность фермента к температуре. Для многих ферментов максимальная ферментативная скорость наблюдается при 38-400C. Эта температура называется температурным оптимумом. При нагревании свыше 700С они утрачивают свои свойства биологических катализаторов. Степень инактивирования зависит от длительности теплового воздействия. Замедление и прекращение ферментативной реакции происходит вследствие тепловой денатурации белковой молекулы фермента. При низких температурах ферменты не денатурируются, но скорость реакции резко снижается за счет снижения кинетической энергии молекул. О действии фермента судят по исчезновению субстрата или появлению продуктов реакции.
Порядок выполнения работы:
В чистую пробирку собрать примерно 2 мл нативной (неразведенной) слюны и кипятить в течение 5 минут, охладить.
Реагенты (кап.) |
|
Пробирки |
|
|
1-я |
2-я |
3-я |
||
|
||||
1% раствор крахмала |
10 |
10 |
10 |
|
Нативная слюна, разведенная |
10 |
- |
- |
|
в 10 раз |
|
|
|
|
Прокипяченная неразведенная |
- |
10 |
- |
|
слюна |
|
|
|
|
22 |
|
|
|

Дистиллированная вода |
- |
- |
10 |
Поместить в термостат при 380С на 10 мин. Из содержимого каждой
пробирки отлить по 5 капель в дополнительные пробирки. а) йодная проба (на крахмал)
Реагенты (кап.) |
|
Пробирки |
|
|
1-а |
2-а |
3-а |
||
|
||||
Исследуемый раствор |
5 |
5 |
5 |
|
Раствор йода в йодистом калии |
1 |
1 |
1 |
|
РЕЗУЛЬТАТЫ: |
|
|
|
|
|
|
|
|
|
б) реакция Троммера (на глюкозу и мальтозу) |
|
|||
Реагенты (кап.) |
1-б |
2-б |
3-б |
|
Исследуемый раствор |
5 |
5 |
5 |
|
10% раствор NаОН |
5 |
5 |
5 |
|
1% раствор CuSO4 |
3 |
3 |
3 |
|
РЕЗУЛЬТАТЫ: |
|
|
|
|
|
|
|
|
|
ВЫВОД: |
|
|
|
|
Работа № 2. ВЛИЯНИЕ РЕАКЦИИ СРЕДЫ НА АКТИВНОСТЬ ФЕРМЕНТОВ И ОПРЕДЕЛЕНИЕ ОПТИМУМА рН
Принцип метода и химизм.
Для разных ферментов существует свой оптимум рН среды, когда фермент наиболее активен. Например, оптимум рН пепсина (фермент желудочного сока) - 1,5-2,0; аргиназы (фермент печени) - 9,5. Для амилазы слюны оптимум рН - 6,8- 7.2; в кислой и щелочной среде активность ее снижается за счет взаимодействия белковой молекулы с ионами раствора.
Химизм реакции см. выше (раб. N1). Порядок выполнения работы:
Слюну развести в 10 раз. Взять 5 пробирок и приготовить
23
смеси в соответствии с таблицей (все растворы берутся в каплях).
Реактивы |
|
|
Пробирки |
|
|
|
1 |
2 |
3 |
4 |
5 |
||
|
||||||
раствор 1 |
5 |
5 |
5 |
5 |
5 |
|
раствор 2 |
8 |
6 |
5 |
3 |
1 |
|
1% раствор NaCl |
7 |
9 |
10 |
12 |
14 |
|
рН |
5,8 |
6,9 |
7,4 |
7,9 |
8,5 |
|
0,5% раствор крахмала |
7 |
7 |
7 |
7 |
7 |
|
Слюна разведенная |
7 |
7 |
7 |
7 |
7 |
|
|
Перемешать, поместить в термостат |
|
||||
|
при температуре 380С на 10 минут |
|
||||
раствор йода |
1 |
1 |
1 |
1 |
1 |
|
Окраска |
|
|
|
|
|
|
|
|
|
|
|
|
|
Продукты гидролиза |
|
|
|
|
|
|
крахмала |
|
|
|
|
|
|
|
|
|
|
|
|
|
ВЫВОД: |
|
|
|
|
|
|
Работа № 3. СПЕЦИФИЧНОСТЬ ДЕЙСТВИЯ АМИЛАЗЫ СЛЮНЫ
Принцип метода.
Ферменты обладают специфичностью, т.к. способны катализировать только определённые химические реакции. Специфичность действия ферментов бывает абсолютная, относительная и стереохимическая. Она определяется тем, что только некоторые строго определённые функциональные группы, входящие в состав ферментов, могут участвовать в образовании фермент-субстратных комплексов.
Амилаза слюны ускоряет гидролиз только полисахаридов, не оказывая действия на дисахариды. Мальтаза слюны ускоряет гидролиз образующегося дисахарида мальтозы и не оказывает действия на сахарозу.
24
Химизм реакции см. в работе N 1. Порядок выполнения работы:
Реактивы (кап.) |
1-я пробирка |
|
2-я пробирка |
Слюна, разведенная 1:5 |
5 |
|
5 |
1% раствор крахмала |
10 |
|
- |
1% раствор сахарозы |
- |
|
10 |
Поместить в термостат при температуре 380С на 10 минут |
|||
Реактив Фелинга |
9 |
|
9 |
Нагреть до кипения и кипятить 1 мин |
|
||
РЕЗУЛЬТАТЫ: |
|
|
|
|
|
|
|
ВЫВОД:
III.2. Контрольные вопросы.
Как и почему активность ферментов зависит от температуры?
Что такое температурный оптимум ферментов?
Как и почему активность ферментов зависит от рН среды (график)?
Какие ферменты активны в кислой; нейтральной; щелочной среде?
Что такое специфичность ферментов?
Какие виды специфичности ферментов Вы знаете? Примеры.
Укажите качественную реакцию на крахмал.
Материал для самоподготовки: I а) 1. с.44-49, 114-129, 139-143; II; III.
Занятие № 5
ТЕМА. МЕХАНИЗМ ДЕЙСТВИЯ ФЕРМЕНТОВ, КИНЕТИКА ФЕРМЕНТАТИВНЫХ РЕАКЦИЙ
25
Цель занятия: Ознакомиться с современными представлениями о механизме действия ферментов и кинетике ферментативных реакций.
Исходный уровень знаний:
-белковая природа ферментов;
-структура сложных ферментов;
-строение молекулы фермента;
-кинетика химических реакций. Содержание занятия.
I.2. Современные представления о механизме действия ферментов (гипотеза Фишера, Кошланда).
Полифункциональный катализ.
Кинетика ферментативных реакций. Константа Михаэлиса. Зависимость активности ферментов от различных факторов. Определение активности ферментов: принцип, значение в медицине.
II.1. Работа № 1. АКТИВНОСТЬ - АМИЛАЗЫ СЛЮНЫ. Принцип метода.
Метод основан на определении наименьшего количества амилазы (при максимальном разведении слюны), полностью расщепляющего весь добавленный крахмал. Амилазная активность слюны выражается количеством (в мл) 0,1% раствора крахмала, которое расщепляется 1 мл неразведенной слюны при температуре 380С в течение 30 минут. В норме амилазная активность равна 160 - 320. Амилазная активность обозначается А 380/30'. Этот метод широко используется для определения амилазной активности крови и мочи.
Порядок выполнения работы:
В 10 пробирок налить по 1 мл воды. В 1-ю пробирку добавить 1 мл слюны, разведённой в 10 раз. Содержимое пробирки перемешать несколько раз, втягивая и выпуская жидкость из пипетки. Набрать в пипетку 1,0 мл смеси и перенести её во 2-ю пробирку. Содержимое тоже перемешать и 1,0 мл перенести в 3- ю пробирку и т. д. до 10 пробирки. Из 10-ой пробирки 1,0 мл смеси вылить.
1 мл слюны
1 мл смеси
26

1 мл воды |
|
|
|
|
|
|
|
|
n |
||
|
|
|
|
|
|
|
I |
II |
III |
|
|
|
|
||||
|
|
|
|||
|
|
|
|
|
|
Рис. 3. Разведение слюны
Во все пробирки добавить по 1,0 мл воды и по 2,0 мл 0,1% раствора крахмала, встряхивая, перемешать и поместить в термостат при 380С на 30 минут. После инкубации пробирки охладить водопроводной водой, добавить по 1 капле 0,1% раствора йода и перемешать. Отметить окраску в каждой пробирке и, пользуясь таблицей, сделать расчет.
Расчет: отметить пробирку, где гидролиз крахмала прошел полностью при наименьшем количестве фермента и по количеству неразведённой слюны (А) в данной пробирке рассчитать амилазную активность (Х) следующим образом:
А мл слюны расщепили 2,0 мл 0,1% раствора крахмала. 1 мл слюны расщепил Х мл раствора крахмала.
В 3-й пробирке, например, А =1/80 мл.
|
|
|
|
|
Пробирки |
|
|
|
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
Разведение |
|
|
|
|
|
|
|
|
|
|
слюны |
|
|
|
|
|
|
|
|
|
|
Окраска |
|
|
|
|
|
|
|
|
|
|
р-ра с йодом |
|
|
|
|
|
|
|
|
|
|
ВЫВОД: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
27 |
Работа № 2. АКТИВНОСТЬ АМИЛАЗЫ (ДИАСТАЗЫ) МОЧИ
Принцип метода.
Метод основан на определении времени, необходимого для полного расщепления крахмала в присутствии 1 мл мочи.
Условно за единицу активности амилазы мочи принимают количество фермента, расщепляющего 2 мг крахмала за 15 минут. Активность амилазы выражают количеством единиц в 1 мл мочи. В норме она составляет 1-2 ЕД, а по методу Вольгемута колеблется от 16 до 64 ЕД.
Моча здоровых людей обладает низкой амилазной активностью по сравнению с амилазой слюны. Определение активности -амилазы в моче и сыворотке крови широко используется в клинике при диагностике заболеваний поджелудочной железы. В первые сутки заболевания амилазная активность увеличивается в моче и сыворотке крови в десятки раз, а затем постепенно возвращается к норме. При почечной недостаточности амилаза в моче отсутствует.
В детском возрасте увеличение активности амилазы наблюдается при эндемическом паротите, что указывает на одновременное поражение поджелудочной железы вирусом паротита. Вирус гриппа также поражает поджелудочную железу, но реже.
Порядок выполнения работы.
На сухую чашку Петри капнуть в разных местах по 1 капле 0,1% раствора йода в йодиде калия (всего 8-10 капель). В пробирку внести 2 мл 0,1% раствора крахмала, содержащего 2 мг крахмала, 1 мл 0,85% р-ра хлорида натрия и поместить пробирку в термостат при 370С на 2 минуты. Через 2 минуты добавить в пробирку 0,5 мл мочи, перемешать и отметить время начала реакции. Затем каждые 2-3 минуты переносить каплю смеси из пробирки на чашку Петри в каплю раствора йода до появления желтой (или бесцветной) окраски и отметить время реакции в минутах. Активность амилазы мочи рассчитать по формуле:
28

15
Х =
Т ∙ 0,5
где Х - активность амилазы в 1 мл мочи; 15 - время, необходимое для полного расщепления 2 мг
крахмала в минутах; 0,5 - количество мочи, взятое в реакционную смесь в мл;
Т - время реакции в минутах.
РЕЗУЛЬТАТ:
ВЫВОД:
III.2. Контрольные вопросы.
Какую реакцию катализирует амилаза?
Укажите промежуточные и конечные продукты гидролиза крахмала.
Чему равна в норме диастаза мочи?
При каких заболеваниях повышается активность диастазы мочи (у взрослых и детей)?
Когда в моче отсутствует амилаза?
Напишите формулы витаминов В2 и РР, укажите соответствующие коферменты.
Материал для самоподготовки: Iа) 1. с.129-139, 143-152; II; III
Занятие № 6
ТЕМА. РЕГУЛЯЦИЯ АКТИВНОСТИ ФЕРМЕНТОВ. КЛАССИФИКАЦИЯ, НОМЕНКЛАТУРА И
ПРАКТИЧЕСКОЕ ПРИМЕНЕНИЕ ФЕРМЕНТОВ.
29
Цель занятия: Ознакомиться со способами регуляции ферментов in vivo, принципами количественной характеристики, классификации, номенклатуры ферментов, применением их в медицине.
Исходный уровень знаний:
-строение холоферментов;
-специфичность действия ферментов;
-механизм образования фермент-субстратного комплекса;
-зависимость активности ферментов от различных факторов. Содержание занятия.
I.2. Факторы, регулирующие активность ферментов in vivo. Активирование ферментов, его виды.
Типы ингибирования ферментов. Классы ферментов, примеры. Номенклатура ферментов.
Разделы медицинской энзимологии, примеры. Иммобилизованные ферменты.
Ферменты плазмы крови.
II.1. Работа № 1. ВЛИЯНИЕ АКТИВАТОРОВ И ИНГИБИТОРОВ НА АКТИВНОСТЬ АМИЛАЗЫ СЛЮНЫ
Принцип метода и химизм.
Активаторы стимулируют действие ферментов, но не принимают участия в реакции. Активаторы некоторых ферментов: для амилазы слюны - хлорид натрия; для пепсина - ионы Н+ хлористо-водородной кислоты; для липазы - желчные кислоты; для аденозинтрифосфатазы - Мg++, Mn++.
Ингибиторы тормозят действие ферментов вплоть до полной остановки реакции. Ингибиторами часто являются продукты промежуточных или конечных реакций какого-либо биохимического процесса. Примеры ингибиторов: ДФФ (диизопропилфторфосфат) - для холинэстеразы и трипсина; синильная кислота - для цитохромоксидазы; малоновая кислота - для сукцинатдегидрогеназы; сульфат меди - для амилазы слюны.
Активаторы и ингибиторы изменяют активность фермента, влияя на его активный или аллостерический центр.
Химизм реакции см. в работе № 1 (занятие № 4).
30
