
Теоретические основы теплотехники 1
.pdf
21
|
v v R |
T |
R |
T |
, |
|
|
p |
p |
||||
|
|
|
|
|
||
где R R 8314 |
Дж/(кмоль К) – универсальная газовая постоянная. |
|||||
|
|
|
||||
Уравнения состояния для 1 кмоля и для G кмолей идеального газа |
||||||
имеют следующий вид: |
|
|
|
|
|
|
для 1 кмоля газа |
pv RT ; |
|
|
|||
(31)
(32)
для
G
кмолей газа
|
|
|
|
|
|
||
pV GRT . |
(32а) |
||||||
Эти уравнения называются уравнениями Клапейрона – Менделеева.
Закон Джоуля определяет, что внутренняя энергия идеального газа за-
висит только от температуры
u u( T ) ;
Реальные газы
|
u |
|
|
|
|
|
v |
T |
|
|
0
.
(33)
Отсутствие теоретически обоснованного единого уравнения состояния реального газа привело к выводу большого количества эмпирических и полу-
эмпирических уравнений состояния, справедливых для отдельных газов в ограниченном диапазоне изменения параметров их состояния.
Чем точнее уравнение, тем больше (как правило) оно содержит инди-
видуальных констант. Так, в известном уравнении состояния Ван-дер-Ваальса содержится две константы, а в более точных уравнениях число констант доходит до десяти и более.
В инженерных расчетах часто пользуются уравнением состояния иде-
ального газа с введением в него поправочного коэффициента (z), называемо-
го коэффициентом сжимаемости
22
pv zRT .
(34)
Коэффициент сжимаемости (z) учитывает различие между идеальным и реальными газами (для идеального газа z = 1).
Коэффициент сжимаемости является функцией давления, температуры и зависит от природы газа.
Для обобщения данных по коэффициентам сжимаемости различных газов был использован принцип «соответственных» состояний, сформулиро-
ванный Ван-дер-Ваальсом. Принцип «соответственных» состояний утвер-
ждает, что критическое состояние действительно является одинаковым для всех веществ.
|
|
|
|
|
|
|
|
|
2 |
p |
|
|
|
|
p |
|
|
|
|
|
|
|
|
В критической точке для всех веществ r = 0, |
|
|
|
|
|
0 |
, |
|
0 |
, |
|||||
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
T |
2 |
v |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
v |
|
v |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
p |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
0 |
. Вещества находятся в соответственных состояниях при одина- |
|||||||||||||
|
v |
2 |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
ковом удалении от критической точки.
Степень удаления от критической точки определяется с помощью приведенных параметров:
|
приведенного давления |
|
p |
; |
|
||
p |
|
||||||
|
|
|
|
|
|
||
|
|
|
|
к |
|
|
|
|
приведенной температуры |
|
T |
; |
|||
T |
|||||||
|
|
|
|
|
|
||
|
|
|
|
|
к |
|
|
|
приведенного объема w |
|
v |
. |
|
|
|
v |
|
|
|||||
|
|
|
|
|
|||
|
|
|
к |
|
|
|
|
Уравнение состояния, записанное в виде F ( w, , ) = 0, называется при-
веденным уравнением состояния. Оно не содержит индивидуальных кон-
стант вещества.
Состояния вещества, в которых они имеют одинаковые и называ-
ются соответственными. Зная параметры и по данным рис. 4 определя-
ется коэффициент сжимаемости z.
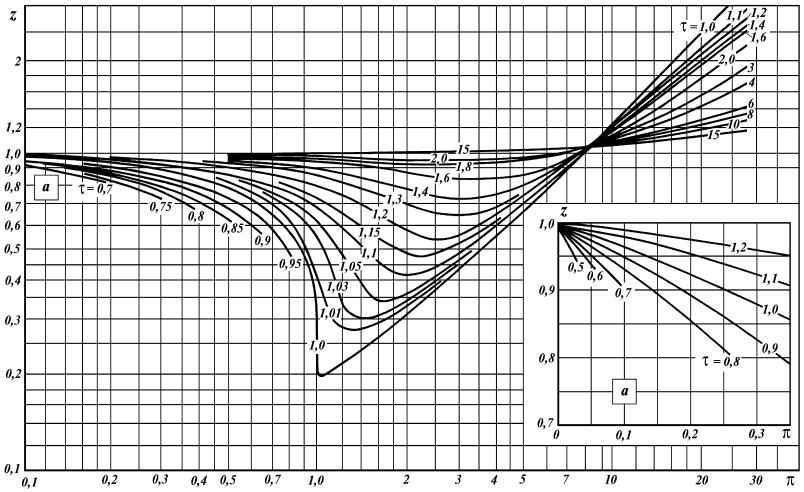
23
Рис. 4. Зависимость коэффициента сжимаемости углеводородных газов от приведенных параметров
24
4. Первое начало термодинамики
Первое начало термодинамики – это количественное выражение закона сохранения и превращения энергии.
Закон сохранения и превращения энергии является универсальным за-
коном природы и применим ко всем явлениям. Он гласит: «запас энергии изолированной системы остается неизменным при любых происходящих в системе процессах; энергия не уничтожается и не создается, а только пе-
реходит из одного вида в другой».
При построении термодинамики принимается, что все возможные энергетические взаимодействия между телами сводятся лишь к передаче теплоты и работы. При этом необходимо отметить, что в отличие от тепло-
обмена, работа как форма энергетического взаимодействия в условиях обра-
тимого течения явлений допускает возможность своего полного превраще-
ния в другие виды энергии.
Первое начало термодинамики как математическое выражение закона сохранения и превращения энергии
В силу того, что теплообмен и передача работы являются единствен-
ными формами передачи энергии, исходное выражение первого начала тер-
модинамики по внешнему балансу теплоты и работы формулируется следу-
|
|
|
ющим образом: «количество теплоты, полученной системой извне ( Q1,2 ), |
||
идет на изменение внутренней энергии системы ( U1,2 |
U2 U1 ) и на вы- |
|
полнение внешней работы ( L1,2 )» |
|
|
|
* |
(35) |
Q1,2 U2 U1 |
L 1,2 , |
|
U1,2 Q1,2 |
L*1,2 . |
(36) |
В дифференциальной форме уравнение (35) может быть представлено следующим образом:
25
|
|
L |
|
* |
= dU + |
* |
. |
Q |
|
(37)
Уравнения (35), (36), (37) являются математическим выражением пер-
вого начала термодинамики по внешнему балансу теплоты и работы.
В термодинамике приняты следущие знаки при определении работы и теплоты в уравнениях первого начала термодинамики: если работа выполняется телом, то она положительная; если работа подводится к телу, то она отрицательная. Если теплота сообщается телу, она имеет положительное
значение; если теплота отводится от тела, она имеет отрицательное значение.
|
L |
|
Работа необратимых потерь |
** |
, связанная с затратами энергии на |
|
преодоление сил трения, удары, завихрения превращается в теплоту внут-
реннего теплообмена ( Q |
|
) |
|
Q**
|
L |
= |
** |
|
.
(38)
Следовательно, полное количество равно сумме теплоты, подведенной извне обмена Q**
теплоты |
Q , полученное телом, |
|
* |
, и теплоты внутреннего тепло- |
|
Q |
||
Q
= Q*
+ Q**
.
(39)
Подставив значение следующие соотношения:
L*
и
Q*
в исходное уравнение (37), получим
Q Q Q dU L ; |
(40) |
Q1,2 Q1*,2 Q1**,2 U 2 U1 L1,2 . |
(41) |
26
Уравнения (40) и (41) называются уравнениями первого начала термо-
динамики по балансу рабочего тела, и справедливы для реальных процессов.
В обратимых процессах |
** |
Q** 0 |
и уравнения первого начала |
L |
термодинамики по внешнему балансу и балансу рабочего тела совпадают.
Первое начало термодинамики для простых тел
Для простых тел, то есть систем, состояние которых определяется дву-
мя независимыми переменными, термодинамическая работа определяется как L p dV и математическое выражение первого начала термодинамики в дифференциальной форме примет следующий вид:
для термодинамической системы
Q dU L dU
pdV
;
(42)
для 1 кг системы
q du l du
pdv
.
(43)
Выражение удельной потенциальной работы можно представить в виде соотношения
w vdp pdv pdv pdv d( pv ) ,
из которого следует, что
w l d( pv ); l w d( pv ).
После подстановки выражения l (45) в уравнение (43), получим:
q du w d( pv ), q d( u pv ) w .
(44)
(45)
(46)
Сумма удельной внутренней энергии (u )
функции ( pv ) называется удельной энтальпией ( h u
ипотенциальной
pv ) (Дж/кг).
27
Поскольку энтальпия определяется с помощью параметров состояния
(u, р, v), то она является функцией состояния, а для простого тела может быть представлена в функции любых двух параметров, например, р и Т. Диффе-
ренциал функции состояния является полным дифференциалом и, следова-
тельно,
|
h |
|
h |
|
|
|
dh |
|
|
dT |
|
dp . |
(47) |
|
||||||
T p |
|
|
|
|
||
|
p T |
|
|
|||
Подобно полной внутренней энергии энтальпия системы является экс-
тенсивным параметром, зависит от количества вещества и определяется по соотношению H h G.
Первое начало термодинамики для 1 кг простого тела по балансу рабо-
чего тела в дифференциальной и интегральной форме можно представить в следующем виде:
* |
** |
du pdv dh vdp ; |
|
||||
q q |
q |
|
|||||
|
q |
|
q |
* q |
|
|
|
|
1,2 |
1,2 |
1,2 |
|
|
|
|
|
|
|
|
2 |
|
2 |
. |
|
u2 |
u1 |
pdv h2 |
h1 vdp |
|
||
|
|
|
|
1 |
|
1 |
|
(48)
(49)
Математическое выражение первого начала термодинамики по внеш-
нему балансу в дифференциальной и интегральной форме имеет следующий вид:
q |
|
* |
|
q1*,2 u2
du l |
* |
dh |
|
u1 l1*,2 h2
w |
; |
* |
|
h1 w1*,2 .
(50)
(51)
28
бота
терь
В реальных процессах эффективная потенциальная (техническая) ра-
w |
|
равна разности обратимой работы |
w |
и работы необратимых по- |
||
|
||||||
w |
|
, которая превращаются в теплоту внутреннего теплообмена q |
|
|||
|
|
|
||||
|
|
|
|
|||
|
** |
|
** |
(52) |
|
|
w |
|
q . |
||
В обратимых процессах |
|
0 |
и поэтому выражение первого начала |
||
w |
|||||
термодинамики по внешнему балансу совпадает с выражением первого нача-
ла термодинамики по балансу рабочего тела.
Аналитическое выражение первого начала термодинамики
Значения удельных внутренней энергии и энтальпии простого тела од-
нозначно определяются двумя независимыми переменными и могут быть представлены следующим образом:
u
h
f ( T ,v );
f ( T , p ) .
(53)
(54)
Изменения внутренней энергии и энтальпии простого тела, как функ-
ций состояния, в элементарных процессах являются полными дифференциа-
лами и определяются соотношениями
|
|
u |
|
|
u |
|
|
|
u |
dv ; |
(55) |
||||
du |
|
|
|
|
dT |
|
dv cvdT |
|
|||||||
|
|
|
|||||||||||||
|
|
T v |
|
v T |
|
|
|
v T |
|
|
|||||
|
|
h |
|
|
|
h |
|
|
|
h |
|
|
|||
dh |
|
|
dT |
|
|
dv c |
|
dT |
|
dp . |
(56) |
||||
|
|
|
|
|
p |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
T p |
|
|
p T |
|
|
|
p T |
|
|
||||
Соотношения (55) и (56) получены, исходя из анализа зависимостей
(19), (48), который показывает, что для изохорного процесса ( v idem) част-
ная производная внутренней энергии по температуре равна истинной изо-

29
хорной теплоемкости
|
u |
, |
(57) |
|
cv |
|
|
||
|
||||
|
T v |
|
||
а для изобарного процесса ( p idem ) частная производная энтальпии по температуре равна истинной изобарной теплоемкости
|
h |
|
|
cp |
|
. |
(58) |
|
|||
|
T p |
|
|
В результате подстановки выражений (55) и (56) в уравнение (48) и
разделения переменных получим:
|
|
u |
|
q c dT |
|
|
|
|
|
|
|
v |
|
v |
|
|
|
||
|
|
|
T |
|
|
|
|
|
|
|
p |
dv c |
|
dT |
dh |
||
|
p |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
dp |
|
|
|
|
|
|
|
T |
|
|
v |
dp |
|
|
.
(59)
Данное соотношение (59) называется первым началом термодинамики для простых тел в аналитической форме.
Выражения в квадратных скобках уравнения (59) в литературе часто называют калорическими коэффициентами, которые могут быть определены по формулам, полученным с использованием дифференциальных соотноше-
ний термодинамики,
|
u |
|
|
|
|
|
|
|
|
|
|
|
p |
|
p c D |
, |
|||||
|
|
|
|
|||||||
|
v |
|
|
|
v |
u |
|
|||
|
T |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
dh |
|
v |
|
( v c |
|
D |
|
|||
|
|
|
|
p |
|
|||||
|
|
|
|
|
|
|
h |
|||
|
|
|
|
|
|
|
|
|
|
|
dp |
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
где Du – коэффициент Джоуля – Гей Люссака,
)
,
(60)
(61)
30
Dh
D |
|
T |
|
|
|
|
|
u |
|
v |
|
|
u |
||
|
|
|
– коэффициент Джоуля-Томсона,
;
(62)
|
T |
|
|
Dh |
. |
(63) |
|
|
|
|
|
|
p |
h |
|
|
|
|
|
Коэффициенты Джоуля – Гей Люссака ( Du ) и Джоуля-Томсона ( Dh )
реальных газов определяются по таблицам термодинамических свойств,
представленным в справочной литературе.
Первое начало термодинамики для идеальных газов. Закон Майера. Энтропия идеального газа
Идеальные газы подчиняются уравнению состояния Клапейрона pv RT и закону Джоуля, согласно которому удельная внутренняя энергия идеального газа зависит только от температуры
u u( T
)
.
(64)
Совместное использование уравнения Клапейрона и закона Джоуля приводит к выводу о том, что удельная энтальпия идеального газа также яв-
ляются функциями только температуры
h u
pv h( T
)
.
(65)
С учетом законов идеальных газов и исходя из соотношений (55), (56),
изменение внутренней энергии 1 кг идеального газа в элементарном и конеч-
ном (1-2) процессах находится по следующим формулам:
du cv dT ; |
u2 u1 cvm T2 T1 , |
(66) |
а изменение энтальпии 1 кг идеального газа в элементарном и конечном (1-2)
