
Теоретические основы теплотехники 1
.pdf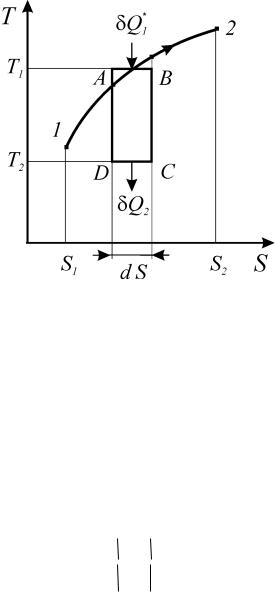
71
Математическое выражение второго начала термодинамики
Наиболее наглядно принцип возрастания энтропии доказывается на ос-
нове изучения круговых процессов тепловых машин.
Рассмотрим реальный процесс 1-2 на диаграмме Т-S (рис. 17).
Рис. 17. К доказательству второго начала термодинамики
Выделим на кривой процесса элементарный участок А-В и к нему доба-
вим три обратимых процесса: адиабату расширения В-С, изотерму отвода теп-
лоты С-D и адиабату сжатия D-А. Полученный цикл А-В-С-D, в целом, необ-
ратим из-за реального процесса 1-2, а следовательно его КПД меньше, чем у цикла Карно
1 |
Q2 |
1 |
T2 |
. |
(182) |
Q* |
|
||||
|
|
T1 |
|
||
|
1 |
|
|
|
|
В выражении (182) справедлив знак неравенства, если рассматриваемый цикл (А-В-С-D) необратим, и знак равенства, если рассматривается обратимый цикл.
После преобразования выражения (182), для любых циклов получаем:

72
Q |
|
T |
|
; |
|
|
|
2 |
2 |
|
|
||
|
|
|
|
|
||
Q |
|
T |
|
|
|
|
|
* |
|
|
|
|
|
|
1 |
|
1 |
|
|
|
Q |
|
Q |
|
|
||
|
|
|
||||
|
|
1 |
; |
|||
|
2 |
|
|
|
||
|
|
|
|
|
|
|
T |
|
|
T |
|
|
|
2 |
|
|
1 |
|
|
|
Q |
|
|
|
|
|
|
* |
|
Q |
|
|
|
|
1 |
|
0 . |
||||
|
|
2 |
||||
|
|
|
|
|
|
|
T |
|
T |
|
|
|
|
1 |
|
|
2 |
|
|
|
(183)
(184)
(185)
Учитывая то, что количество теплоты, подведенной к рабочему телу
извне, имеет положительный знак ( Q1* Q1* ), а |
количество теплоты, |
отведенной от рабочего тела – отрицательно |
( Q2 Q2 ), из |
выражения (185) получаем следующее неравенство |
|
Q |
|
Q |
|
* |
|
|
|
1 |
2 |
||
|
T |
T |
1 |
2 |
0
.
(186)
Для рабочего тела в обратимом процессе CD согласно II началу термо-
статики
Q2 T2
dS2
.
(187)
Согласно условию замыкания кругового процесса (A-B-C-D-A), инте-
гральное изменение любой функции состояния рабочего тела равно нулю, а,
так как энтропия изменяется только в процессах A-B и C-D, это условие можно представить следующим образом:
dS dS1 dS2 0 . |
(188) |
Выражение (186) с учетом соотношений (187), (188) приобретает

73
следующий вид:
Q |
|
|
|
|
|
* |
dS |
|
|
||
1 |
|
||||
|
|
|
|
|
|
T |
|
|
|
1 |
|
|
|
|
|
|
|
1 |
|
|
|
|
|
или |
|
|
|
|
|
|
|
|
Q |
||
dS |
|
|
|
|
* |
|
|
|
1 |
||
|
|
|
|
|
|
|
1 |
|
T |
||
|
|
|
|||
|
|
|
|
|
1 |
0
.
(189)
(189а)
Вследствие того, что при выводе рассматривался произвольный про-
цесс и не было ограничений на свойства рабочего тела, результаты вывода
(выражение 189а) имеют самый общий характер.
Итоговое математическое выражение второго начала термодинамики в дифференциальной и интегральной формах, как принципа возрастания энтропии изолированных систем имеет следующий вид:
dS
S |
1,2 |
S |
|
|
|
Q |
|
|
|
|
* |
|
|
T |
; |
|
|
|
|
|
|
|
|
Q |
|
|
2 |
* |
2 S1 |
|
T |
|
|
|
1 |
|
|
|
|
|
.
(190)
(191)
Знак неравенства в выражениях (190), (191) справедлив в случае, когда в системе происходят реальные необратимые процессы, а равенства – при протекании обратимых процессов.
Если совместить математические выражения второго начала термоста-
тики (162) и второго начала термодинамики (190) то получается следующее соотношение:
dS |
Q |
|
Q* Q** |
|
Q |
, |
(192) |
|
T |
|
T |
|
T |
|
|
из которого вытекает следующее утверждение:
74
|
Q |
|
|
** |
|
dS** = |
T |
> 0, |
|
|
(193)
а при условии, что абсолютная температура всегда положительна (T > 0),
непосредственно следует принцип необратимости внутреннего теплообмена
Q |
|
|
0
.
(194)
Данное неравенство (194) свидетельствует о том, что внутренний теп-
лообмен Q** в реальных процессах имеет только положительный знак, т.е.
работа и количество теплоты в действительных процессах всегда меньше ра-
боты и теплоты в обратимом процессе. Затраты работы на необратимые по-
тери в реальных процессах, равные количеству теплоты внутреннего тепло-
обмена L Q , однозначно способствуют росту энтропии. |
|
||
Для изолированной |
системы, у которой отсутствует |
теплообмен с |
|
окружающей средой ( Q |
|
0 ), неравенства (190), (191) принимают вид |
|
|
|||
|
|
dSизол 0, S2 S2 . |
(195) |
Анализ выражения (195) наглядно показывает, что какие бы процессы не протекали в изолированной системе, ее энтропия не может уменьшаться.
При протекании в изолированной системе необратимых процессов энтропия системы возрастает; если же в ней протекают обратимые процессы, то эн-
тропия системы остается неизменной.
Из анализа математического выражения второго начала термодинамики
(191) следует, что в том случае, когда в изолированной системе протекают самопроизвольные процессы, сопровождающиеся выравниванием темпера-
туры различных ее частей, энтропия системы увеличивается. Отсюда следу-
ет, что энтропия является величиной, определяющей близость изолирован-
75
ной системы к состоянию равновесия.
Все реальные процессы, происходящие в природе, необратимы и со-
провождаются частичным переходом различных видов энергии в теплоту,
которая рассеивается в пространстве. Обратный же переход теплоты в дру-
гие виды энергии возможен только при наличии разности температур.
Р. Клаузиус ввел энтропию как меру «деградации» энергии. Направленность протекания процессов во Вселенной, по версии Клаузиуса, должна привести к тепловому равновесию, из которого Вселенная выйти самостоятельно не может. Состояние Вселенной, при котором в ней устанавливается тепловое
равновесие, было названо состоянием «тепловой смерти Вселенной».
Следует отметить, что свои выводы Р. Клаузиус сделал, рассматривая Вселенную как изолированную систему. Современная наука опровергает это предположение. Кроме того, математическое выражение второго начала термодинамики и разнообразие процессов, протекающих во Вселенной, не исключают возможности существования процессов, имеющих отрицатель-
ный знак внутреннего теплообмена ( Q |
|
0 ). Эти обстоятельства подвер- |
|
гают сомнению правомерность теории Р. Клаузиуса о «тепловой смерти Все-
ленной».
8. Смеси жидкостей, паров и газов
Общие соотношения
Термодинамическая система – объект исследования термодинамики,
может представлять собой смесь химически не взаимодействующих между собой чистых веществ. Предполагается также, что структура отдельных ком-
понентов смеси в процессе смесеобразования и стабилизации смеси не изме-
няется.
Из закона сохранения материи следует, что масса смеси G равна сумме масс составляющих ее компонентов Gi

76
n G Gi , i 1
(196)
а число киломолей смеси G равно сумме числа киломолей всех компонентов
смеси Gi
n |
|
G G i , |
(197) |
i 1 |
|
где n – число компонентов в смеси.
Одной из важнейших характеристик смеси является ее состав. Он зада-
ется массовыми или молярными концентрациями (долями) компонентов.
Массовой концентрацией или массовой долей mi называется отноше-
ние массы компонента к массе всей смеси
m |
G |
|
G |
|
i |
|
i |
||
|
|
|
||
|
G |
|
n |
|
|
|
|
i |
|
|
|
|
|
G |
|
|
|
i 1 |
|
.
(198)
Молярной концентрацией или молярной долей i-го компонента
ri
называется отношение количества киломолей этого компонента |
G |
i |
||||||
|
|
|
|
|
|
|
|
|
числу киломолей смеси |
|
|
|
|
|
|
|
|
ri |
G |
i |
|
G |
i |
. |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
||
|
G |
|
n |
|
|
|
|
|
|
|
G i |
|
|
|
|||
|
|
|
|
|
|
|
||
|
|
|
|
i 1 |
|
|
|
|
к общему
(199)
Очевидно, что для термодинамических смесей справедливы следующие соотношения:
n |
n |
|
mi 1 , |
ri 1 . |
(200) |
i 1 |
i 1 |
|

77 |
|
Средняя (кажущаяся) молярная масса смеси m |
равна отношению мас- |
сы смеси к количеству киломолей смеси и может быть определена из следу-
ющих соотношений:
|
|
|
|
|
n |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
G |
|
Gi |
|
|
n |
|
|
G |
i |
|
n |
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
m |
|
i |
= |
i 1 |
|
= |
|
|
i |
|
= ri i ; |
|
|
|
||||||||
|
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
Gi |
|
G |
|
|
i 1 |
|
|
G |
|
|
i 1 |
|
|
|
|
|
|||
|
G |
|
|
G |
|
|
G |
|
|
|
|
|
1 |
|
|
|
1 |
|
|
|||
m |
i |
= |
|
|
= |
|
|
|
|
|
= n |
|
|
|
|
= |
|
|
|
. |
||
G |
i |
n |
|
n |
|
G |
|
|
G |
|
n |
m |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
Gi |
|
|
|
i |
|
|
|
i |
|
|
|
|
i |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
G |
|
|
|
|
|
|
|
|
|
|
|
|
i 1 |
|
|
i 1 |
i |
|
|
i 1 |
i |
|
i 1 |
i |
|
||||||
|
|
|
|
|
|
|
|
|
i |
|
|
|
|
|||||||||
(201)
(202)
Зависимость между массовой и молярной концентрациями устанавли-
вается соотношением
m |
G |
|
i |
||
|
||
i |
G |
|
|
или
= |
|
i |
Gi |
||||
|
|
|
|
|
|
||
|
|
|
G |
||||
|
m |
||||||
|
|
|
|
|
|
||
m |
|
|
|
. |
|||
i |
|
|
|
i |
|||
|
|
|
|
|
|
||
r |
|
|
|
m |
|
||
i |
|
|
|
|
|
||
= ri im
(203)
(204)
Газовая постоянная смеси |
R |
выражению:
|
|
R |
|
n |
|
|
m |
|
= |
|
i |
||
|
||||||
R |
|
|
m |
|||
|
|
|
i 1 |
|
||
|
|
|
|
|
m может быть вычислена по следующему |
|||||||||
|
|
|
|
|
|
|
|
|
|
R |
R |
= |
1 |
|
, |
(205) |
|||
|
|
|
|
|
|
||||
i |
n |
|
n r |
|
|
|
|||
|
|
|
|
|
|||||
|
ri i |
|
|
i |
|
|
|
||
|
|
|
|
|
|
||||
|
i 1 |
|
i 1 Ri |
|
|
|
|||
где R =8314 Дж/(кмоль К) – универсальная газовая постоянная, Ri – характе-
ристическая газовая постоянная компонента смеси.
Для жидких, твердых и газообразных смесей часто используется и по-
нятие объемной концентрации компонентов. Объемной концентрацией i-го компонента vi называется отношение объема данного компонента Vi к объе-
78
му всей смеси V
v |
Vi |
. |
(206) |
|
|||
i |
V |
|
|
|
|
||
Схемы смешения
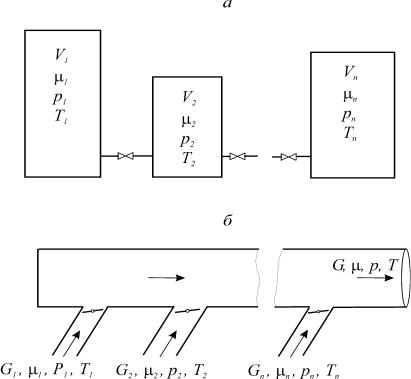
При образовании смесей на практике встречаются две основные схемы смешения: при постоянном объеме (V = idem, рис. 18а) и постоянном давле-
нии (p = idem, рис. 18б).
Рис. 18. Схемы смешения при постоянном объеме (а) и при постоянном давлении (б)
При расчете и анализе схемы смешения при постоянном объеме рас-
сматривается система, включающая ряд резервуаров, соединенных трубопро-
водами с установленными на них кранами (рис. 18а). В каждом резервуаре объемом Vi находится один компонент с известными исходными параметрами (Gi , i , pi , Ti ). После открытия кранов во всех резервуарах происходит выравнивание давления pm, а затем температуры Tm и концентра-
79
ции компонентов (mi, ri) – система переходит в состояние термодинамическо-
го равновесия. Во всех стадиях процесса смешения полный объем системы
сохраняет неизменную величину V =
n Vi i 1
.
В процессе смешения по схеме с постоянным объемом теплота извне не
подводится ( Q |
|
0 ) и внешняя работа не совершается ( |
|
0 |
) и, следова- |
|
L |
||||
|
|
|
тельно, исходя из первого начала термодинамики по внешнему балансу (35),
получаем, что этот процесс смешения идет без изменения внутренней энер-
гии
U1,2 U2 U1 0
(
U
idem
).
(207)
Смесеобразование при постоянном давлении происходит в трубопро-
водах (рис. 18б). К общему трубопроводу отдельными потоками подводятся компоненты. Для каждого компонента известны: массовый расход Gi , мо-
лярная масса i , давление pi и температура Ti . Смесеобразование в трубо-
проводе возможно лишь в случае, когда давление каждого компонента pi
больше среднего давления смеси в трубопроводе pm . При прохождении за-
порного устройства давление компонента уменьшается до среднего давления
смеси |
pm – отсюда наименование схемы ( p idem ). |
|
|
|
Заключительные стадии процесса смешения при |
p idem |
– выравни- |
вание температур, концентраций компонентов в смеси (диффузионные про-
цессы) и переход системы в состояние термодинамического равновесия.
В процессе смешения при |
p idem |
теплота извне не подводится |
( Q 0 ) и внешняя работа не совершается ( W 0 ) и, следовательно, ис-
ходя из первого начала термодинамики по внешнему балансу для потока (81),
получаем, что этот процесс смешения идет без изменения энтальпии
H1,2 H2 H1 0 ( H idem). (208)

80
Смеси идеальных газов
Смеси идеальных газов являются также идеальными газами и подчи-
няются уравнению состояния идеальных газов (уравнению Клапейрона)
pmV G Rm Tm G R Tm , |
(209) |
где pm , Tm – давление и температура смеси.
Средняя температура и среднее давление смеси характеризуют конеч-
ное состояние диффузионного равновесия смеси.
Состояние компонентов смеси в процессе перемешивания непрерывно изменяется, начиная с момента первичного выравнивания давлений компо-
нентов и кончая состоянием диффузионного равновесия, когда давление каждого из компонентов снижается до уровня стабильного парциального давления p i .
Закон диффузионного равновесия смеси идеальных газов (закон Даль-
тона) характеризует установившееся состояние газовой смеси и формулиру-
ется следующим образом: каждый компонент смеси ведет себя в газовой смеси так, как будто он один при температуре смеси Tm равномерно распро-
странен во всем объеме смеси V и развивает при этом давление, которое называется парциальным p i .
Уравнения состояния для i-го компонента и всей смеси идеальных га-
зов могут быть представлены в следующем виде:
p iV
pmV
= |
G |
|
|
G |
|
i RT RTm
;
.
(210)
(211)
При делении уравнения (210) на уравнение (211) получаем
