
Теоретические основы теплотехники 1
.pdf
31
процессах определяется по следующим зависимостям:
dh cp dT ; |
h2 h1 cpm ( T2 T1 ) . |
(67)
После подстановки соотношений (66) и (67) в выражение первого нача-
ла термодинамики для простых тел (48), (49) получаем уравнение первого начала термодинамики для идеального газа по балансу рабочего тела в диф-
ференциальной и интегральной формах:
q
q1,2
q q cv dT
cvm T2 T1 l1,2
pdv
cpm
cp
T2
dT vdp ;
T1 w1,2 ..
(68)
(69)
Из уравнения первого начала термодинамики для идеального газа (68)
можно получить следующее выражение:
( c |
p |
c |
) dT |
|
v |
|
pdv vdp d(
pv ) RdT
,
(70)
из которого следует, что разность истинных теплоемкостей идеального газа при постоянном давлении и при постоянном объеме равна величине характе-
ристической газовой постоянной
c |
p |
c |
|
v |
R
.
(71)
Это выражение (71) впервые было получено Р. Майером (1842 г.) и
называется законом Майера.
Уравнение (71) может быть записано и для одного кмоля газа
c |
p |
c |
|
v |
( cp
cv
) R
R
.
(72)
Разделив уравнение (68) на абсолютную температуру T, получим

32
|
q |
c |
|
dT |
|
p |
dv c |
|
||||||||
|
T |
v |
T |
T |
|
p |
||||||||||
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
С учетом того, что для идеального |
||||||||||||||||
пейрона, справедливы равенства: |
|
p |
|
R |
; |
v |
||||||||||
T |
v |
T |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||
q |
c |
( T ) |
dT |
R |
dv |
c |
||||||||||
|
|
|
|
|||||||||||||
T |
|
v |
|
|
|
T |
|
|
|
|
|
v |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
dT |
|
v |
dp . |
(73) |
|
T |
T |
||||
|
|
|
газа, исходя из уравнения Кла-
|
R |
получим |
|
|
||||
p |
|
|
||||||
|
|
|
|
|
|
|
||
p ( T ) |
dT |
R |
dp |
. |
(74) |
|||
T |
p |
|||||||
|
|
|
|
|
|
|||
Правая часть уравнения (74) представляет собой сумму полных диффе-
ренциалов. Это значит, что и соотношение q / T есть полный дифференциал некоторой функции состояния идеального газа (s), называемой удельной эн-
тропией.
Изменение удельной энтропии в элементарном процессе представляет собой полный дифференциал и определяется соотношением
|
q |
|
q |
* |
q |
** |
|
|
|
|
|
||
ds |
T |
|
|
|
T |
|
|
|
|
|
|
.
(75)
Из уравнения (74) после интегрирования получим, что изменение удельной энтропии идеального газа в процессе (1-2) может быть найдено из соотношения
s |
|
s |
c |
|
ln |
T |
R ln |
v |
|
2 |
mv |
2 |
|
2 |
|||||
|
1 |
|
|
T |
|
v |
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
1 |
|
|
1 |
=
|
|
|
T |
|
|
c |
|
ln |
2 |
R ln |
|
mp |
T |
||||
|
|
|
|||
|
|
|
|
||
|
|
|
1 |
|
p1 p2
.
(76)
Теплоемкости c
ми и находятся путем
mp и cmv называются вторыми средними теплоемкостя-
осреднения по логарифму абсолютных температур
|
|
1 |
|
2 |
|
|
|
cmz |
|
|
|
cz d ln T . |
(77) |
||
|
|
||||||
ln T |
ln T |
||||||
|
|
|
|
||||
2 |
1 |
|
1 |
|
|
||
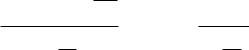
33
Если принять,
температуры cz az
что
bz
истинная теплоемкость является линейной функцией
T , то
|
|
2 |
|
|
|
|
dT |
|
|
|
a |
z |
|
z |
|
|
|
|
|
||||
|
|
|
|
b T |
T |
||
c |
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
mz |
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ln |
2 |
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
a |
|
b |
|
T |
T |
|
z |
2 |
|
1 |
|||
|
z |
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
ln |
2 |
|
|
|
|
|
T |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
a |
z |
b |
|
z |
Tmz
.
(78)
Таким образом, первая средняя теплоемкость равна истинной теплоем-
кости при средней арифметической температуре процесса (Tma ), а вторая – при средней логарифмической температуре процесса (Tmz). В случае, если bz 0 , то первая средняя теплоемкость численно несколько больше второй.
5. Процессы изменения состояния термодинамических систем
Классификация термодинамических процессов
Термодинамический процесс может быть задан либо графическим спо-
собом в виде изображения процесса в координатах p-v, p-T, Т-s, либо в ана-
литической форме в виде зависимости ( p,v ) 0 .
Уравнение процесса может быть также задано исходным условием о неизменном значении в этом процессе какой - либо функции состояния
( z idem; z p,v,t ,u,h,s ) или условием о равенстве нулю какого – либо эф-
фекта термодинамического процесса q 0 , однако и в этом случае исход-
ное условие приводится к основной форме уравнения процесса.
При изучении термодинамических процессов определяются:
1)закономерность изменения параметров состояния рабочего тела, то есть выводится уравнение процесса или дается его графическое изображение
вкоординатах p-v, p-T, Т-s и т.д.;
2)параметры состояния системы в начальной и конечной точках про-
цесса;

34
3)численные значения работы и теплообмена в процессе;
4)изменение значений внутренней энергии, энтальпии и энтропии ра-
бочего тела.
Простейшие термодинамические процессы
Простейшими термодинамическими процессами обычно считают изо-
барный, изохорный и изопотенциальные процессы.
Изобарный процесс ( p idem; dp 0 ) – процесс в котором давление в системе остается постоянным.
Изобарный процесс (или изобара) графически представлен на рис. 5.
В изобарных процессах происходит увеличение (1-2) или уменьшение
(1-3) удельного объема, что связано изменением температуры, обусловлен-
ным подводом или отводом теплоты.
Изобарные процессы подвода или отвода теплоты происходят в порш-
невых двигателях внутреннего сгорания, газотурбинных, паросиловых, холо-
дильных установках и др.
Для идеального газа в изобарном процессе (1-2) значение удельного
|
|
T |
|
|
объема прямо пропорционально температуре рабочего тела |
2 |
|
||
T |
||||
|
|
|
||
|
|
1 |
|
|
Удельная термодинамическая и потенциальная работы |
||||
процессе определяются из соотношений |
|
|
|
|
2 |
|
|
|
|
l1,2 p dv p v2 v1 |
, |
|
|
|
1 |
|
|
|
|
2 |
|
|
|
|
w1,2 v dp 0 . |
|
|
|
|
1 |
|
|
|
|
v |
|
|
2 |
. |
|
v |
||
|
||
1 |
|
в изобарном
(79)
(80)
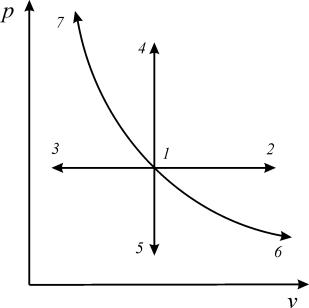
35
Рис. 5. Простейшие термодинамические процессы:
1-2, 1-3 – изобары; 1-4, 1-5 – изохоры; 1-6, 1-7 – изопотенциальные процессы
Количество теплоты, подведенной к рабочему телу или отведенной от него в изобарном процессе, определяется из выражения первого начала тер-
модинамики
q1,2 u1,2 l1,2 h1,2 . |
(81) |
Изохорный процесс ( v idem; dv 0 ) – процесс, при котором объем си-
стемы или удельный объем рабочего тела остается постоянным (рис. 5).
В изохорных процессах происходит увеличение (1-4) или уменьшение
(1-5) давления, что связано с соответственным изменением температуры – подводом или отводом теплоты.
Изохорные процессы подвода или отвода теплоты происходят в порш-
невых двигателях внутреннего сгорания, газотурбинных, паросиловых уста-
новках и др.
Для идеального газа в изохорном процессе (1-4) давление прямо про-

36 |
|
|
|
|
|
|
|
T |
|
p |
4 |
|
|
порционально температуре рабочего тела |
4 |
|
|
. |
||
T |
p |
|||||
|
|
|
||||
|
1 |
|
|
1 |
|
|
Удельная термодинамическая и потенциальная работы в изохорном процессе определяются из соотношений
w1,4
|
|
4 |
l1,4 |
p |
|
|
|
1 |
|
4 |
vdp |
|
||
1 |
|
|
dv
v
0 |
, |
p |
|
1 |
|
p4
.
(82)
(83)
Количество теплоты, подведенной к рабочему телу или отведенной от него в изохорном процессе, определяется из выражения первого начала тер-
модинамики
q |
h |
w |
1,2 |
1,2 |
1,2 |
u1,2
.
(84)
Изопотенциальный процесс – термодинамический процесс изменения
состояния |
системы, |
при |
котором |
значение |
потенциальной |
функции |
( П pv idem; d( pv ) 0 ) сохраняет неизменное значение |
||||
(процессы 1-6, 1-7) (рис. 5).
Для идеального газа, согласно уравнению Клапейрона ( pv RT ), изо-
потенциальный процесс ( pv idem ) является и изотермическим (T idem).
Удельная термодинамическая и потенциальная работы в изопотенци-
альном процессе (1-6) определяются из следующих соотношений:
|
|
6 |
|
6 |
|
dv |
|
|
|
|
v6 |
|
|
|
|
||
|
|
l1,6 p dv = pv |
= pv ln |
; |
|
|
(85) |
||||||||||
|
|
|
|
|
|
||||||||||||
|
|
1 |
|
|
1 |
|
v |
|
|
|
|
v1 |
|
|
|
||
|
6 |
|
6 |
|
|
dp |
|
|
|
1 |
dp |
|
|
|
p |
|
|
|
|
|
|
|
|
p |
|
|
|
|
p |
|
|
|
p |
|
|
w |
|
v dp = |
|
vp |
|
|
= pv |
|
|
= pv ln |
1 |
. |
(86) |
||||
1,6 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
1 |
|
|
|
|
|
|
6 |
|
|
|
|
6 |
|
|

37
(
pv
Нетрудно заметить, что постоянство потенциальной функции idem ) приводит к равенству логарифмов в выражениях (85) и (86) в си-
лу того, что соблюдается условие
p1 p6
v6 v1
. Поэтому, в изопотенциальном
процессе численные значения термодинамической и потенциальной работ равны между собой.
Количество теплоты, подведенной к рабочему телу или отведенной от него в изопотенциальном процессе определяется из выражения первого нача-
ла термодинамики по балансу рабочего тела
q |
u |
l |
h |
1,2 |
1,2 |
1,2 |
1,2 |
w1,2
.
(87)
Уравнения перечисленных простейших и любых других термодинами-
ческих процессов могут быть представлены одним уравнением. Это уравне-
ние называется уравнением политропы, а термодинамические процессы, опи-
сываемые этим уравнением, называются политропными.
Политропные процессы
Термин «политропа» представляет собой сочетание двух греческих слов «поли» - много и «тропос» - путь, направление. Поэтому в политропном процессе предполагается многообразие путей изменения параметров состоя-
ния системы.
Политропным процессом с постоянным показателем называется обра-
тимый термодинамический процесс изменения состояния простого тела, под-
чиняющийся уравнению, которое может быть представлено в следующих формах:
pvn idem C ; |
(88) |
p1 / n v idem C ; |
(89) |
1 |
|

38
n |
n |
p1v1 |
= p2v2 . |
(90)
где п – показатель политропы, являющий в рассматриваемом процессе по-
стоянной величиной, которая может иметь любые частные значения - поло-
жительные и отрицательные (- n + ).
Физический смысл показателя политропы п определяется после диф-
ференцирования выражения (88)
v |
n |
dp n v |
n 1 |
pdv 0 . |
|
|
Из соотношения непосредственно следует
n |
vdp |
|
w |
|
w |
. |
|
|
1,2 |
||||
|
|
|
|
|
|
|
|
pdv |
|
l |
|
l |
|
|
|
|
|
|
1,2 |
|
(91)
(92)
Это значит, что постоянный показатель политропы определяется со-
отношением потенциальной и термодинамической работ в элементарном или конечном процессах. Значения этих работ могут быть определены графиче-
ски в координатах p v (рис. 6а).
В логарифмических координатах политропный процесс (политропа) с
постоянным показателем представляет собой прямую линию (рис. 6б)
log
p n log
v
log
C
.
(93)
При этом, постоянный показатель политропы определяется как тангенс угла наклона линии процесса к оси абсцисс ( ) (рис. 6б)
n =
log p |
1 |
log p |
2 |
|
|
||
log v |
2 |
log v |
|
|
1 |
||
=log( p1 / p2 ) . log( v2 / v1 )
(94)
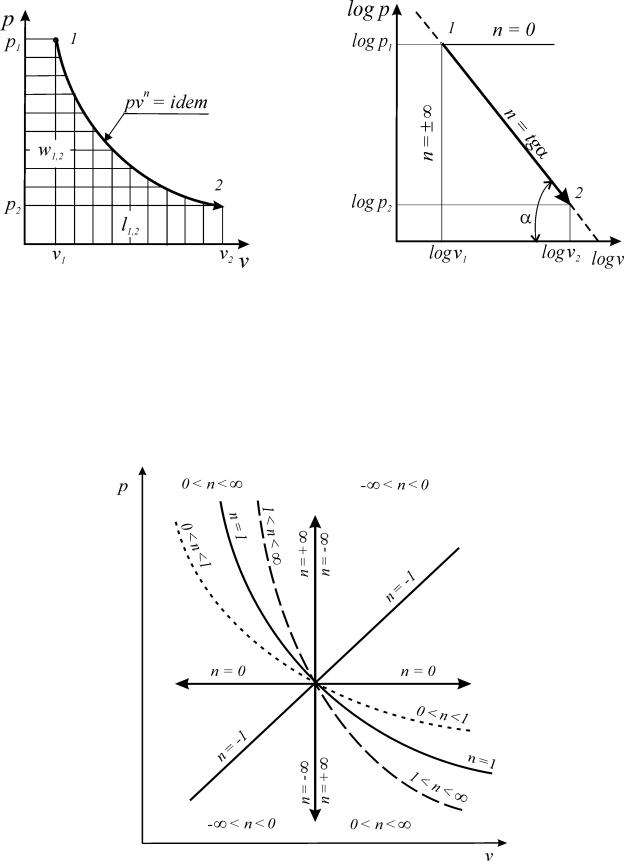
39
а |
б |
Рис. 6. Политропа с постоянным показателем
Из соотношения (92) следует, что для изобарного процесса n = 0,
для изохорного процесса - n = ± ∞, для изопотенциального процесса - n = 1 (рис. 7).
Рис. 7. Политропные процессы изменения состояния простого тела
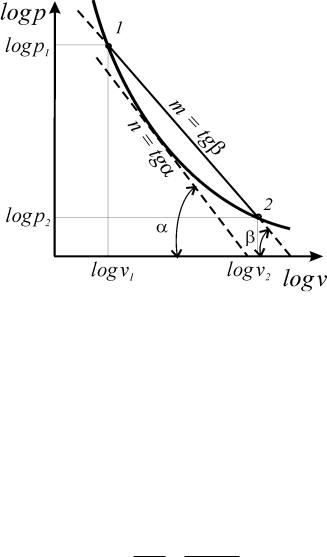
40
Следует отметить, что не все термодинамические процессы в коорди-
натах logv – logp описываются прямой линией, т.е. подчиняются уравнению политропы с постоянным показателем. Любой термодинамический процесс можно описать уравнением политропы с переменным показателем (рис. 8).
Расчет политропного процесса с переменным показателем вызывает необходимость ввести в рассмотрение три показателя процесса: истинный показатель процесса (n); первый средний показатель n и второй средний показатель (m).
Рис. 8. Политропа с переменным показателем
Истинный показатель процесса (n) определяется как соотношение эле-
ментарной потенциальной работы w к элементарной термодинамической работе l , что соответствует тангенсу угла наклона касательной, проведен-
ной к кривой процесса в точке процесса, к оси абсцисс ( ) в логарифмиче-
ской сетке координат
n =
w |
|
vdp |
|
|
l |
pdv |
|||
|
|
d log p d log v
= tg .
(95)
Для конкретных процессов, характеризующихся неизменным значени-
