
Теоретические основы теплотехники 1
.pdf
41
ем какой-либо функции или параметра состояния (z = p,v,T, u, h, s), истинный показатель политропы определяется соотношением
nz
v p
pv z
.
(96)
Первый средний показатель политропы определяется как отношение конечных (интегральных) значений потенциальной и термодинамической ра-
бот в процессе
|
w |
|
|
|
n |
1,2 |
. |
(97) |
|
l |
||||
|
|
|
||
|
1,2 |
|
|
Второй средний показатель политропы численно равен тангенсу угла наклона секущей 1-2 к оси абсцисс ( ) в логарифмической сетке
координат (рис. 8)
|
log p |
1 |
log p |
2 |
|
log( p |
|
/ p |
2 |
) |
|
|
m = |
|
|
= |
1 |
|
|
. |
(98) |
||||
log v |
|
log v |
|
log( v |
|
/ v |
|
) |
||||
|
2 |
|
|
2 |
|
|
|
|||||
|
|
1 |
|
|
1 |
|
|
|
||||
Непосредственно из последнего выражения (98) следует уравнение по-
литропы с переменным показателем
|
|
|
|
|
|
m |
|
|
|
1 |
|
|
|
p |
|
v |
|
|
|
p |
|
m |
|
v |
|
||
2 |
2 |
|
|
|
1 |
||||||||
|
|
|
|
|
|
|
2 |
|
2 |
||||
p |
|
v |
|
|
|
p |
|
|
v |
|
|||
|
|
|
|
|
|
|
|||||||
|
1 |
|
1 |
|
|
1 |
|
1 |
|
||||
.
(99)
При проведении инженерных расчетов в ряде случаев политропные процессы с переменным показателем политропы приближенно описываются уравнением политропы с постоянным показателем (88), значение которого принимается равным первому среднему показателю политропы ( n n ).

42
Работа в политропных процессах простых тел
Выражения конечных (интегральных) величин термодинамической и потенциальных работ в политропных процессах можно получить при сопо-
ставлении их элементарных значений:
l pdv, w vdp ;
l w pdv vdp d pv .
(100)
(101)
После подстановки выражения для показателя политропы (92) в соот-
ношение (101) получаем
l w
или
l
1
1
1
n l
d n
pv
d
.
pv
,
(102)
(103)
Интегрируя последнее выражение (103) с учетом того, что процесс подчиняется уравнению политропы с постоянным показателем (n=idem), по-
лучаем следующее соотношение для определения удельной термодинамиче-
ской работы в конечном процессе (1-2)
|
2 |
1 |
|
1 |
|
|
|
2 |
|
|
|
1 |
|
|
|
|
|
|
l |
|
d( pv ) |
|
|
|
|
d( pv ) |
( p |
v |
|
p v ) . |
(104) |
||||||
|
|
|
|
|
2 |
|||||||||||||
1,2 |
1 n |
1 n |
|
|
|
|
1 n |
2 |
|
1 |
1 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
1 |
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
Введем понятие характеристики процесса расширения или сжатия, |
||||||||||||||||||
определяемой соотношением |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
p2v2 |
. |
|
|
|
|
|
|
(105) |
|
|
|
|
|
1,2 |
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
p1v1 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||

43
С учетом соотношений (92), (105), зависимости для определения удельной термодинамической и потенциальной работы в конечном процессе примут следующий вид:
l |
|
1,2 |
|
w1,2 n l1,2
p v |
|
||
1 |
1 |
||
|
|||
n 1 |
|
||
|
n |
||
|
n |
||
1 1,2
1 p1v1
;
1 1,2 .
(106)
(107)
Соотношение для определения характеристики расширения или сжатия в рассматриваемом процессе 1,2 определяется с учетом зависимостей (89),
(90) и имеет следующий вид:
|
|
|
p v |
|
|
|
2 |
|
2 |
||
|
|
|
|
||
|
1,2 |
|
p v |
|
|
|
|
|
|
||
|
|
|
1 |
1 |
|
|
p |
2 |
|
|
|
|
|
||
= |
|
|
|
|
|
p |
|||
|
|
|||
|
1 |
|||
n 1 n
v |
|
|
1 |
= |
|
|
|
v2 |
|
n 1
.
(108)
Теплообмен в термодинамических процессах простых тел
Теплообмен в любом термодинамическом процессе изменения состоя-
ния простых тел может быть выражен в зависимости от величины термоди-
намической или потенциальной работы процесса. При этом термодинамиче-
ский процесс в общем случае рассматривается как политропа с переменным показателем.
Расчетное выражения теплообмена для простых тел выводится на ос-
нове рассмотрения выражения первого начала термодинамики
q du l.
(109)
Удельная внутренняя энергия для простых тел может быть представле-
на в виде функции любых двух независимых параметров состояния. Примем,

44
что u =и (p, v). Тогда дифференциал внутренней энергии запишется в следу-
ющем виде:
|
u |
dv |
|
|
u |
dp . |
du |
|
|
|
|||
dv p |
|
|
|
|
|
|
|
|
dp v |
|
|||
Последнее выражение (110) можно представить в виде
du |
1 |
|
u |
pdv |
|
1 |
|
u |
vdp . |
|
|
|
|
|
|
||||
|
p |
dv p |
|
|
|
|
|
|
|
|
|
|
v |
dp v |
|
||||
Введем следующие обозначения:
|
1 |
|
u |
|
|
|
1 |
|
u |
|
|
av |
|
|
|
|
; |
ap |
|
|
|
. |
|
|
p |
|
dv |
|
|
|
v |
|
dp |
|
|
|
p |
|
|
|
v |
||||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
При этом выражение (111) примет вид:
du av l a p w av l a p n l ( av n a p ) l .
Сопоставляя соотношения (109) и (113), получим
q ( a |
v |
n a |
p |
1 ) l. |
|
|
|
(110)
(111)
(112)
(113)
(114)
Для определения величин ( av и
a p
) рассмотрим два термодинамиче-
ских процесса:
1. Изоэнергетический процесс (u = idem, du
показатель политропы принимает значение n = nu.
Так как в изоэнергетическом процессе l 0
дует, что
av nu a p 0
= 0). Для этого процесса
, из уравнения (113) сле-
(115)

или
av
45
n |
a |
p |
u |
|
.
(115а)
2. Адиабатный процесс ( q = 0). В этом процессе показатель политро-
пы принимает значение n = k и называется показателем адиабаты.
В адиабатном процессе элементарная термодинамическая работа также не равна нулю, поэтому из выражения (114) имеем
a |
k a |
p |
v |
|
1 0
.
(116)
Сопоставляя соотношения (115) и (116), получаем следующие выраже-
ния:
a |
|
|
1 |
|
p |
k n |
|||
|
|
|||
|
|
|
||
|
|
|
u |
, av |
nu |
. |
|
k nu |
|||
|
|
(117)
С учетом полученных соотношений для определения av и ap, находим выражения для расчета удельных значений изменения внутренней энергии и теплообмена в элементарном процессе:
du |
n n |
l |
|
u |
|||
|
|
||
|
k n |
|
|
|
u |
|
|
q |
k n |
l |
|
k nu |
|||
|
|
,
.
(118)
(119)
Соотношения для расчета удельных значений изменения внутренней энергии и теплообмена в конечном процессе имеют следующий вид:
u |
|
nu n |
l |
, |
(120) |
|
|||||
1,2 |
1,2 |
|
|
||
|
|
k nu |
|
|
|
|
46 |
|
|
q1,2 |
k n |
l1,2 . |
|
k n |
|||
|
|
||
|
u |
|
(121)
Полученные соотношения (120), (121) позволяют в координатах p-v по-
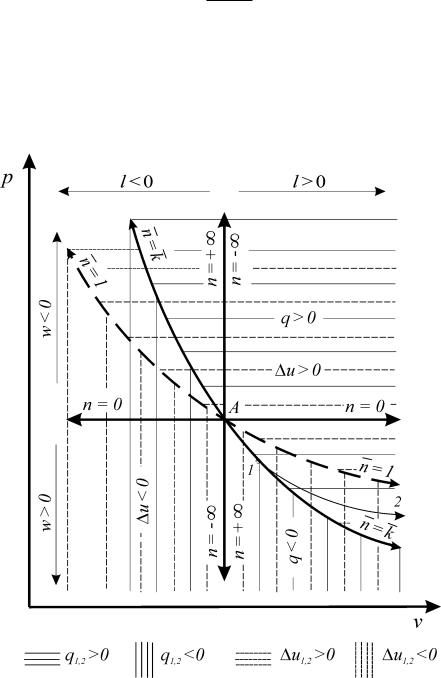
строить области подвода и отвода теплоты (рис. 9).
Рис. 9. Процессы изменения состояния идеального газа
Некоторые характеристики важнейших термодинамических процессов приведены в табл. 1
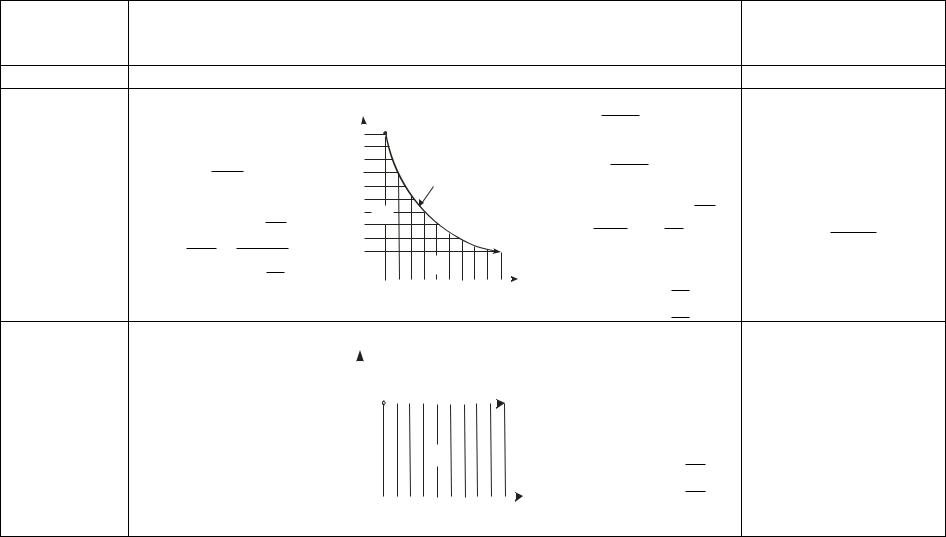
Название и уравнение
процесса
1
Политропный pvn = idem
Изобарный p = idem, dp = 0
47
Термодинамические процессы изменения состояния простого тела
|
Показатель |
|
|
|
|
|
Графическое |
|
|
|
|
|
|
|
|
|
|
|
|
Работа |
|
||||||||||||
|
политропы |
|
|
|
|
|
изображение |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
2 |
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P v |
1 |
|
1 1,2 , |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
l1,2 = |
|
1 |
|
|
|
||||||||||||
|
- n + , |
|
|
P |
|
|
|
n |
1 |
|
|||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
P v |
|
|
|
|
|
|
|
||||||
|
|
|
|
vdp |
|
w |
|
|
|
|
|
|
|
|
|
|
|
|
1 |
1,2 , |
|||||||||||||
n = |
|
|
|
|
|
|
|
|
|
w1,2 |
= n |
|
|
1 |
|
|
1 |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
|
|
|
|
|
|
|
|
n |
|
|
n |
|
1 |
||||||||||||||||||||
|
|
|
|
|
pdv |
|
|
|
|
|
Pv = idem |
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n 1 |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
p |
|
|
w |
|
|
|
|
|
P v |
|
|
|
|
|
|
|
P |
|
n |
|||||||
|
|
|
|
|
log |
|
|
1 |
|
|
|
1,2 |
|
|
|
|
2 |
|
|
|
|
|
|||||||||||
|
w |
|
|
|
|
|
|
|
|
|
|
|
1,2 = |
|
|
2 |
|
|
|
= |
|
|
2 |
|
= |
||||||||
|
|
|
|
|
p |
|
|
|
|
|
2 |
|
P v |
|
|
|
|
|
P |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
|
1,2 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
l |
|
|
|
|
|
v |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
log |
|
|
|
2 |
|
1,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
1,2 |
|
|
2 |
|
|
|
|
|
|
|
v |
|
|
|
n |
1 |
|
T |
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
v |
|
|
|
|
|
|
|
= |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
= |
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
v |
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
|
|
|
2 |
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
v |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
2 |
|
|
|
|
|
|
T |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
||||
|
|
|
|
|
|
|
|
|
|
|
P |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P= idem |
|
|
|
l1,2 = p (v2 - v1), |
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
1 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
P1 |
|
|
|
|
|
|
|
|
w1,2 |
= 0, |
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
n = 0 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
n 1 |
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
1,2 |
|
|
1,2 |
|
|
v1 |
|
T2 |
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
T |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
v |
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
= |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
1 |
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
v1 |
v2 v |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 1
Количество
теплоты
5
q1,2 = u1,2 + l1,2 =
= h1,2 + w1,2 ,
q1,2 = |
k n |
l1,2 |
|
k n |
|||
|
|
||
|
u |
|
q1,2 = u1,2 + l1,2 =
= h1,2
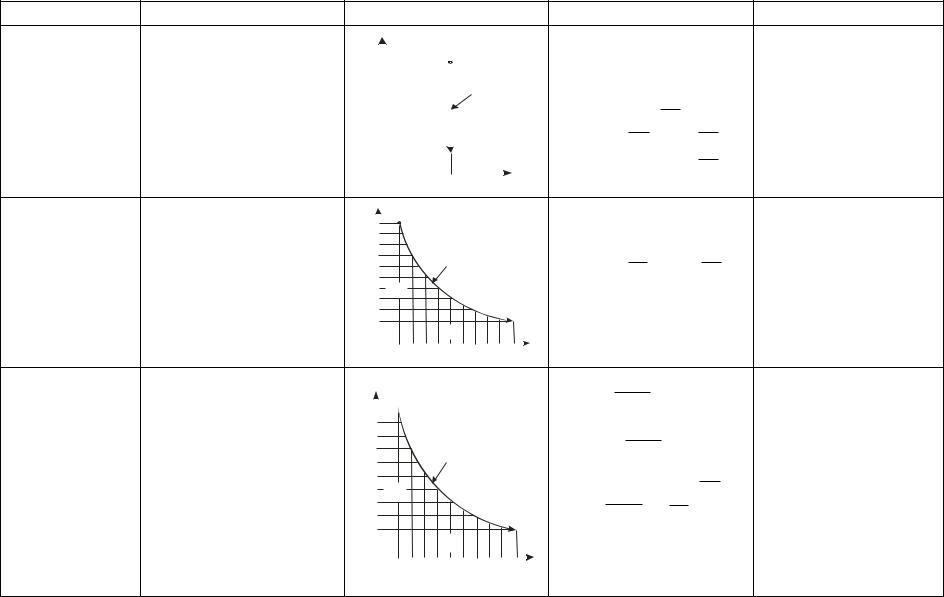
1 |
2 |
Изохорный
v = idem, n = ± ∞ dv = 0
Изопотенциаль- |
n = 1 |
|
ный pv = idem |
||
|
Адиабатный |
n = k = ns = |
||||||
|
|
|
|
|
|||
δq = 0, |
vdp |
|
h |
||||
|
k |
|
|
|
|
|
|
|
|
|
|||||
pv |
= idem |
|
|
|
u s |
||
|
|
pdv s |
|||||
48
|
|
|
3 |
|
|
||||
P |
|
|
|
|
|
|
|
||
P1 |
|
|
1 |
|
|
|
|||
|
|
|
|
|
|
|
v = idem |
||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
w1,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
P2 |
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
||||
|
|
|
|
|
|
||||
|
|
|
|
v1 = v2 |
v |
|
|
||
P |
1 |
|
|
|
|
|
|
||
P |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|||
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
Pv = idem |
|
|
|||
|
w |
|
|
|
|
|
|
|
|
1,2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
P |
|
|
|
|
|
|
|
||
2 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|||
|
|
|
1, 2 |
|
|
|
|||
|
v |
|
|
|
|
v |
v |
||
1 |
|
|
|
|
2 |
||||
P
P1  1
1
Pvk = idem
w1,2
2
P2
1,2
v1 |
v2 v |
4
l1,2 = 0,
w1,2 = v (p1 - p2),
|
|
P |
|
n 1 |
|
T |
|
|
|
|
n |
|
|
||||
1,2 |
= |
|
2 |
|
= |
|
2 |
|
|
|
|||||||
|
P |
|
|
T |
||||
|
|
|
|
|||||
|
|
|
|
|
|
|||
|
|
1 |
|
|
|
1 |
||
l1,2 = w1,2 = |
|
|
|||
|
v |
2 |
|
P |
|
= pv ln |
|
= pv ln |
1 |
, |
|
v |
|
P |
|||
|
1 |
|
|
||
|
|
|
2 |
|
|
1,2 = 1 |
|
|
|||
|
|
p v |
|
1 1,2 , |
|||||||||||
l1,2 = |
|
|
1 |
1 |
|||||||||||
k |
1 |
||||||||||||||
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
p v |
1 |
1,2 , |
||||||||||
w1,2 = k |
|
|
1 |
|
1 |
||||||||||
k |
|
||||||||||||||
|
|
|
1 |
|
|
|
|
|
|
||||||
|
P v |
|
|
|
|
P |
|
|
k 1 |
||||||
|
|
|
|
|
|
|
k |
||||||||
|
2 |
|
2 |
|
|
|
2 |
|
|
||||||
1,2 = |
|
= |
= |
||||||||||||
|
|
|
|||||||||||||
P v |
|
|
P |
|
|||||||||||
|
|
|
|
|
|
|
|
||||||||
|
1 |
|
|
|
|
|
|
|
|||||||
|
1 |
|
|
|
1 |
|
|
||||||||
|
v |
|
k 1 |
|
T |
2 |
|
|
|||||||
= |
|
|
1 |
|
|
|
|
|
= |
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|||||
|
v |
|
|
|
|
|
|
|
T |
|
|
||||
|
|
2 |
|
|
|
|
|
|
1 |
|
|
||||
Продолжение табл. 1
5
q1,2 = u1,2 =
= h1,2 + w1,2
q1,2 = u1,2 + l1,2 =
=h1,2 + w1,2
q1,2 = 0

|
|
|
49 |
|
|
|
Процессы изменения состояния идеального газа |
|
|||
|
При изучении процессов изменения состояния идеальных газов, наряду |
||||
с |
общими |
соотношениями |
по |
расчету |
термодинамических |
процессов (79) |
– (121), следует |
использовать уравнение Клапейрона (27) |
|||
и закон Джоуля (33), в соответствии с которыми для идеального газа спра-
ведливы следующие выражения:
если
h
pv idem , то T idem;
u pv u RT h T ; du cv dT ;
dh c p dT .
(122)
(123)
(124)
(125)
Из уравнений (122) (125) следует, что для идеального газа процессы изопотенциальный (pv =idem), изотермический (T = idem), изоэнергетиче-
ский (u= idem) и изоэнталыпийный (h = idem) тождественны и, следователь-
но, показатели этих процеcсов равны
n |
pv |
n |
|
T |
nu
nh
1
.
(126)
Характеристика расширения или сжатия процессов, в которых рабочим телом является идеальный газ, с учетом уравнения Клапейрона может быть определена по соотношению температур
|
|
|
p |
2 |
v |
2 |
|
|
|
||||
|
|
|
|
|
||
|
1,2 |
|
p v |
|
||
|
|
|
|
|||
|
|
|
|
1 |
1 |
|
=
T2 T1
.
(127)
Изменения удельных значений внутренней энергии и энтальпии иде-
ального газа в процессе в соответствии с законом Джоуля находится по сле-
дующим формулам:
u1,2 cvm T2 T1 ; |
(128) |

50
h1,2 cpm T2 T1 .
(129)
Показатель адиабатного процесса для идеального газа определяется как соотношение изобарной и изохорной теплоемкостей
k = ns =
|
w |
|
|
|
l |
q 0
|
h |
= |
|
|
u |
q 0
=
c c
p v
=
c c
p v
.
(130)
На основании закона Майера ( cp cv R ) показатель адиабаты для идеального газа может быть определен из следующего соотношения:
k =
c c
p v
=
cv R |
1 |
|
R |
|
cv |
cv |
|||
|
|
>1.
(131)
Для идеального газа показатель изоэнергетического процесса |
nu |
поэтому удельное количество теплоты в элементарном процессе может определено по формуле
q |
k n |
l . |
|
k 1 |
|||
|
|
1 |
и |
быть
(132)
На примере идеального газа произведем анализ термодинамических процессов (рис.9).
Адиабата ( q 0 ) является линией перемены знака теплообмена. При расширении газа термодинамическая работа l 0 и тогда любая политропа,
расположенная правее адиабаты (n < k), находится в области подвода тепло-
ты ( q > 0). Если политропа расширения будет находиться слева от адиабаты
(n > k), то этот процесс будет характеризоваться отводом теплоты ( q < 0).
Таким образом, все термодинамические процессы, проходящие выше адиабаты осуществляются с подводом теплоты и наоборот.
