
КонюховХроматография
.pdf
136 |
В. Ю. КОНЮХОВ. ХРОМАТОГРАФИЯ |
(рис. 52, 2). При вогнутой изо* терме адсорбции (третьего ти* па) у пика размыт фронт (рис. 52, 3).
Для построения изотерм и изостер адсорбции вычисляют
Пп
абсолютную адсорбцию a по уравнению
a 2 ma 1 Пa , g 1 Пп
где Пп — площадь пика на хроматограмме при введении ma молей адсорбата; Пa — площадь фрагмента хромато*
граммы между линией, соответствующей времени удержи* вания несорбирующегося газа, и растянутым краем пика, и ограниченная высотой h; g — масса сорбата в колонке. Площади Па и Пп обычно определяют взвешиванием фраг* ментов хроматограммы на аналитических весах.
Парциальные давления адсорбата вычисляют по урав* нению
P 2 mauлh1 RT , Пп 1 3
где uл — скорость движения диаграммной ленты; — объ* емная скорость газа*носителя; R — универсальная газо* вая постоянная; Т — температура термостата колонок. Вы* числив а и соответствующие им Р, строят изотермы ад* сорбции в координатах а = f(P).
2.5.2. ОПРЕДЕЛЕНИЕ ТЕПЛОТ РАСТВОРЕНИЯ И ТЕПЛОТ АДСОРБЦИИ ВЕЩЕСТВ В НЕПОДВИЖНОЙ ФАЗЕ
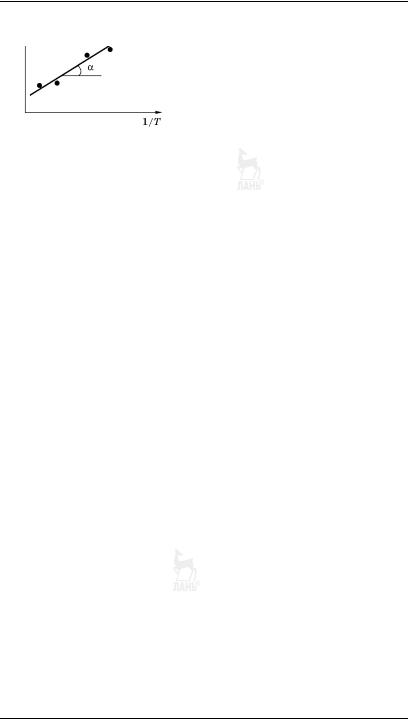
Методом обращенной газовой хроматографии можно определить теплоты растворения (в газо*жидкостной хро* матографии) и теплоты адсорбции (в газо*адсорбционной хроматографии). Для этого получают зависимость време* ни удерживания tR исследуемого вещества от температу* ры. Вычисляют удельные удерживаемые объемы Vg при
ГЛАВА 2. ГАЗОВАЯ ХРОМАТОГРАФИЯ |
137 |
|
Рис. 55 |
Рис. 54 |
Зависимость объемов удержива* |
Вычисление теплоты |
ния воды (1) и гептана (2) |
сорбции из хроматографических |
на пигменте пурпурном от |
данных |
температуры |
различных Т и строят график в координатах lnVg от 1/Т (рис. 54). Из тангенса угла наклона прямой, проведенной через точки, вычисляют дифференциально*молярную те* плоту сорбции при максимальной концентрации адсорба*
та в газовой фазе: qst = R tg .
Отношение qst для воды (полярного вещества) и гептана (неполярное вещество) может служить мерой гидрофиль* ности поверхности сорбента в колонке. В работе В. Ю. Ко* нюхова «Исследование адсорбционных свойств красочных пигментов методом газовой хроматографии» [26] таким путем были измерены теплоты адсорбции воды и гептана на поверхности красочных пигментов.
Исследуемые пигменты помещали в хроматографиче* скую колонку длиной 40 см и диаметром 3 мм. Тестирую* щие вещества вводили в испаритель хроматографа с по* мощью микрошприца объемом 1 мкл. Получали хромато* граммы адсорбатов в интервале температур 333–443 К. На рис. 55 приведены полученные опытные данные. Как вид* но из рисунка, для обоих тестирующих веществ опытные точки группируются вдоль прямых, это позволило вычис* лить дифференциально*молярные изостерические тепло* ты адсорбции при максимальной концентрации адсорба* та в газовой фазе qst. Они оказались равными: –35,2 кДж/ моль для воды и –6,8 кДж/моль для гептана. Таким обра* зом поверхность пигмента пурпурного имеет ярко выра* женные гидрофильные свойства: отношение теплот ад* сорбции воды и гептана равно 5,2.
Powered by TCPDF (www.tcpdf.org)

138 |
В. Ю. КОНЮХОВ. ХРОМАТОГРАФИЯ |
2.5.3.ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТА ДИФФУЗИИ ВЕЩЕСТВА В НЕПОДВИЖНОЙ ФАЗЕ
Суть метода заключается в том, что исследуемое веще* ство (нелетучую жидкость, полимер) помещают в хрома* тографическую колонку и записывают хроматограммы тестирующих веществ при различных линейных скоро* стях газа*носителя u. По уравнению (2.25) вычисляют ВЭТТ (Н). Далее методом наименьших квадратов вычис* ляют константы A, B и C уравнения Ван*Деемтера (2.45), связывающего H C u:
H 1 A 2 Bu 2 C 3 u.
Коэффициент диффузии D тестирующего вещества в неподвижной фазе рассчитывают из полученного значе* ния константы С:
|
8d2k1 |
|
С 2 |
f |
, |
32D 4 (15 k1)2 |
где df — толщина пленки полимера; k — коэффициент емкости.
В качестве примера рассмотрим результаты опытов по определению коэффициентов диффузии веществ в полиэти* лентерефталате. Измерения проводили в интервале темпе* ратур 40–250 С. В качестве газа*носителя применяли ге* лий, интервал измерения линейной скорости 6–20 см/с; детектором служил катарометр.
Пробы исследуемых веществ (бензола, толуола и т. д.) подавали в испаритель хроматографа с помощью микро* шприца объемом 1 мкл. Полимер наносили на инертный адсорбент из раствора в бензиловом спирте. В табл. 10 при* ведены результаты измерений и расчетов коэффициентов диффузии толуола:
1 2 3 4 5 6 2 7 897
12345466748946 78 2 8 8
1818 |
123 |
423 |
523 |
6223 |
|
|
|
|
|
22 128328 |
67893 |
7463 |
7493 |
874 3 |
1

ГЛАВА 2. ГАЗОВАЯ ХРОМАТОГРАФИЯ |
139 |
Для бензола коэффициент диффузии при 40 С оказал* ся равен 2,85 10–12 м2/с, это значение несколько выше, чем в случае толуола при указанной температуре. Вычислен* ные значения D и энергия активации диффузии толуола по порядку величины соответствуют литературным данным.
2.5.4.ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ СТЕКЛОВАНИЯ ПОЛИМЕРОВ
Вхроматографическую колонку загружают полимер.
Спомощью хроматографического шприца подают пробы тестирующего вещества и регистрируют время их удер* живания t при различных температурах. По перегибам на кривых lnt = f(1/T) определяют температуры физиче* ских или фазовых переходов в полимере. Появление пе* регибов обусловлено изменением механизма сорбции: ниже температуры стеклования полимера молекулы ад* сорбата практически не проникают вглубь твердой поли* мерной фазы и удерживание их в хроматографической колонке определяется лишь адсорбцией на поверхности полимера. При температурах выше температуры стекло* вания макромолекулы приобретают возможность менять конформации и становится возможной диффузия молекул адсорбата вглубь фазы полимера, и наряду с адсорбцией,
происходит абсорбция, в результате чего, начиная с TС на* блюдается некоторое увеличение t. При дальнейшем по* вышении Т вплоть до температуры плавления равновес* ная сорбция уменьшается, что вновь приводит к сниже* нию времени удерживания.
Вкачестве примера приведем данные по определению температуры стеклования сополимера бутадиена и стиро* ла (ДСТ*30). Исследуемые полимеры и смеси полимеров наносили на инертный носитель из растворов в толуоле. В качестве газа*носителя применяли гелий, детектором служил катарометр, тестирующие вещества — четырех* хлористый углерод и толуол.
Вкачестве иллюстрации на рис. 56 в координатах lnt от 1/T представлены полученные данные: линия 1 отвеча* ет температурной зависимости времени удерживания то* луола, линия 2 — CCl4. Температура стеклования ДСТ*30

140 |
В. Ю. КОНЮХОВ. ХРОМАТОГРАФИЯ |
Рис. 56
Зависимость времени удерживания толуола (1) и CCl4 (2) на ДСТ
(жесткого блока), найденная из опытов по сорбции толуо* ла, оказалась равной 78–87 С, из опытов по сорбции CCl4 80–90 С. В обоих случаях значения ТС близки к опреде* ленному методом дифференциальной сканирующей кало* риметрии ( 81 С).
2.5.5.ОПРЕДЕЛЕНИЕ ТЕРМОДИНАМИЧЕСКИХ ПАРАМЕТРОВ ВЗАИМОДЕЙСТВИЯ ПОЛИМЕР — РАСТВОРИТЕЛЬ
Одной из особенностей растворов полимеров является их неидеальное поведение (неподчинение закону Рауля) при самых малых концентрациях. Отрицательные откло* нения от закона Рауля свидетельствуют о сильном сродст* ве компонентов раствора друг к другу, а положительные — о слабом. Отклонения от идеальности в растворах обуслов* ливаются несоблюдением следующих условий:
HM 1 0 и SM 1 SидM ,
где НМ и SМ — энтальпия и энтропия смешения. Харак* теристикой отклонения от идеальности в растворах яв* ляются избыточные термодинамические функции сме* шения.

ГЛАВА 2. ГАЗОВАЯ ХРОМАТОГРАФИЯ |
141 |
Если изменения энергии Гиббса, энтальпии и энтро* пии смешения, сопровождающие образование реального раствора, обозначить через GМ, HМ и SМ, а изменение этих же функций при получении идеального раствора — через GидM , HидM и SидM , то избыточные функции можно записать как разность:
|
GE 1 GM 2 GM , |
(2.47) |
|
ид |
|
|
SE 1 SM 2 SM . |
(2.48) |
|
ид |
|
Поскольку при образовании идеального раствора |
||
HM 1 0, |
то |
|
ид |
HЕ = HМ. |
(2.49) |
|
||
Уравнения (2.47)–(2.48) справедливы для избыточных парциальных молярных термодинамических функций смешения (бесконечно малых приращений термодинами* ческих функций, пересчитанных на 1 моль добавленного компонента). Избыточные термодинамические функции смешения могут быть вычислены из соотношений:
GE 2 RTln3 411 , |
(2.50) |
||||
H |
E |
4 R |
2ln 311 |
|
|
|
|
, |
(2.51) |
||
|
2(1/T) |
||||
SE 2 НE 1 GE , |
(2.52) |
||||
|
|
|
Т |
|
|
где GЕ, НЕ, SЕ — соответственно избыточная парциаль* ная молярная энергия Гиббса, энтальпия и энтропия сме* шения. Величину ln 211 можно определить из хроматогра* фических данных по уравнению:
ln 31 4 ln |
2732 R |
5 |
P10 |
(B |
5 V ), |
(2.53) |
|
Vg P10 M2 |
RT |
||||||
1 |
|
11 |
1 |
||||
|
|
|
|
где В11 — второй вириальный коэффициент сорбата при температуре колонки; V1 — его молярный объем; P10 — давление насыщенного пара чистого сорбата; Vg — приве* денный удельный объем удерживания.
По этим уравнениям можно определить избыточные термодинамические функции смешения полимера с рас* творителем.

142 |
В. Ю. КОНЮХОВ. ХРОМАТОГРАФИЯ |
В теории Флори — Хаггинса для растворов полимеров активность a1 выражается в виде двух слагаемых:
lna1 5 (lna1)комб 6 (lna1)некомб 5 3ln71 6 118 1r 272 6 9722 4,
где (ln a1)комб — комбинаторная (или конфигурационная) энтропия, a (lna1)некомб — некомбинаторная (или термиче*
ская) энергия Гиббса смешения; 21 3 |
|
11v1 |
|
|
; v1 и v2 — |
1 v 4 1 v |
|||||
|
1 |
1 |
2 |
2 |
|
удельные объемы адсорбата и полимера соответственно;
1 и 2 — их массовые доли.
Поскольку соотношение 1 и 2 меняется с температу* рой из*за разной величины коэффициентов термического расширения компонентов, оба члена в (ln a1)комб будут из* меняться с температурой. Параметр термодинамического взаимодействия Флори — Хаггинса связан с энергией Гиббса и зависит от температуры и концентрации, а так* же от (ln a1)комб. Для случая 2 1:
|
2 a1 |
31 |
|
2 v1 |
3 |
2 |
|
|
|
v1 |
3 |
|
|
|
||||||
ln8 |
|
9 |
4 ln8 |
|
9 |
5 81 |
6 |
|
|
9 |
5 7. |
(2.54) |
||||||||
|
v |
M v |
||||||||||||||||||
|
|
1 |
|
|
|
2 |
|
|
|
|
|
2 2 |
|
|
|
|
|
|||
Из уравнения (2.54) следует |
|
|
|
|
|
|
|
|
|
|
||||||||||
4 5 ln |
2731 R 1v2 |
6 |
216 |
|
|
V1 |
|
3 |
6 |
|
P1 |
|
(B |
6 V ). |
|
|||||
|
|
M v |
|
8 |
|
RT |
|
(2.55) |
||||||||||||
|
V P |
0 |
V |
|
7 |
|
|
|
|
|
|
|
11 |
1 |
||||||
|
|
|
9 |
|
|
|
2 2 |
|
|
|
|
|
|
|
|
|
||||
|
|
g 1 |
1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Для вычислений по уравнению (2.55) необходимо знать величину второго вириального коэффициента сорбата. Для неполярных веществ В11 можно рассчитать по фор*
муле: |
|
|
1 |
|
3 |
Т 42 |
2 |
|||
|
B P |
9 |
|
|||||||
|
11 кр |
7 |
51 |
8 |
69 |
кр |
|
6. |
||
|
|
|
|
|
||||||
|
RTкр |
128 |
|
|
|
Т |
|
|||
Здесь Ткр и Ркр — критические температура и давле* ние адсорбата. Таким образом, используя эксперименталь* но определенные величины удерживаемых объемов, с по* мощью уравнения (2.55) можно рассчитать параметр тер* модинамического взаимодействия Флори — Хаггинса.

ГЛАВА 2. ГАЗОВАЯ ХРОМАТОГРАФИЯ |
143 |
2.6.ПРЕПАРАТИВНАЯ ГАЗОВАЯ ХРОМАТОГРАФИЯ
Одновременно с развитием аналитической хро* матографии, ставшей одним из важнейших методов ана* лиза сложных смесей, происходило развитие и неанали* тических вариантов хроматографии, в первую очередь для выделения индивидуальных соединений из их смесей. Так сформировалась препаративная газовая хроматография. В настоящее время она превратилась в самостоятельную область газовой хроматографии, которой ежегодно посвя* щаются научные работы и которая получила свое индиви* дуальное аппаратурно*инструментальное оформление.
Следует отметить, что первым для препаративных це* лей хроматографию использовал ее основатель М. С. Цвет, который после разделения пигментов (методом жидкост* ной адсорбционной хроматографии) на колоннах большо* го диаметра (до 30 мм) разрезал столбик неподвижной фазы (CaCO3) на части и извлекал из каждого слоя индивидуаль* ное вещество. Началом же современной препаративной га* зовой хроматографии можно считать работу Д. Эванса и Дж. Татлова [48], которые разделили хлоруглеводороды на колонке диаметром 3 см.
Препаративная хроматография развивалась параллель* но с самой газовой хроматографией, когда, с одной сторо* ны, становились понятными исключительные раздели* тельные способности хроматографических колонок, а с другой стороны, потребность в чистых веществах уже не удовлетворялась другими методами разделения: дистил* ляцией, экстракцией и т. п. Первоначально препаратив* ная газовая хроматография служила как бы лаборатор* ным дополнением к этим методам. В настоящее время можно говорить уже о полупромышленном и промышлен* ном использовании препаративной хроматографии для получения больших количеств чистых веществ.
Главные отличия процессов, происходящих в препа* ративных колонках по сравнению с аналитическими, вы* званы большим их диаметром и количеством вводимой на разделение смеси. В результате процесс разделения в ана* литических и препаративных колоннах отличается как

144 |
В. Ю. КОНЮХОВ. ХРОМАТОГРАФИЯ |
по существу, так и по аппаратурному оформлению, хотя общая принципиальная основа для них сохраняется.
В препаративной хроматографии появляются свои кри* терии, которые в аналитической хроматографии вообще не используются:
1)удельная нагрузка ms — количество вводимой в еди* ницу времени смеси, отнесенная к единице сечения ко* лонки;
2)степень обогащения q — отношение относительного
содержания выделяемого компонента в продукте сk к от* носительному содержанию его в исходной смеси c0:
ck
q 2 11 ck ; c0
11 c0
3) коэффициент извлечения 1 — отношение получен* ного количества компонента к общему его количеству, вве* денному в систему;
4)производительность Р — количество продукта задан* ной степени чистоты, получаемого в единицу времени;
5)удельная производительность — производитель* ность, отнесенная к единице сечения или объема колонны.
Достоинствами препаративной газовой хроматографии как метода разделения являются:
универсальность, позволяющая использовать метод для разделения практически всех летучих веществ;
высокая селективность, обусловленная специфично* стью взаимодействия подвижной и неподвижной фаз и позволяющая разделять даже изомеры;
высокая эффективность за счет развитой поверхности массообмена;
возможность получения за один цикл одного или не* скольких компонентов;
высокая гибкость метода и возможность полной авто* матизации разделительного процесса.
Основным недостатком препаративной хроматографии
является сравнительно низкая ее производительность. Ос* новная причина этого — периодический характер и низ*

ГЛАВА 2. ГАЗОВАЯ ХРОМАТОГРАФИЯ |
145 |
кая степень использования хроматографической колон* ки: в процессе разделения большая ее часть заполнена инертным носителем, значительная часть которого не при* нимает никакого участия в процессах массопередачи.
Препаративную хроматографию можно использовать для решения следующих основных задач разделения:
получение веществ в количествах, достаточных для идентификации;
получение стандартов веществ заданной высокой сте* пени чистоты;
получение чистых веществ для других целей, напри* мер для органического синтеза и т. д.
Естественно, что решение первой из задач может быть осуществлено с использованием обычных аналитических хроматографов с микропрепаративной приставкой и не требует использования специальных препаративных хро* матографов.
Основное внимание привлекает задача применения препаративной газовой хроматографии для получения дос* таточно больших количеств веществ. Здесь развитие пре* паративной газовой хроматографии идет как по линии со* вершенствования методов проявительной периодической хроматографии, так и по линии развития методов непре* рывной хроматографии, применение которой представля* ется особенно перспективным вследствие обеспечения бо* лее высокой производительности.
2.6.1.ПРОЯВИТЕЛЬНАЯ ПЕРИОДИЧЕСКАЯ ХРОМАТОГРАФИЯ
Этот вариант препаративной хроматографии в настоя* щее время получил очень широкое распространение и яв* ляется признанным лабораторным методом выделения ве* ществ из сложных смесей.
В лабораторную препаративную колонну диаметром около 50 мм вводят 10–20 см3 смеси. Если при этом удель* ную нагрузку поддерживать на уровне аналитических ко* лонок, то для получения нужных количеств вещества по* требовались бы колонны очень большого диаметра. По* этому на практике используют одновременное увеличение
