
- •Основные углеводы животных, их содержание в тканях, биологическая роль.
- •Основные углеводы пищи человека, потребность в углеводах.
- •Переваривание и всасывание углеводов.
- •Глюкоза как важнейший метаболит углеводного обмена.
- •Общая схема источников и путей расходования глюкозы в организме
- •Катаболизм глюкозы.
- •Анаэробный распад глюкозы, химизм, распределение, энергетика и физиологическое значение. Субстратное фосфорилирование.
- •Г ликонеогенез. Взаимосвязь гликолиза и гликонеогенеза (цикл кори).
- •Образование фосфоенолпирувата из пирувата
- •Определение глюкозы
- •Принцип и химизм ферментативного метода определения глюкозы в крови (глюкозооксидазного).
- •П ринцип колориметрического метода определения глюкозы по реакции с орто-толуидином.
- •Принцип количественного определения сахара мочи по альтгаузену.
- •Классификация:
- •Аэробный дихотомический распад глюкозы
- •2 Этапа:
- •Челночные механизмы переноса водорода из цитозоля в митохондрии.
- •Пентозофосфатный путь превращения глюкозы, распределение и физиологическое значение, энергетика. Биологическое значение. Окислительная и неокислительная стадии, биологическое значение.
- •Сахарная нагрузка как метод, характеризующий толерантность к глюкозе.
- •1. Нормальная сахарная кривая.
- •2. Гипергликемическая кривая.
- •3. Гипогликемическая сахарная кривая.
- •Свойства и распространение гликогена. Особенности обмена. Биосинтез гликогена в печени и мышцах.
- •Синтез гликогена.
- •Распад гликогена в печени и мышцах, особенности.
- •Фосфорилированные и дефосфорилированные формы фосфорилазы и гликогенсинтетазы, регуляция активности.
- •Природные соединения, в состав которых входят гетерополисахариды представлены гликопротеинами и гликозаминогликанами
Распад гликогена в печени и мышцах, особенности.
В организме человека может содержаться до 450 г гликогена, треть из которого накапливается в печени, а остальное — главным образом в мышцах.
Гликоген мышц служит резервом энергии и не участвует в регуляции уровня глюкозы в крови. В мышцах отсутствует глюкозо-6-фосфатаза, поэтому гликоген мышц не может быть источником глюкозы в крови. По этой причине колебания содержания гликогена в мышцах меньше, чем в печени.
Гликоген печени служит прежде всего для поддержания уровня глюкозы в крови в фазе пострезорбции. Поэтому содержание гликогена в печени варьирует в широких пределах. При длительном голодании оно падает почти до нуля, после чего начинается снабжение организма глюкозой с помощью глюконеогенеза.
Распад гликогена (мобилизация гликогена до глюкозы) активируется в постабсортивном периоде (при голодании, усиленной физической нагрузке). В печени функционируют два пути распада гликогена: амилолитический путь и фосфоролитический путь
Амилолитический путь заключается в гидролитическом распаде гликогена:
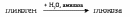
Этот путь катализируют α-амилаза, которая расщепляет внутренние 1,4 -α-гликозидные связи и γ - амилаза, которая отрывает концевые остатки глюкозы.
Основным способом распада гликогена является фосфоролитический путь при участии Н3РО4:
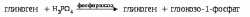
Гл![]() юкозо-1-фосфат
переходит в глюкозо-6-фосфат под действием
ферментафосфоглюкомутазы.
юкозо-1-фосфат
переходит в глюкозо-6-фосфат под действием
ферментафосфоглюкомутазы.
В печени имеются фермент – глюкозо-6-фосфатаза, способный отщеплять остатки Н3РО4 от глюкозо-6-фосфата, переводя глюкозо-6-фосфат в свободную глюкозу.
Фосфорилаза расщепляет только 1,4 -α-гликозидные связи. В расщеплении 1,6 -α-гликозидных связей участвует дополнительный фермент – 1,6 -α-гликозидаза.
Ключевым ферментом распада гликогена является фосфорилаза. В распаде гликогена участвуют активная фосфорилированная форма фосфорилазы (фосфорилаза «А»). Она образуется из неактивной фосфорилазы «В» путём фосфорилирования и увеличения олигомерности. Фосфорилаза «В» является нефосфорилированным димером, а фосфорилаза «А» представляет собой фосфорилированный тетрамер.
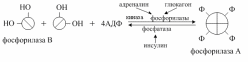
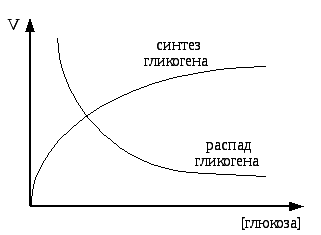 Си
Си![]() нтез
и распад гликогена подвержены авторегуляции
при изменении концентрации глюкозы по
приведенной схеме.
нтез
и распад гликогена подвержены авторегуляции
при изменении концентрации глюкозы по
приведенной схеме.
У детей обмен гликогена имеет свои особенности. В последний месяц внутриутробного развития активируется синтез гликогена, и его содержание достигает до 10% массы печени. В процессе родов происходит усиленный распадгликогена на энергетические цели, и его содержание резко снижается. Синтез гликогена активируется в первые 2-3 месяца.
Фосфорилированные и дефосфорилированные формы фосфорилазы и гликогенсинтетазы, регуляция активности.
Действие этих гормонов в конечном счете сводится к изменению скорости реакций, катализируемых ключевыми ферментами метаболических путей обмена гликогена – гликогенсинтазой и гликогенфосфорилазой, активность которых регулируется аллостерически и фосфорилированием/ десфорилированием.
Гликогенфосфорилаза существует в 2 формах:
1) фосфорилированная - активная (форма а); 2) дефосфорилированная - неактивная (форма в).
Фосфорилирование осуществляется путём переноса фосфатного остатка с АТФ на гидроксильную группу одного из сериновых остатков фермента. Следствие этого - конформационные изменения молекулы фермента и его активация.
Взаимопревращения 2 форм гликогенфосфорилазы обеспечиваются действием ферментов киназы фосфорилазы и фосфопротеинфосфатазы (фермент, структурно связанный с молекулами гликогена). В свою очередь, активность киназы фосфорилазы и фосфопротеинфосфатазы также регулируется путём фосфорилирования и дефосфорилирования.
Активация киназы фосфорилазы происходит под действием протеинкиназы А - ПКА (цАМФ-зависимой). цАМФ сначала активирует протеинкиназу А, которая фосфорилирует киназу фосфорилазы, переводя её в активное состояние, а та, в свою очередь, фосфорилирует гликогенфосфорилазу. Синтез цАМФ стимулируется адреналином и глюкагоном.
Активация фосфопротеинфосфатазы происходит в результате реакции фосфорилирования, катализируемой специфической протеинкиназой, которая, в свою очередь, активируется инсулином посредством каскада реакций с участием других белков и ферментов. Активируемая инсулином протеинкиназа фосфорилирует и тем самым активирует фосфопротеинфосфатазу. Активная фосфопротеинфосфатаза дефосфорилирует и, следовательно, инактивирует киназу фосфорилазы и гликогенфосфорилазу.
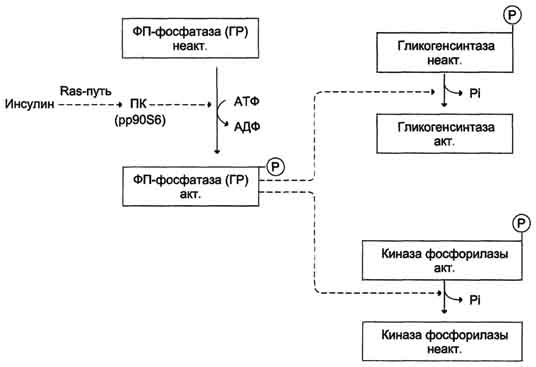
Влияние инсулина на активность гликогенсинтазы и киназы фосфорилазы. ФП-фосфатаза (ГР) - фосфопроте-инфосфатаза гранул гликогена. ПК (pp90S6) - протеинкиназа, активируемая инсулином.
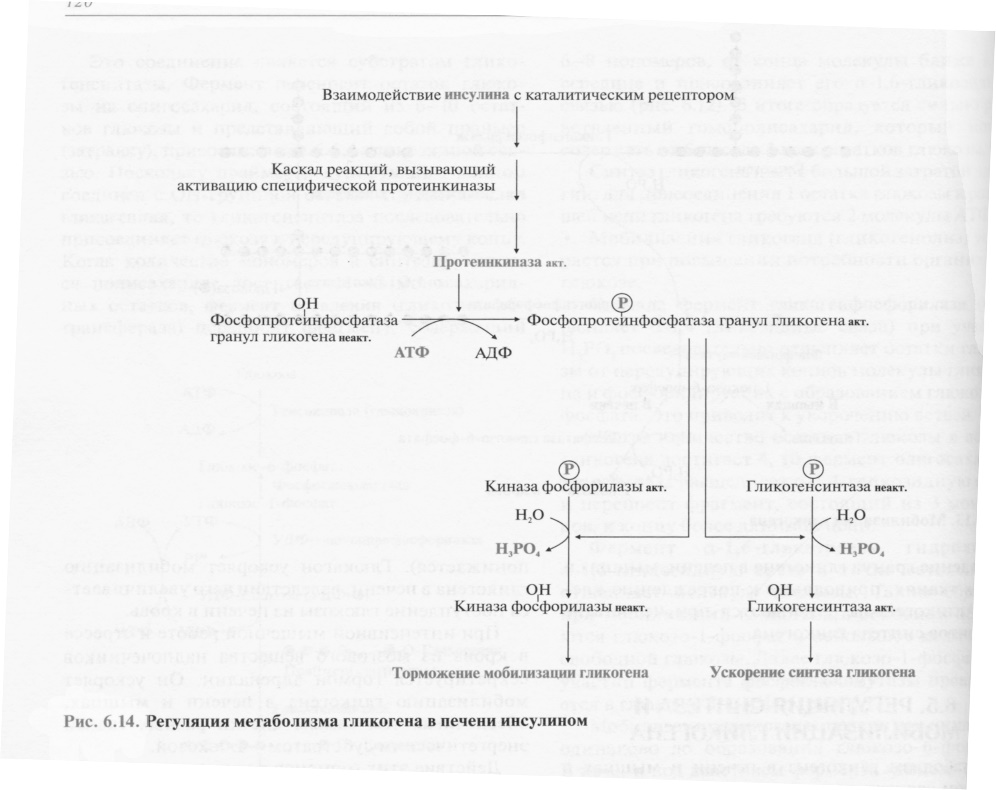
Активность гликогенсинтазы также изменяется в результате фосфорилирования и дефосфорилирования. Однако есть существенные различия в регуляции гликогенфосфорилазы и гликогенсинтазы:
ф
 осфорилирование
гликогенсинтазы катализирует ПК А и
вызывает её инактивацию;
осфорилирование
гликогенсинтазы катализирует ПК А и
вызывает её инактивацию;
дефосфорилирование гликогенсинтазы под действием фосфопротеинфосфатазы, наоборот, её активирует.
Регуляция метаболизма гликогена в ПЕЧЕНИ
Повышение уровня глюкозы в крови стимулирует синтез и секрецию β-клетками поджелудочной железы гормона инсулина. Инсулин передает сигнал в клетку через мембранный каталитический рецептор - тирозиновую протеинкиназу. Взаимодействие рецептора с гормоном инициирует ряд последовательных реакций, приводящих к активации фосфопротеинфосфатазы гранул гликогена. Этот фермент дефосфорилирует гликогенсинтазу и гликогенфосфорилазу, в результате чего гликогенсинтаза активируется, а гликогенфосфорилаза становится неактивной.
Таким образом, в печени ускоряется синтез гликогена и тормозится его распад.
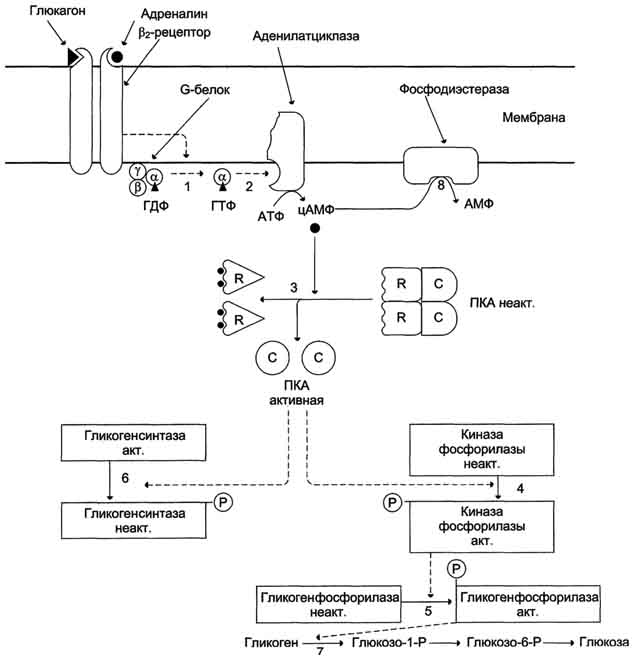
При голодании снижение уровня глюкозы в крови является сигналом для синтеза и секреции α-клетками поджелудочной железы глюкагона. Гормон передает сигнал в клетки через аденилатциклазную систему. Это приводит к активации проттеинкиназы А, которая фосфорилирует гликогенсинтазу и киназу фосфорилазы. В результате фосфорилирования гликогенсинтаза инактивируется и синтез гликогена тормозится, а киназа фосфорилазы становится активной и фосфорилирует гликогенфосфорилазу, которая становится активной. Активная гликогенфосфорилаза ускоряет мобилизацию гликогена в печени.
1 - глюкагон и адреналин взаимодействуют со специфическими мембранными рецепторами. Комплекс гормон-рецептор влияет на конформацию G-белка, вызывая диссоциацию его на протомеры и замену в α-субъединице ГДФ на ГТФ;
2 - α-субъединица, связанная с ГТФ, активирует аденилатциклазу, катализирующую синтез цАМФ из АТФ;
3 - в присутствии цАМФ протеинкиназа А обратимо диссоциирует, освобождая обладающие каталитической активностью субъединицы С;
4 - протеинкиназа А фосфорилирует и активирует киназу фосфорилазы;
5 - киназа фосфорилазы фосфорилирует гликогенфосфорилазу, переводя её в активную форму;
6 - протеинкиназа А фосфорилирует также гликогенсинтазу, переводя её в неактивное состояние;
7 - в результате ингибирования гликогенсинтазы и активации гликогенфосфорилазы гликоген включается в процесс распада;
8 - фосфодиэстераза катализирует распад цАМФ и тем самым прерывает действие гормонального сигнала. Комплекс α-субъединица-ГТФ затем распадается.
При интенсивной физическеой работе и стрессе в крови повышается концентрация адреналина. В печени есть два типа мембранных рецепторов адреналина. Эффект адреналина в печени обусловлен фосфорилированием и активацией гликогенфосфорилазы. Адреналин имеет сходный с глюкагоном механизм действия. Но возможно включение и другой эффекторной системы передачи сигнала в клетку печени.
Р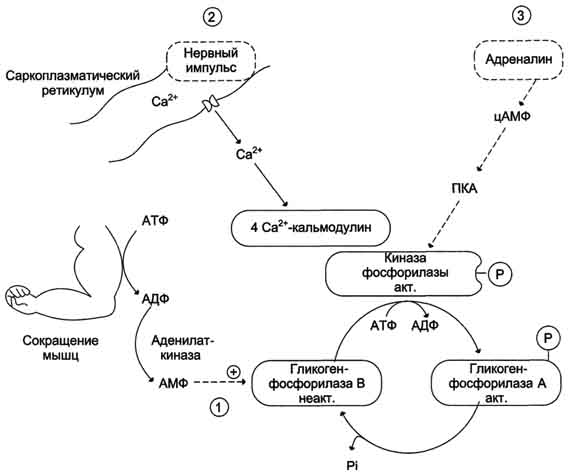 егуляция
метаболизма гликогена в МЫШЦАХ
егуляция
метаболизма гликогена в МЫШЦАХ
При высоком инсулин-глюкагоновом индексе инсулин способствует поступлению глюкозы в мышцы с помощью ГЛЮТ-4 и вызывает активацию гликогенсинтазы и ингибирование гликогенфосфорилазы.
При интенсивной мышечной работе мобилизацию гликогена в мышцах стимулируют 3 основных механизма.
В экстремальных ситуациях в мышечных клетках мобилизация гликогена ускоряется адреналином. Связывание адреналина с β-рецепторами, ассоциированными с аденилатциклазной системой, приводит к образованию цАМФ в клетке, а затем фосфорилированию и активации киназы фосфорилазы и гликогенфосфорилазы.
Активация гликогенфосфорилазы мышц.
1 - аллостерическая активация гликогенфосфорилазы В. В процессе мышечного сокращения происходит разрушение АТФ с образованием АМФ, который является аллостерическим активатором гликогенфосфорилазы В;
2 - нервный импульс инициирует освобождение Ca2+ из саркоплазматического ретикулума. Са2+ образует комплекс с кальмодулином, способный активировать киназу фосфорилазы;
3 - активация гликогенфосфорилазы адреналином через аденилатциклазную систему.
Образование цАМФ, стимулированное адреналином, служит сигналом к увеличению производства энергии в результате ускорения расщепления гликогена. Именно в ходе распада, образованного из гликогена глюкозо-6-фосфата, синтезируется АТФ. Инактивация гликогенсинтазы под влиянием адреналина в мышечных клетках проходит так же, как и в печени.
В состоянии покоя при низких концентрациях адреналина в крови гликогенфосфорилаза мышц находится в дефосфорилированном - неактивном состоянии, но распад гликогена всё-таки происходит. Это объясняется тем, что гликогенфосфорилаза активируется способом, не связанным с её фосфорилированием, так как уровень цАМФ в клетке низкий. В данной ситуации происходит аллостерическая активация гликогенфосфорилазы. Активаторами фермента служат АМФ и Н3РО4, образующиеся в клетке при распаде АТФ.
При умеренных мышечных сокращениях, т.е. в ситуации, не требующей участия в регуляции цАМФ, аллостерическим способом активируется киназа фосфорилазы. В данном случае аллостерическими эффекторами служат ионы Са2+, концентрация которых резко возрастает при сокращении мышц в ответ на сигнал от двигательного нерва. Активность фермента снижается сразу же, как только концентрация Са2+ в клетке уменьшается после поступления сигнала к расслаблению мышц. Таким образом, роль ионов Са2+ заключается не только в инициации мышечного сокращения, но также в обеспечении его энергозатрат.
Активация киназы фосфорилазы с помощью ионов Са2+ опосредована кальмодулином. Кальмодулин в данном случае - прочно связанная субъединица фермента.
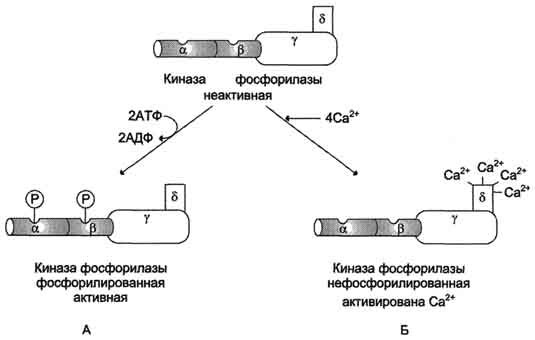
Регуляция активности киназы фосфорилазы.
Фермент состоит из 4 идентичных белковых комплексов. Каждый комплекс содержит 4 разных субъединицы α, β, γ, δ. На рисунке показан один из тетрамеров. Каталитической активностью обладает γ-субъединица. α- и β- протомеры выполняют регуляторную функцию, они фосфорилируются при участии ПК А. Кальмодулин - δ-субъединица, прочно связанная с ферментом.
А - активация киназы фосфорилазы в результате фосфорилирования;
Б - активация киназы фосфорилазы после присоединения Са2+ к кальмодулину.
В мышцах в период пищеварения, если он совпадает с состоянием покоя, происходит стимуляция синтеза гликогена. Мышечная работа во время пищеварения замедляет процесс синтеза гликогена, так как при этом мышцы используют для окисления глюкозу крови, поступающую из кишечника.
В переключении мобилизации гликогена на запасание глюкозы участвует инсулин. Как уже говорилось, глюкоза поступает в мышечные и жировые клетки с помощью глюкозо-транспортёров ГЛЮТ-4. Транспортёры в отсутствие инсулина находятся в цитоплазме клеток, и глюкоза клетками не используется, так как в мембране нет белков-переносчиков. Инсулин стимулирует перемещение ГЛЮТ-4 и встраивание их в мембрану клеток. Механизм подобного влияния инсулина изучен недостаточно, но определены его основные этапы. Цепь событий при стимуляции инсулином потребления глюкозы мышцами и жировыми клетками выглядит следующим образом:
рецептор инсулина (IR) - инсулинстимулируемая тирозиновая протеинкиназа - обязательный посредник всех действий инсулина;
активированный инсулином IR фосфорилирует специфические цитоплазматические белки - субстраты инсулина (IRS);
фосфорилированный субстрат (в основном IRS-1) соединяется с фосфатидилинозитол-3-киназой (ФИ-3-киназа) и активирует этот фермент;
активная ФИ-3-киназа катализирует фосфорилирование по позиции 3 ряд компонентов инозитолфосфатной сигнальной системы, приводящей к стимуляции транслокации ГЛЮТ из цитозоля в плазматическую мембрану;
глюкоза с помощью ГЛЮТ-4 поступает в мышечные клетки и включается в синтез гликогена.
Влияние инсулина на скорость синтеза гликогена в мышцах осуществляется посредством изменения активности гликогенсинтазы и гликогенфосфорилазы - ключевых ферментов, о чём уже говорилось при обсуждении влияния инсулина на метаболизм гликогена в печени.
