
- •Пищевые белки как источник аминокислот. Качественный состав и биологическая ценность пищевых белков.
- •Динамическое состояние белков в организме. Нормы белка в питании. Азотистый баланс.
- •П ереваривание белков
- •Протеиназы пищеварительного тракта (общая характеристика и классификация)
- •Минеральный состав желудочного сока. Роль соляной кислоты в процессах пищеварения.
- •Виды кислотности желудочного сока, определение и расчет всех видов кислотности по михаэлису.
- •Проферменты пищеварительных протеиназ, механизм превращения в ферменты. Субстратная специфичность протеиназ.
- •Желудочные протеиназы: пепсин, гастриксин, их роль в переваривании белков.
- •Методы количественного определения пепсина.
- •Химический состав панкреатического и кишечного соков. Роль панкреатических и кишечных протеиназ в переваривании белков.
- •Б иохимические механизмы регуляции пищеварения, гормоны желудочно-кишечного тракта. Всасывание аминокислот.
- •Общая схема источников и путей расходования аминокислот в тканях. Экзогенный и эндогенный пул аминокислот
- •Трансаминирование, химизм. Трансаминазы, их специфичность. Роль витамина в6 в трансаминировании.
- •Биологическая роль реакций трансаминирования
- •Определение трансаминаз в сыворотке крови.
- •Д езаминирование аминокислот
- •Окислительное дезаминирование химизм. Роль глутаматдегидрогеназы. Биологическая роль окислительного дезаминирования аминокислоты.
- •Непрямое дезаминирование аминокислот, понятие, стадии, биологическое значение.
- •Декарбоксилирование аминокислот, химизм, ферменты, субстратная специфичность декарбоксилаз.
- •Биогенные амины, механизм образования, влияние на процессы метаболизма и физиологические функции. Окисление биогенных аминов.
- •Образование катехоламинов и гамк, функции аминов.
- •Понятие о свободном амином азоте. Принцип метода определения, диагностическое значение.
- •Трансметилирование. Метионин и s-аденозилметионин. Роль метионина в биосинтезе биологически важных соединений, в реакциях обезвреживания.
- •Тетрагидрофолиевая кислота и ее роль в синтезе и переносе одноуглеродных радикалов.
- •Обмен фенилаланина и тирозина. Пути превращения в норме.
- •Врожденные нарушения обмена ароматических аминокислот. Методы предупреждения, диагностики и лечения врожденных нарушений обмена фенилаланина и тирозина.
- •Наследственные нарушения обмена других аминокислот.
- •Понятие о скрининг-тестах.
- •Качественное открытие фенилпировиноградной и гомогентезиновой кислот.
- •Конечные продукты азотистого обмена. Основные источники аммиака в организме.
- •О безвреживание аммиака в месте образования в организме.
- •Транспортные формы обезвреженного аммиака
- •Г люкозо-аланиновый цикл
- •Синтез мочевины как путь окончательного обезвреживания аммиака. Химизм, ферменты, энергетика. Биологический смысл цикла мочевинообразования, связь с цтк.
- •Нарушения синтеза и выведения аммиака. Причины уремии.
- •Патология азотистого обмена.
- •Определение мочевины в сыворотке крови. Диагностическое значение.
- •Креатин и креатинин. Количественное определение креатинина, роль, диагностическое значение.
- •Образования аммонийных солей
Д езаминирование аминокислот
Дезаминирование – процесс потери аминокислотой аминогруппы, в результате чего образуется соответствующая α-кетокислота (безазотистый остаток) и выделяется молекула аммиака. В организме подвергается этому процессу только глутаминовая кислота, т.к. в организме активен фермент глутаматдегидрогеназа (ГДГ). Фермент ГДГ активен в митохондриях клеток всех органов, кроме мышечной ткани.
Окислительное дезаминирование химизм. Роль глутаматдегидрогеназы. Биологическая роль окислительного дезаминирования аминокислоты.
Наиболее активно в тканях происходит дезаминирование глутаминовой кислоты. Реакцию катализирует фермент глутаматдегидрогеназа, коферментом глутаматдегидрогеназы является NAD+. Реакция идёт в 2 этапа. Вначале происходит ферментативное дегидрирование глутамата и образование а-иминоглутарата, затем - неферментативное гидролитическое отщепление иминогруппы в виде аммиака, в результате чего образуется а-кетоглутарат. Окислительное дезаминирование глутамата - обратимая реакция и при повышении концентрации аммиака в клетке может протекать в обратном направлении, как восстановительное шинирование α-кетоглутарата. Глутаматдегидрогеназа очень активна в митохондриях клеток практически всех органов, кроме мышц. Этот фермент - олигомер, состоящий из 6 субъединиц (молекулярная масса 312 кД). Глутаматдегидрогеназа играет важную роль, так как является регуляторным ферментом аминокислотного обмена. Аллостерические ингибиторы глутаматдегидрогеназы (АТФ, ГТФ, NADH) вызывают диссоциацию фермента и потерю глутаматдегидрогеназной активности. Высокие концентрации АДф активируют фермент. Таким образом, низкий энергетический уровень в клетках стимулирует разрушение аминокислот и образованиеα-кетоглутарата, поступающего в ЦТК как энергетический субстрат. Глутаматдегидрогеназа может индуцироваться стероидными гормонами (кортизолом).
Оксидаза L-аминокислот. В печени и почках обнаружен фермент оксидаза L-аминокислот, способный дезаминировать некоторые L-аминокислоты. Коферментом в данной реакции выступает FMN. Однако вклад оксидазы L-аминокислот в дезаминирование, очевидно, незначителен, так как оптимум её действия лежит в щелочной среде (рН 10,0). В клетках, где рН среды близок к нейтральному, активность фермента очень низка.
Оксидаза D-аминокислот также обнаружена в почках и печени. Это FAD-зависимый фермент. Оптимум рН этой оксидазы лежит в нейтральной среде, поэтому фермент более активен, чем оксидаза L-аминокислот. Роль оксидазы D-аминокислот невелика, так как количество D-изомеров в организме крайне мало, потому что в белки пищи и белки тканей человека и животных входят только природные L-аминокислоты. Вероятно, оксидаза D-аминокислот способствует их превращению в соответствующие L-изомеры.
Непрямое дезаминирование аминокислот, понятие, стадии, биологическое значение.
Непрямое дезаминирование (трансдезаминирование) Большинство аминокислот не способно дезаминироваться в одну стадию, подобно Глу. Аминогруппы таких аминокислот в результате трансаминирования переносятся на α-кетоглутарат с образованием глутаминовой кислоты, которая затем подвергается прямому окислительному дезаминированию. Такой механизм дезаминирования аминокислот в 2 стадии получил название трансдезаминирования, или непрямого дезаминирования:
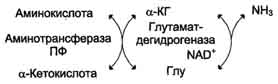
Непрямое дезаминирование аминокислот происходит при участии 2 ферментов: аминотрансферазы (кофермент ПФ) и глутаматдегидрогеназы (кофермент NAD+).
непрямое дезаминирование - основной способ дезаминирования большинства аминокислот. Обе стадии непрямого дезаминирования обратимы, что обеспечивает как катаболизм аминокислот, так и возможность образования практически любой аминокислоты из соответствующей α-кетокислоты.
В мышечной ткани активность глутаматдегидрогеназы низка, поэтому в этих клетках при интенсивной физической нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ. Вначале происходит перенос аминогруппы аминокислот на аспартат, затем на инозиновую кислоту (ИМФ) и в завершение - дезаминирование АМФ. Представленная схема отражает последовательность реакций непрямого неокислительного дезаминирования:

Можно выделить 4 стадии процесса:
трансаминирование с α-кетоглутаратом, образование глутамата;
трансаминирование глутамата с оксалоацета-том (фермент ACT), образование аспартата;
реакция переноса аминогруппы от аспартата на ИМФ (инозинмонофосфат), образование АМФ и фумарата;
гидролитическое дезаминирование АМФ.
Перенос аминогруппы от аспартата и синтез АМФ происходят следующим образом.
Реакция дезаминирования адениловой кислоты происходит под действием фермента АМФ дезаминазы Этот путь дезаминирования преобладает в мышцах при интенсивной работе, в результате которой накапливается молочная кислота. Выделяющийся аммиак предотвращает закисление среды в клетках, вызванное образованием лактата.
Биологическая роль непрямого дезаминирования. А - при катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогена-зы, в результате чего получаются а-кетоглутарат и аммиак; Б - при необходимости синтеза аминокислот и наличии необходимых α-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей α-кетокислотой, что приводит к синтезу новой аминокислоты
