
- •Пищевые белки как источник аминокислот. Качественный состав и биологическая ценность пищевых белков.
- •Динамическое состояние белков в организме. Нормы белка в питании. Азотистый баланс.
- •П ереваривание белков
- •Протеиназы пищеварительного тракта (общая характеристика и классификация)
- •Минеральный состав желудочного сока. Роль соляной кислоты в процессах пищеварения.
- •Виды кислотности желудочного сока, определение и расчет всех видов кислотности по михаэлису.
- •Проферменты пищеварительных протеиназ, механизм превращения в ферменты. Субстратная специфичность протеиназ.
- •Желудочные протеиназы: пепсин, гастриксин, их роль в переваривании белков.
- •Методы количественного определения пепсина.
- •Химический состав панкреатического и кишечного соков. Роль панкреатических и кишечных протеиназ в переваривании белков.
- •Б иохимические механизмы регуляции пищеварения, гормоны желудочно-кишечного тракта. Всасывание аминокислот.
- •Общая схема источников и путей расходования аминокислот в тканях. Экзогенный и эндогенный пул аминокислот
- •Трансаминирование, химизм. Трансаминазы, их специфичность. Роль витамина в6 в трансаминировании.
- •Биологическая роль реакций трансаминирования
- •Определение трансаминаз в сыворотке крови.
- •Д езаминирование аминокислот
- •Окислительное дезаминирование химизм. Роль глутаматдегидрогеназы. Биологическая роль окислительного дезаминирования аминокислоты.
- •Непрямое дезаминирование аминокислот, понятие, стадии, биологическое значение.
- •Декарбоксилирование аминокислот, химизм, ферменты, субстратная специфичность декарбоксилаз.
- •Биогенные амины, механизм образования, влияние на процессы метаболизма и физиологические функции. Окисление биогенных аминов.
- •Образование катехоламинов и гамк, функции аминов.
- •Понятие о свободном амином азоте. Принцип метода определения, диагностическое значение.
- •Трансметилирование. Метионин и s-аденозилметионин. Роль метионина в биосинтезе биологически важных соединений, в реакциях обезвреживания.
- •Тетрагидрофолиевая кислота и ее роль в синтезе и переносе одноуглеродных радикалов.
- •Обмен фенилаланина и тирозина. Пути превращения в норме.
- •Врожденные нарушения обмена ароматических аминокислот. Методы предупреждения, диагностики и лечения врожденных нарушений обмена фенилаланина и тирозина.
- •Наследственные нарушения обмена других аминокислот.
- •Понятие о скрининг-тестах.
- •Качественное открытие фенилпировиноградной и гомогентезиновой кислот.
- •Конечные продукты азотистого обмена. Основные источники аммиака в организме.
- •О безвреживание аммиака в месте образования в организме.
- •Транспортные формы обезвреженного аммиака
- •Г люкозо-аланиновый цикл
- •Синтез мочевины как путь окончательного обезвреживания аммиака. Химизм, ферменты, энергетика. Биологический смысл цикла мочевинообразования, связь с цтк.
- •Нарушения синтеза и выведения аммиака. Причины уремии.
- •Патология азотистого обмена.
- •Определение мочевины в сыворотке крови. Диагностическое значение.
- •Креатин и креатинин. Количественное определение креатинина, роль, диагностическое значение.
- •Образования аммонийных солей
Врожденные нарушения обмена ароматических аминокислот. Методы предупреждения, диагностики и лечения врожденных нарушений обмена фенилаланина и тирозина.
Фенилкетонурия В печени здоровых людей небольшая часть фенилаланина (∼10%) превращается в фенил-лактат и фенилацетилглутамин. Этот путь катаболизма фенилаланина становится главным при нарушении основного пути - превращения в тирозин, катализируемого фенил-аланингидроксилазой. Такое нарушение сопровождается гиперфенилаланинемией и повышением в крови и моче содержания метаболитов альтернативного пути: фенилпирувата, фенилацетата, фениллактата и фенилацетилглу-тамина.
Дефект фенилаланингидроксилазы приводит к заболеванию фенилкетонурия (ФКУ). Выделяют 2 формы ФКУ:
Классическая ФКУ - наследственное заболевание, связанное с мутациями в гене фенилаланингидроксилазы, которые приводят к снижению активности фермента или полной его инактивации. При этом концентрация фенилаланина повышается в крови в 20-30 раз (в норме - 1,0-2,0 мг/дл), в моче - в 100-300 раз по сравнению с нормой (30 мг/дл). Концентрация фенилпирувата и фениллактата в моче достигает 300-600 мг/дл при полном отсутствии в норме. Наиболее тяжёлые проявления ФКУ - нарушение умственного и физического развития, судорожный синдром, нарушение пигментации. При отсутствии лечения больные не доживают до 30 лет. Частота заболевания - 1:10 000 новорождённых. Заболевание наследуется по аутосомно-рецессивному типу. Тяжёлые проявления ФКУ связаны с токсическим действием на клетки мозга высоких концентраций фенилаланина, фенилпирувата, фениллактата. Большие концентрации фенилаланина ограничивают транспорт тирозина и триптофана через гематоэнцефаличеекий барьер и тормозят синтез нейро-медиаторов (дофамина, норадреналина, серотонина).
Вариантная ФКУ (коферментзависимая гиперфенилаланинемия) - следствие мутаций в генах, контролирующих метаболизм Н4БП. Клинические проявления - близкие, но не точно совпадающие с проявлениями классической ФКУ. Частота заболевания - 1-2 случая на 1 млн новорождённых. Н4БП необходим для реакций гидроксилирования не только фенилаланина, но также тирозина и триптофана, поэтому при недостатке этого кофермента нарушается метаболизм всех 3 аминокислот, в том числе и синтез ней-ромедиаторов. Заболевание характеризуется тяжёлыми неврологическими нарушениями и ранней смертью ("злокачественная" ФКУ).
Прогрессирующее нарушение умственного и физического развития у детей, больных ФКУ, можно предотвратить диетой с очень низким содержанием или полным исключением фенилаланина. Если такое лечение начато сразу после рождения ребёнка, то повреждение мозга предотвращается. Считается, что ограничения в питании могут быть ослаблены после 10-летнего возраста (окончание процессов миелинизации мозга), однако в настоящее время многие педиатры склоняются в сторону "пожизненной диеты".
Для диагностики ФКУ используют качественные и количественные методы обнаружения патологических метаболитов в моче, определение концентрации фенилаланина в крови и моче. Дефектный ген, ответственный за фенилкетонурию, можно обнаружить у фенотипически нормальных гетерозиготных носителей с помощью теста толерантности к фенилаланину. Для этого обследуемому дают натощак ∼10 г фенилаланина в виде раствора, затем через часовые интервалы берут пробы крови, в которых определяют содержание тирозина. В норме концентрация тирозина в крови после фенилаланиновой нагрузки значительно выше, чем у гетерозиготных носителей гена фежилкетонурии. Этот тест используется в генетической консультации для определения риска рождения больного ребёнка. Разработана схема скрининга для выявления новорождённых детей с ФКУ. Чувствительность теста практически достигает 100%. В настоящее время диагностику мутантного гена, ответственного за ФКУ, можно проводить с помощью методов ДНК-диагностики (рестрикционного анализа и ПЦР).
Для осуществления биологической функции в нервных клетках требуется определённая концентрация
В связи с этим большое значение приобретают механизмы инактивации биогенных аминов.
Инактивация биогенных аминов происходит двумя путями:
1) метилированием с участием SAM под действием метилтрансфераз. Таким образом могут инактивироваться различные биогенные амины, но чаще всего происходит инактивация гастамина и адреналина. Так, инактивация адреналина происходит путём метилирования гидроксильной группы в ортоположении .
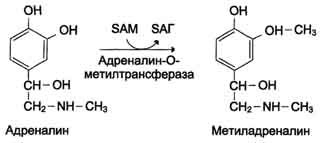
Реакция инактивации гистамина также преимущественно происходит путём метилирования
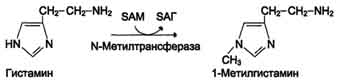
2) окислением ферментами моноаминооксидазами (МАО) с коферментом FAD - таким путем. Чаще происходит инактивация дофамина, норадреналина, серотонина, ГАМК. При этом происходит окислительное дезаминирование биогенных аминов с образованием альдегидов, а затем соответствующих кислот, которые выводятся почками
