
- •3. Значение кровообращения для жизнедеятельности организма.
- •2. История развития учения о кровообращении.
- •4. Методы исследования кровяного давления в эксперименте.
- •5. Волны 1-го, 2-го и 3-го порядка и механизм их возникновения.
- •6. Понятие о среднем динамическом артериальном давлении (и.М.Сеченов).
- •9. Морфофункциональная классификация сосудов.
- •10. Основные законы гемодинамики.
- •11. Артериальное давление и факторы, его определяющие.
- •12. Минутный объем и общее периферическое сопротивление сосудов.
- •13. Давление крови в различных участках сосудистого русла.
- •14. Систолическое, диастолическое, пульсовое и среднее артериальное давление. Их нормальные величины.
- •15. Методы определения артериального давления у человека и животных.
- •17. Принцип и техника определения артериального давления по методу Рива-Роччи и Короткова.
- •18. Генез «Коротковских тонов» при определении артериального давления.
- •19. Регуляция артериального давления и роль сосудистых рефлексогенных зон.
- •20. Сосудодвигательный центр и его значение.
- •21. Симпатическая и парасимпатическая иннервация сосудов (а. П. Вальтер, к. Бернар).
- •22. Влияние симпатических адренергических волокон на тонус сосудов.
- •23. Роль 1-, 2- и 2-рецепторов гладких мышечных клеток стенки сосудов в формировании характера ответной реакции.
- •24. Влияние симпатических холинергических волокон на тонус сосудов.
- •25. Влияние парасимпатической нервной системы на тонус сосудов.
- •26. Роль м-холинорецепторов гладкомышечных клеток сосудов.
- •27. Рефлекторная регуляция сосудистого тонуса. Сосудистые рефлексогенные зоны.
- •1.Основные рефлексогенные зоны сосудистого русла:
- •2.Внесосудистые рефлексогенные зоны. Основные рецепторы рефлексогенных зон сердечнососудистой системы:
- •28. Механизм баро- и хеморецепторных рефлексов.
- •29. Роль спинальных, бульбарных, гипоталамических и корковых сосудистых центров в регуляции кровяного давления.
- •30. Гуморальная регуляция сосудистого тонуса.
- •34. Движение крови по венам и факторы, его обеспечивающие
- •35. Давление крови в венах разного калибра.
- •36. Методы определения венозного давления.
- •37. Понятие о венном пульсе.
- •40. Систолический объем, его величина и методы определения.
- •41. Сердечный индекс и его величина.
- •45. Понятие об общем периферическом сопротивлении сосудов, роль в гемодинамике
- •46. Способы расчета общего периферического сопротивления сосудов в абсолютных и условных единицах.
- •48. Объем циркулирующей крови и его величина
- •49. Механизмы регуляции и методы определения объема циркулирующей крови.
- •58. Рефлекторная регуляция тонуса сосудов.
- •59. Роль баро- и хеморецепторов в рефлекторной регуляции тонуса сосудов.
- •60. Система краткосрочной регуляции артериального давления и ее механизмы.
- •63. Местные механизмы саморегуляции сосудистого тонуса.
- •71. Понятие о свойствах пульса (ритмичность, частота) и их клиническое значение.
- •72. Артериальный пульс, механизмы его возникновения.
- •73. Способы регистрации сфигмограммы.
- •74. Элементы сфигмограммы.
- •75. Клиническое значение сфигмографии.
- •76. Механизм и скорость распространения пульсовой волны.
- •81. Размеры капилляра.
- •82. Величина давления и скорость кровотока в капиллярах.
- •83. Механизм регуляции кровотока в капиллярах.
- •1. Что называется дыханием?
- •2. Основные стадии процесса дыхания.
- •3. Частота и глубина дыхания.
- •4. Методика регистрации дыхательных движений гк
- •5. Биомеханика вдоха и выдоха.Дыхательные мышцы, их классификация и роль.Характеристика движения ребер.Роль диафрагмы, значение радиуса ее кривизны.
- •6. Растяжимость легких, ее величина. Роль эластических структур и поверхностного натяжения. Физиологические фующии сурфактанта.
- •7. Эластическая отдача гк, динамика ее величины и направления в зависимости от глубины вдоха.
- •8. Сопротивление дыхательных путей.Его величина и факторы, ее определяющие.Регуляция просвета воздухоносных путей.
- •9. Работа дыхательных мышц и потребление ими кислорода в зависимости от величины минутного объема дыхания.
- •11. Влияние фаз дыхания на величину давления в плевральной полости
- •12. Величина давления в плевральной полости и причины , ее обуславливающие.
- •13. Влияние фаз дыхания на величину давления в плевральной полости
- •14. Пневматоракс и его виды
- •15. Значение межn.Т1еврального давления для дыхания.
- •16. Способы измерения межплеврального давления и эластической тяги легких.
- •17. Изменениядавления в воздухоносных путях в зависимости от фаз дыхания.
- •18. Изменение внутриплеврального и внутриальвеолярного давления в различные фазы дыхательного ци1-:ла.
- •19. Понятие о транспульмональном и трансдиафрагмальном давлении.
- •20. Статические легочные объемы и емкости
- •21. Общая емкость легких (оел) и величины ее составляющие. Величина жизненной емкости легких (жел) и фа1поры, ее определения
- •22, Остаточиый объем (00), еговеличина и определение
- •23. Чтоназывается жел? Величина и факторы, ее определения
- •25. Емкость вдоха (ев) и ее величина
- •26. Функциональная остаточная емкость (фое) и ее величина
- •27. Методы расчета должной величины жизненной емкости легких (джел)
- •28. 0Бъем и емкость закрытия, их зависимость от возраста
- •30. Возрастные изменения величины общей емкости легких (оел), жизненной емкости (жел) и остаточного объема
- •30. Определение жел и величин , ее составляющих
- •31. Значение величины легочных объемов и ем1-:остей для оценки функц показателей легких
- •33. Анатомическое мертвое пространство. Его функц особенности и методы определения
- •33 Альвеолярное мертвое пространство. Физиологическое мертвое пространств
- •35. Динамические объемы и емкости легких
- •36. Методы исследования динамических показателей внешнего дыхания
- •40. Индекс Тиффно, его ве.R1ичина и к.R1иническое значение
- •Вопрос 41. График зависимости объемных скоростей потоков от объема легких в период вдоха и выдоха - «петля поток объем» (инфа из инета)
- •Вопрос 42. Пин:овая объемная с1{орость экспираторного потока, ее ве.1ш чина и клиническое значение.
- •Вопрос 43. Газовый состав атмосферного, выдыхаемого и альвеолярного воздуха.
- •Что называется вентиляцией легких?
- •Что называется гипервентиляцией?
- •Как влияет гипервентиляция на содержание угле1(ислого газа в крови?
- •Механизм увеличения продолжительности задержки дыхания после гипервентиляции
- •Как влияет задержка дыхания на содержание кислорода в крови?
- •Дыхательный центр, его локализация, двигательные и гомеостатичес, ая функции.
- •Фушщии ядер пневмотаксического центра
- •Роль углекислого газа и других продуктов метаболизма в регуляции дыхания (вопрос взят с интернета )
- •Центральная и периферические хеморецепторы, обеспечивающие рефлекторную регуляцию дахания.
- •Значение кислорода в регуляции дыхания.
- •Функциональная система дыхания, обеспечивающая постоянства газового состава крови.
- •Механизм генерации дыхательного ритма.
- •Гуморальная регуляция дыхания
- •Физиологическое влияние сна на параметры дыхания.
- •Синдром сонного апноэ.
- •Влияние физической нагрузки на частоту и глубину дыхательных движений.
- •Фазовый характер изменения дыхания при физической нагрузке. Понятие об анаэробном пороге
- •Динамика нейрогенных и гуморальных механизмов легочной вентиляции при физической нагрузке
- •Влияние на дыхание пониженного барометрического давления
- •Дыхание при повышенном барометрическом давлении. Понятие о кессонной болезни.
- •Дыхательный центр, его локализация, функциональная характеристика и нейрональная
- •Рефлекторный механизм вдоха и выдоха. Роль блуждающих нервов регу.11яции дыхания.
- •Какие дыхательные рефлексы назфваюся защитными?
- •Каково значение защитных дыхательных рефлексов?
- •Механизм кашлевого и чихательного рефлексрв.
- •Роль слизистой оболочки дыхательных путей в кондиционировании температуры и влажности.
- •Механическая очистка вдыхаемого воздуха от инородных частиц и микроорганизмов. Роль вол сяного фильтра слизистой носа, секретируемой слизи мерцательного эпителия,
- •Механизмы регуляции секреции слизи и двигательной активности ресничек слизистой оболочки воздухоностных путей.
76. Механизм и скорость распространения пульсовой волны.
Пульсовые колебания кровотока, давления и оъёма распространяются в упругой жидкой среде (в потоке крови) в виде пульсовой волны.
Скорость распространения пульсовой волны выше, чем скорость кровотока.
Она зависит (1) от растяжимости стенки сосуда, (2) от отношения толщины стенки сосуда к радиусу.
Чем меньше растяжимость и толще стенка, тем больше скорость распрост-ранения пульсовой волны:
аорта – 4-6 м/сек
лучевая а. – 8-12 м/сек
С возрастом скорость увеличивается, т.к. развивается склероз сосудов.
При гипертонии напряжение сосудистой стенки (тонус) увеличивается, поэтому скорость распространения пульсовой волны также увеличивается.
77. Факторы, определяющие скорость распространения пульсовой волны.
78. Клиническое значение определения скорости распространения пульсовой волны.
79. Виды капилляров, их физиологическое значение.
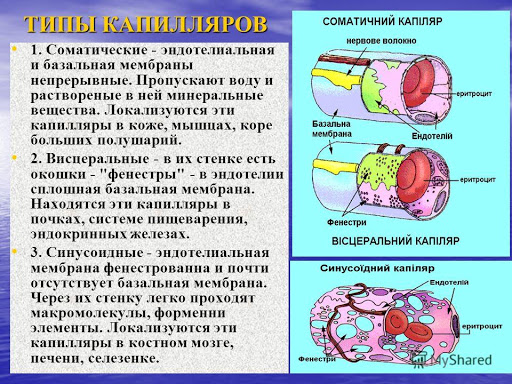
80. Количество капилляров, приходящееся на 1 мм2 поперечного сечения скелетной мышцы и миокарда.
В тканях, отличающихся интенсивным обменом веществ, число капилляров на 1 мм2 поперечного сечения больше, чем в тканях, в которых обмен веществ менее интенсивный. Так, в сердце на 1 мм2 сечения в 2 раза больше капилляров, чем в скелетной мышце. В сером веществе мозга, где много клеточных элементов, капиллярная сеть значительно более густая, чем в белом.
В скелетной мышце в состоянии покоя на 1 мм2 поперечного сечения приходится около 30 открытых, т. е. функционирующих, капилляров, а при максимальной работе мышцы число открытых капилляров на 1 мм2 возрастает в 100 раз
81. Размеры капилляра.

82. Величина давления и скорость кровотока в капиллярах.

83. Механизм регуляции кровотока в капиллярах.
1) Прекапиллярная миогенная саморегуляция через дилатацию гладких мышечных клеток в артериях и артериолах, поддержание тонуса сосудов, изменение их просвета и гидродинамического сопротивления кровотоку – в сосудах головного мозга, миокарда, печени, кишечника, скелетных мышц.
2) Метаболическая саморегуляция расширения капилляров посредством рецепции повышенной концентрации СО2, пирувата, лактата, ионов Н, неорганического фосфата, аденозина, ионов внеклеточного К, Са, Na, Mg и др. метаболитов, особенно при мышечной деятельности;
3) Гуморальная регуляция просвета сосудов под воздействием гистамина, серотонина, брадикинина и других биологически активных веществ в крови;
4) Гормональная регуляция тонуса, просвета и кровотока под воздействием циркулирующих в крови катехоламинов (адреналина и норадреналина), ангиотензина, вазопрессина, кортикоидов, тироксина, инсулина, воздействующих на специфические хеморецепторы сосудистых мембран в зависимости от концентрации гормона в крови.
84. Артериовенозные анастомозы и их значение.
Артериовенозные анастомозы (их много в коже, легких, почках, печени) обеспечивают: перераспределение крови в работающем органе, поддержание постоянной температуры в определенном участке тела и увеличение притока крови к сердцу.
85. Методы исследования капилляров у человека.
Капилляроскопия (от лат. capillaris — волосяной и др.-греч. σκοπέω — смотрю) — это неинвазивный метод исследования капилляров мягких тканей. На основании состояния капилляров делаются выводы о микроциркуляции человека.

86. Понятие о микроциркуляции.
Микроциркуля́ция (др.-греч. μικρός — «малый» + лат. circulatio — «круговращение») — транспорт биологических жидкостей на тканевом уровне[1]. Основная функция микроциркуляции состоит в транспорте клеток крови и веществ к тканям и от тканей. Кроме того, микроциркуляция участвует в процессах терморегуляции, формировании цвета и консистенции мочи.
87. Характеристика микроциркуляторного русла.
Микроциркуляторное русло – это система мелких сосудов, включающая артериолы, гемокапилляры, венулы, а также артериоловенулярные анастомозы. Этот функциональный комплекс кровеносных сосудов, окруженный лимфатическими капиллярами и лимфатическими сосудами, вместе с окружающей соединительной тканью обеспечивает регуляцию кровенаполнения органов, транскапиллярный обмен и дренажно-депонирующую функцию. Сосуды микроциркуляторного русла пластичны при изменении кровотока. Они могут депонировать форменные элементы или быть спазмированы и пропускать лишь плазму, изменять проницаемость для тканевой жидкости.
Вопросы к итоговому занятию по теме «Физиология крови»
Внутренняя среда организма (кровь, лимфа, тканевая жидкость) и ее значение.
Понятие о внутренней среде организма было введено в 1865 г. Клодом Бернаром. Она представляет собой совокупность жидкостей организма, омывающих все органы и ткани и принимающих участие в обменных процессах, и включает плазму крови, лимфу, межтканевую, синовиальную и цереброспинальную жидкости. Кровь называют универсальной жидкостью, так как для поддержания нормального функционирования организма в ней должны содержаться все необходимые вещества, т. е. внутренняя среда обладает постоянством – гомеостазом. Но это постоянство относительно, так как все время происходит потребление веществ и выделение метаболитов – гомеостазис. При отклонении от нормы формируется функциональная система, осуществляющая восстановление измененных показателей.
Гомеостаз характеризуется определенными среднестатистическими показателями, которые могут колебаться в небольших пределах и иметь сезонные, половые и возрастные отличия.
Таким образом, по определению П. К. Анохина, все биологические константы делятся на жесткие и пластичные. Жесткие могут колебаться в небольших пределах без значительных нарушений жизнедеятельности. К ним относятся pH крови, величина осмотического давления, концентрация ионов Na, R, Ca в плазме крови. Пластичные могут варьироваться в значительных пределах без каких-либо последствий для организма. К этой группе принадлежат величина кровяного давления, уровень глюкозы, жиров, витаминов и т. д.
Внутренняя среда обеспечивает возможность поступления в клетки необходимых для их жизнедеятельности веществ и вывод продуктов обмена. Благодаря поддержанию определенного состава внутренней среды клетки функционируют в постоянных условиях.
Кровь — внутренняя среда организма, образованная жидкой соединительной тканью. Состоит из плазмы и форменных элементов: клеток лейкоцитов и постклеточных структур (эритроцитов и тромбоцитов).
Лимфа-— разновидность соединительной ткани. Функция лимфы — возвращение белков, воды, солей, токсинов и метаболитов из тканей в кровь.
Тканевая жидкость образуется из жидкой части крови — плазмы, проникающей через стенки кровеносных сосудов в межклеточное пространство. Между тканевой жидкостью и кровью происходит обмен веществ. Часть тканевой жидкости поступает в лимфатические сосуды, образуется лимфа, которая движется по лимфатическим сосудам. По ходу лимфатических сосудов находятся лимфатические узлы, которые играют роль фильтра. Из лимфатических сосудов лимфа изливается в вены, то есть возвращается в кровяное русло.
Понятие о гомеостазе.
Сохранение постоянства внутренней среды называется гомеостазом.
В организме на относительно постоянном уровне поддерживаются кровяное давление, температура тела, осмотическое давление крови и тканевой жидкости, содержание в них белков и сахара, ионов натрия, калия, кальция, хлора и др. Гомеостаз поддерживается комплексом динамических процессов. Значительная роль в поддержании гомеостаза принадлежит регуляторным системам - нервной и эндокринной. Сохранение постоянства внутренней среды возможно только при функционировании системы дыхания, сердечно-сосудистой системы, органов пищеварения и выделения.
Система крови.
Понятие системы крови было введено в 1830-х гг. Х. Лангом. Кровь – это физиологическая система, которая включает в себя:
1) периферическую (циркулирующую и депонированную) кровь;
2) органы кроветворения;
3) органы кроверазрушения;
4) механизмы регуляции.
Система крови обладает рядом особенностей:
1) динамичностью, т. е. состав периферического компонента может постоянно изменяться;
2) отсутствием самостоятельного значения, так как все свои функции выполняет в постоянном движении, т. е. функционирует вместе с системой кровообращения.
Ее компоненты образуются в различных органах.
Гематокрит – отношение объема форменных элементов крови к общему объему крови (36-48%). Поскольку объем форменных элементов определяется практически только количеством эритроцитов при помощи центрифугирования крови (сравните: 4-5*1012 эритроцитов и 4,5-9*109 лейкоцитов, т.е., в 1000 раз меньше), то и гематокрит в основном зависит от количества эритроцитов.
Количество крови в организме и ее состав.
Объем крови составляет 6-8% от массы тела. У детей количество крови относительно больше: у новорожденных оно ' составляет в среднем 15% от массы тела, а у детей в возрасте 1 года —11%. В физиологических условиях не вся кровь циркулирует в кровеносных сосудах, часть ее находится в так называемых кровяных депо (печень, селезенка, легкие, сосуды кожи). Общее количество крови в организме сохраняется на относительно постоянном уровне.
Периферическая кровь состоит из жидкой части — плазмы и взвешенных в ней форменных элементов или кровяных клеток (эритроцитов, лейкоцитов, тромбоцитов)
Гематокритный показатель.
- объёмное соотношение форменных элементов и плазмы,. В норме этот показатель равен 40-45%
Объемные соотношения плазмы и форменных элементов определяют с помощью гематокрита. В периферической крови плазма составляет приблизительно 52—58% объема крови, а форменные элементы 42— 48%.
Физико-химические свойства крови.
Кровь является суспензий, так как состоит из взвешенных в плазме форменных элементов – лейкоцитов, тромбоцитов и эритроцитов. Соотношение плазмы и форменных элементов зависит от того, где находится кровь. В циркулирующей крови преобладает плазма – 50–60 %, содержание форменных элементов – 40–45 %. В депонированной крови, наоборот, плазмы – 40–45 %, а форменных элементов – 50–60 %. Для определения процентного соотношения плазмы и форменных элементов вычисляют гематокритный показатель. В норме он составляет у женщин 42 ± 5 %, а у мужчин – 47 ± 7 %.
Физико-химические свойства крови обусловлены ее составом:
1) суспензионное;
2) коллоидное;
3) реологическое;
4) электролитное.
Суспензионное свойство связано со способностью форменных элементов находиться во взвешенном состоянии. Коллоидное свойство обеспечивается в основном белками, которые могут удерживать воду (лиофильные белки). Электролитное свойство связано с наличием неорганических веществ. Его показателем является величина осмотического давления. Реологическая способность обеспечивает текучесть и влияет на периферическое сопротивление.
Цвет: артериальная – ярко-красная за счет содержания в эритроцитах только оксигемоглобина, венозная – темно-красная за счет наличия восстановленного HHb.
Относительная плотность 1,052-1,062
Вязкость крови 4,0-5,0 (относительно воды)
Температура крови 37-40°С
Осмотическое давление крови 7,3-7,6 атм. Определяется криоскопическим методом: π=СмRT, где π – осмотическое давление, См – молярная концентрация (моль/л), R – универсальная газовая постоянная, Т – температура; См=Δt/К, следовательно π= ΔtRT/К. Депрессия точки замерзания крови составляет 0,54-0,58°С (по сравнению с водой)
Онкотическое давление - давление, формируемое за счет белков, в основном альбуминов, что связано с их меньшей молекулярной массой и большим количеством молекул (осмотическое давление зависит не от молекулярной массы растворенного вещества, а количества его частиц в растворе). Составляет около 28 мм.рт.ст.
рН 7,36(венозная кровь)-7,44(артериальная кровь), такой узкий коридор обеспечивается наличием буферных систем крови: бикарбонатной, фосфатной, белковой и гемоглобиновой (самой мощной из них). Они временно связывают избыток кислых продуктов метаболизма, образующихся в результате интенсивной работы, которые затем постепенно выводятся почками и легкими. Таким образом, большое количество кислых продуктов метаболизма не вызывает сильного уменьшения рН и нарушения работы клеток организма.
Суспензионная устойчивость крови – способность крови находиться в виде суспензии. Количественный показатель, оценивающий суспензионную устойчивость крови – скорость оседания эритроцитов (СОЭ). Факторы, обеспечивающие суспензионную устойчивость крови – гидрофильная поверхность эритроцитов и отрицательный заряд на их поверхности. Изменение белкового состава (увеличение фибриногена, γ-глобулина, парапротеинов и др., наблюдающееся при воспалительных и онкологических заболеваниях) крови может приводить к уменьшению отрицательного заряда эритроцитов, следовательно, повышению СОЭ и уменьшению суспензионной устойчивости крови, что снижает функциональные возможности крови. Нормальные значения СОЭ: новорожденные – 1-2 мм/ч, у детей старше года и мужчин – 6-12 мм/ч, у женщин – 8-15 мм/ч, у пожилых – 15-20 мм/ч)
Факторы, определяющие вязкость крови.
Состав плазмы.
Характеристика белков, углеводов, липидов, минеральных веществ плазмы и их значение.
Небелковые азотистые компоненты плазмы и их значение.
Альбуминово-глобулиновый коэффициент.
90-92% вода
8-10% сухой остаток (органические и неорганические вещества)
Жесткие и пластичные константы.
Органические вещества в основном представлены белками – 7-8% от массы плазмы. Белки: альбумины (4-5%), глобулины (до 3%) и фибриноген (0,2-0,4%).
Фракции глобулинов: α1, α2, β и γ (разделены на основании разной скорости движения при электрофорезе)
Плазма составляет жидкую часть крови и является водно-солевым раствором белков. Состоит на 90–95 % из воды и на 8—10 % из сухого остатка. В состав сухого остатка входят неорганические и органические вещества. К органическим относятся белки, азотосодержащие вещества небелковой природы, безазотистые органические компоненты, ферменты.
Белки составляют 7–8 % от сухого остатка (что составляет 67–75 г/л) и выполняют ряд функций. Они отличаются по строению, молекулярной массе, содержанию различных веществ. При увеличении концентрации белков возникает гиперпротеинемия, при уменьшении – гипопротеинемия, при появлении патологических белков – парапротеинемия, при изменении их соотношения – диспротеинемия. В норме в плазме присутствуют альбумины и глобулины. Их соотношение определяется белковым коэффициентом, который равняется 1,5–2,0.
Альбумины – мелкодисперсные белки, молекулярная масса которых 70 000—80 000 Д. В плазме их содержится около 50–60 %, что составляет 37–41 г/л. В организме они выполняются следующие функции:
1) являются депо аминокислот;
2) обеспечивают суспензионное свойство крови, поскольку являются гидрофильными белками и удерживают воду;
3) участвуют в поддержании коллоидных свойств за счет способности удерживать воду в кровеносном русле;
4) транспортируют гормоны, неэтерефицированные жирные кислоты, неорганические вещества и т. д.
При недостатке альбуминов возникает отек тканей (вплоть до гибели организма).
Глобулины – крупнодисперсные молекулы, молекулярная масса которых более 100 000 Д. Их концентрация колеблется в пределах 30–35 %, что составляет около 30–34 г/л. При электрофорезе глобулины распадаются на несколько видов:
1) β1– глобулины;
2) β2-глобулины;
3) β-глобулины;
4) γ-глобулины.
За счет такого строения глобулины выполняют различные функции:
1) защитную;
2) транспортную;
3) патологическую.
Защитная функция связана с наличием иммуноглобулинов – антител, способных связывать антигены. Также они входят в состав защитных систем организма, такие как – системы пропердина и комплемента, обеспечивая неспецифическую резистентность организма. Участвуют в процессах свертывания крови за счет наличия фибриногена, занимающего промежуточное положение между β-глобулинами и γ-глобулинами, являющимися источником фибриновых нитей. Образуют в организме систему фибринолиза, основным компонентом которой является плазминоген.
Транспортная функция связана с переносом металлов с помощью гаптоглобина и церулоплазмина. Гаптоглобин относится к β2-глобулинам и образует комплекс с трансферрином, сохраняющим для организма железо. Церулоплазмин является β2-глобулином, который способен соединять медь.
Патологические глобулины образуются в ходе воспалительных реакций, поэтому в норме не обнаруживаются. К ним относятся интерферон (образуется при внедрении вирусов), С-реактивный белок, или белок острой фазы (является β-глобулином и присутствует в плазме при тяжелых, хронических заболеваниях).
Таким образом, белки обеспечивают физико-химические свойства крови и выполняют защитную функцию.
В плазме также содержатся аминокислоты, мочевина, мочевая кислота, креатинин;
Их содержание невелико, поэтому они обозначаются как остаточный азот крови. В норме он составляет примерно 14,3—28,6 %. Уровень остаточного азота поддерживается за счет наличия белков в пище, выделительной функции почек и интенсивности белкового обмена.
Органические вещества в плазме представлены в виде продуктов обмена углеводов и липидов. Компоненты обмена углеводов:
1) глюкоза, содержание которой в норме составляет 4,44– 6,66 ммоль/л в артериальной крови и 3,33—5,55 ммоль/л в венозной и зависит от количества углеводов в пище, состояния эндокринной системы;
2) молочная кислота, содержание которой резко повышается при критических состояниях. В норме ее содержание равно 1–1,1 ммоль/л;
3) пировиноградная кислота (образуется при утилизации углеводов, в норме содержится приблизительно 80–85 ммоль/л). Продуктом липидного метаболизма является холестерин, участвующий в синтезе гормонов, желчных кислот, построении клеточной мембраны, выполняющий энергетическую функцию. В свободном виде он представлен в форме липопротеидов – комплекса белков и липидов. Выделяют пять групп:
1) хиломикроны (участвуют в транспорте триацилглицеридов экзогенного происхождения, образуются в эндоплазматической сети энтероцитов);
2) липопротеиды очень низкой плотности (переносят триацилглицериды эндогенного происхождения);
3) липопротеиды низкой плотности (доставляют холестерин к клеткам и тканям);
4) липопротеиды высокой плотности (образуют комплексы с холестерином и фосфолипидами).
Биологически активные вещества и ферменты относятся к группе веществ, обладающих высокой энзимной активностью, на их долю приходится 0,1 % сухого остатка.
Неорганические вещества являются электролитами, т. е. анионами и катионами. Они выполняют ряд функций:
1) регулируют осмотическое давление;
2) поддерживают pH крови;
3) участвуют в возбуждении клеточной мембраны.
У каждого элемента имеются свои функции:
1) йод необходим для синтеза гормонов щитовидной железы;
2) железо входит в состав гемоглобина;
3) медь катализирует эритропоэз.
Осмотическое давление крови обеспечивается за счет концентрации в крови осмотически активных веществ, т. е. это разность давлений между электролитами и неэлектролитами.
Осмотическое давление относится к жестким константам, его величина 7,3–8,1 атм. Электролиты создают до 90–96 % всей величины осмотического давления, из них 60 % – хлорид натрия, так как электролиты имеют низкую молекулярную массу и создают высокую молекулярную концентрацию. Неэлектролиты составляют 4—10 % величины осмотического давления и обладают высокой молекулярной массой, поэтому создают низкую осмотическую концентрацию. К ним относятся глюкоза, липиды, белки плазмы крови. Осмотическое давление, создаваемое белками, называется онкотическим. С его помощью форменные элементы поддерживаются во взвешенном состоянии в кровеносном русле. Для поддержания нормальной жизнедеятельности необходимо, чтобы величина осмотического давления всегда была в пределах допустимой нормы.
Эритроциты, их форма, цитометрические показатели и строение.
Эритроциты – красные кровяные тельца, содержащие дыхательный пигмент – гемоглобин. Эти безъядерные клетки образуются в красном костном мозге, а разрушаются в селезенке. В зависимости от размеров делятся на нормоциты, микроциты и макроциты. Примерно 85 % всех клеток имеет форму двояковогнутого диска или линзы с диаметром 7,2–7,5 мкм. Такая структура обусловлена наличием в цитоскелете белка спектрина и оптимальным соотношением холестерина и лецитина. Благодаря данной форме эритроцит способен переносить дыхательные газы – кислород и углекислый газ. Ядро отсутствует, так как: 1)Ядро самая кислород потребляющая структура клетки; 2)Освобождается дополнительное место для ННb; 3)Появляется возможность принять форму двояковогнутого диска
Эритроциты обладают физиологическими и физико-химическими свойствами:
1) пластичностью;
2) осмотической стойкостью;
3) наличием креаторных связей;
4) способностью к оседанию;
5) агрегацией;
6) деструкцией.
Пластичность во многом обусловлена строением цитоскелета, в котором очень важным является соотношение фосфолипидов и холестерина. Это соотношение выражается в виде липолитического коэффициента и в норме составляет 0,9. Пластичность эритроцитов – способность к обратимой деформации при прохождении через узкие капилляры и микропоры. При снижении количества холестерина в мембране наблюдается снижение стойкости эритроцитов.
Осмотическое давление в клетках немного выше, чем в плазме, за счет внутриклеточной концентрации белков. Также на осмотическое давление оказывает влияние и минеральный состав (в эритроцитах преобладает калий и снижено содержание ионов Na). За счет наличия осмотического давления обеспечивается нормальный тургор.
В настоящее время установлено, что эритроциты являются идеальным переносчиками, поскольку обладают креаторными связями, транспортируют различные вещества и осуществляют межклеточное взаимодействие.
Способность к оседанию обусловлена удельным весом клеток, который выше, чем все плазмы крови. В норме она невысока и связана с наличием белков альбуминовой фракции, которые способны удерживать гидратную оболочку эритроцитов. Глобулины являются лиофобными коллоидами, которые препятствуют образованию гидратной оболочки. Соотношение альбуминовой и глобулиновой фракций крови (белковый коэффициент) определяет скорость оседания эритроцитов. В норме он составляет 1,5–1,7.
При уменьшении скорости кровотока и увеличении вязкости наблюдается агрегация. При быстрой агрегации образуются «монетные столбики» – ложные агрегаты, которые распадаются на полноценные клетки с сохраненной мембраной и внутриклеточной структурой. При длительном нарушении кровотока появляются истинные агреганты, вызывающие образование микротромба.
Деструкция (разрушение эритроцитов) происходит через 120 дней в результате физиологического старения. Оно характеризуется:
1) постепенным уменьшением содержания липидов и воды в мембране;
2) увеличенным выходом ионов K и Na;
3) преобладанием метаболических сдвигов;
4) ухудшением способности к восстановлению метгемоглобина в гемоглобин;
5) понижением осмотической стойкости, приводящей к гемолизу.
Стареющие эритроциты за счет понижения способности к деформации застревают в миллипоровых фильтрах селезенки, где поглощаются фагоцитами. Около 10 % клеток подвергаются разрушению в сосудистом русле.
Количество эритроцитов в зависимости от пола и возраста.
Эритроциты являются самыми многочисленными форменными элементами крови. Так, у мужчин в норме содержится 4,5–5,5 × 1012/л, а у женщин – 3,7–4,7 × 1012/л. Однако количество форменных элементов крови изменчиво (их увеличение называется эритроцитозом, а при уменьшение – эритропенией).
Функции эритроцитов, значение формы и строения.
1) дыхательная;
2) питательная;
3) ферментативная;
4) защитная;
5) буферная.
Гемоглобин участвует в иммунологических реакциях.
Дыхательная функция связана с наличием гемоглобина и бикарбоната калия, за счет которых осуществляется перенос дыхательных газов.
Питательная функция связана со способностью мембраны клеток адсорбировать аминокислоты и липиды, которые с током крови транспортируются от кишечника к тканям.
Ферментативная функция обусловлена присутствием на мембране карбоангидразы, метгемоглобинредуктазы, глютатионредуктазы, пероксидазы, истинной холинэстеразы и др.
Защитная функция осуществляется в результате оседания токсинов микробов и антител, а также за счет присутствия факторов свертывания крови и фибринолиза.
П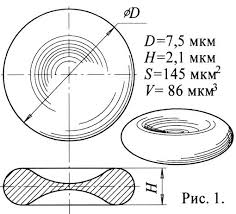 оскольку
эритроциты содержат антигены, то их
используют в иммунологических реакциях
для выявления антител в крови.
оскольку
эритроциты содержат антигены, то их
используют в иммунологических реакциях
для выявления антител в крови.
Преимущества формы двояковогнутого диска над сферической
Увеличение площади, как минимум, на 20% (по другим данным в 1,7 раза)
Повышенная пластичность благодаря избыточной, «мешковидной» мембране по сравнению с шаровидным эритроцитом, благодаря чему риск разрыва мембраны при прохождении через узкие пространства минимальный.
Компактность
Снижение диффузионного расстояния (расположение наиболее удаленной молекулы ННb от поверхности эритроцита)
Несмотря на то, что форма двояковогнутого диска энергетически не выгодна, эритроцит затрачивает дополнительное количество энергии на ее поддержание, чтобы получить эти преимущества.
Физиологический эритроцитоз и его виды.
Эритроцитоз – состояние, характеризующееся увеличением количества эритроцитов и Нb в единице объема крови, повышением гематокрита.
Эритроцитоз встречается не только при развитии в организме каких-то
нарушений (патологический эритроцитоз), но и в физиологических условиях
(физиологический эритроцитоз).
В зависимости от механизма возникновения эритроцитозы делятся на абсолютныеиотносительные.
При абсолютных эритроцитозах увеличение количества эритроцитов происходит вследствие стимуляции эритропоэза, поэтому возрастает общее число клеток во всей крови и соответственно в единице ее объема. Все физиологические эритроцитозы относятся к разряду абсолютных. Эритроцитоз новорожденных- это физиологический абсолютный эритроцитоз, т.к. у плода количество эритроцитов в крови выше, то после рождения какое-то время еще находят увеличенное количество клеток. Приблизительно через неделю количество эритроцитов у них становится нормальным.
К эритроцитозам такого же рода относится эритроцитоз у жителей горных местностей. Здесь вследствие гипоксии наблюдается стимуляция эритропоэза, которая при длительном прибывании в горах становится физиологической. Количество эритроцитов находится в прямой зависимости от высоты проживания.
АБСОЛЮТНЫЙ ЭРИТРОЦИТОЗ может быть ипатологическим, в этих случаях он обязан своим происхождением процессам, ведущим к гипоксии или действию химических веществ, повышающих эритропоэз (при заболеваниях легких, сердечной недостаточности раз-
личных типов, нарушениях внешнего дыхания).
Абсолютный патологический эритроцитоз наблюдается при отравлении медью, фосфором, кобальтом, марганцем и т.п. Возрастание количества эритроцитов в случаях действия этих веществ происходит в результате прямого стимулирования костного мозга.
Во всех случаях абсолютного патологического эритроцитоза устранение основного патологического процесса ведет к нормализации эритропоэза и количества эритроцитов в крови, т.е. увеличение количества эритроцитов является временной реакцией гемопоэтической ткани.
ОТНОСИТЕЛЬНЫЕ ЭРИТРОЦИТОЗЫ являются преимущественнопатологическими и связаны с уменьшением жидкой части крови и ее сгущением.
При относительных эритроцитозах увеличивается количество эритроцитов лишь в единице объема крови, а не во всей ее массе. Сгущение крови может происходить в случаях потери организмом больших количеств жидкостей при обильных рвоте, поносах, потоотделении. При холере число эритроцитов в одном литре может достигать 7-8x1012. При кризисе в течении ряда инфекционных заболеваний (малярии, пневмонии, возвратном тифе и др.),вследствие обильного потоотделения, наблюдается сгущение крови и повышение содержания эритроцитов. Определенную роль в сгущении крови при кризисе и в период выздоровления имеет обильное мочеотделение, также приводящее к значительной потере жидкости кровью.
Сгущение крови является постоянным признаком шока, вследствие происходящей плазмопотери.
Относительный эритроцитоз исчезает при ликвидации причин, его вызывающих.
Понятие об эритроне.
Эритрон – это морфо-функциональная единица системы крови включающая в себя органы эритропоэза и эритродиереза, пул циркулирующих в крови эритроцитов и механизмы регуляции, обеспечивающие баланс между эритропоэзом и эритродиерезом
Понятие о гемопоэзе.
Эритропоэз и факторы, его обеспечивающие.
Возрастные особенности кроветворения.
Кроветворение (гемопоэз) - процесс образования, развития и созревания клеток крови — лейкоцитов, эритроцитов, тромбоцитов. Кроветворение осуществляется кроветворными органами. Различают эмбриональный (внутриутробный) гемопоэз, который начинается на очень ранних стадиях эмбрионального развития и приводит к образованию крови как ткани, и постэмбриональный гемопоэз, который можно рассматривать как процесс физиологического обновления крови. Во взрослом организме непрерывно происходит массовая гибель форменных элементов крови, но отмершие клетки заменяются новыми, так что общее количество кровяных клеток сохраняется с большим постоянством
Эритропоэз – процесс образования эритроцитов. Основные факторы
Железо (хорошо усваивается из продуктов животного происхождения, для получения суточной нормы достаточно 100г красного мяса, например, говядины)
Витамин В9
Витамин В12 (для его всасывания необходим внутренний фактор Кастла (гастромукопротеин), вырабатываемый обкладочными клетками желудка. Поэтому, если имеются определенные проблемы с желудком (не любая проблема!!!), возможно возникновение витамин В12-дефицитной анемии)
Эритропоэтин – вырабатывается в почках (90%) и в других тканях, в основном в печени (10%) в ответ на гипоксии клеток этих органов. Попадая в кровь, стимулирует эритропоэз в крастном костном мозге. Самые частые причины гипоксии: 1)Анемия; 2)Кровопотеря; 3)Легочные заболевания; 4)Высокогорье;
Возрастная эволюция эритропоэза
В первые недели эритропоэз происходит в желточном мешке, к концу второй недели перемещается в печень, а в течение последнего месяца беременности происходит исключительно в красном костном мозге (ККМ). До 5-летнего возраста кроветворение происходит практически во всех костях. Постепенно ККМ длинных трубчатых костей замещается жировой тканью и примерно после 20 лет кроветворение происходит в плоских костях (грудина, подвздошные кости, позвоночник, ребра)
Гемолиз и его виды.
Гемолиз – выход HHb в плазму в результате разрыва оболочки эритроцита
Физиологический – старые эритроциты
Осмотический – при помещении в гипотонический раствор; минимальная осмотическая резистентность – разрушаются менее устойчивые эритроциты, прежде всего старые, при концентрации NaCl 0,42-0,48%; максимальная осмотическая резистентность – разрушаются все эритроциты при концентрации NaCl 0,30-0,34%.
Химический – например, НCl при определении количества ННb
Биологический - яды змей, содержащие лецитиназу, разрушающую оболочку эритроцитов
Механический - при длительном маршировании (маршевая гемоглобинурия, плоскостопие только увеличивает количество разрушенных эритроцитов при этом)
Термический
Иммунный - при переливании несовместимой крови или при резус-конфликте между матерью и плодом.
Осмотическая резистентность эритроцитов — их устойчивость по отношению к гипотоническим растворам натрия хлорида. Максимальная осмотическая резистентность ниже 0,32 % возможна после больших кровопотерь и спленэктомии, при гемоглобинозе С, застойных желтухах, а также в некоторых случаях полицитемии. Повышение осмотической резистентности эритроцитов ниже 0,32 % характерно для талассемии и гемоглобинопатии. Минимальная осмотическая резистентность выше 0,48 % наблюдается при семейной гемолитической анемии, гемолитической анемии новорожденных и отравлении свинцом
Границы осмотической стойкости эритроцитов.
Методы определения количества эритроцитов и их цитометрических показателей.
Одним из методов определения количества эритроцитов в крови является подсчет в счетной камере.такой метод позволяет лаборанту оценить не только количество эритроцитов, но и их структуру, диаметр.
Метод подсчета эритроцитов в счетной камере.
Кровь предварительно разводят с целью уменьшения числа клеток, подлежащих счету. В
химические пробирки отмеривают пипеткой по 4 миллилитра 3%-ного раствора хлорида натрия и осторожно выдувают в нее 0,02 миллилитра капиллярной крови. Взвесь тщательно перемешивают и затем заполняют камеру с сетками Горяева.Сетка Горяева состоит из 225 больших квадратов (15 х 15). Перед заполнением камеру и шлифованное покровное стекло моют и сушат. Каплю разведенной крови вносят пипеткой под притертое покровное стекло камеры. После заполнения камеру оставляют на 1—2 минуты в покое для оседания форменных элементов, затем приступают к подсчету при малом увеличении микроскопа в затемненном поле Эритроциты считают в 5 больших квадратах (5 х 16 = 80 малым квадратам), расположенных по диагонали. Считают только эритроциты на верхней и левой границе квадрата.
Количество эритроцитов в 1 миллилитре крови рассчитывают по формуле: (a * 4000 * 200) /80
где a - число подсчитанных эритроцитов,
4000 - приведение к объему 1 мкл крови,
200 - степень разведения,
80 - количество малых квадратов.
После сокращения, формула определения количества эритроцитов в крови выглядит следующим образом:
(а * 10 000) = млн/л
Данный метод подсчета эритроцитов занимает довольно длительное время - как минимум 20-30 минут.
Наиболее часто снижение количества эритроцитов происходит при анемиях. Одновременно снижается количество гемоглобина
Лейкоциты, их количество. Лейкоцитарная формула.
Лейкоциты – ядросодержащие клетки крови, размеры которых от 4 до 20 мкм. Продолжительность их жизни сильно варьируется и составляет от 4–5 до 20 дней для гранулоцитов и до 100 дней для лимфоцитов. Количество лейкоцитов в норме у мужчин и женщин одинаково и составляет 4–9 × 109/л. Однако уровень клеток в крови непостоянен и подвержен суточными и сезонным колебаниям в соответствии с изменением интенсивности обменных процессов.
Лейкоциты делятся на две группы: гранулоциты (зернистые) и агранулоциты.
Среди гранулоцитов в периферической крови встречаются:
1) нейтрофилы – 46–76 %;
2) эозинофилы – 1–5 %;
3) базофилы – 0–1 %.
В группе незернистых клеток выделяют:
1) моноциты – 2—10 %;
2) лимфоциты – 18–40 %.
Процентное содержание лейкоцитов в периферической крови называется лейкоцитарной формулой, сдвиги которой в разные стороны свидетельствуют о патологических процессах, протекающих в организме. Различают сдвиг вправо – понижение функции красного костного мозга, сопровождающееся увеличением количества старых форм нейтрофильных лейкоцитов. Сдвиг влево является следствием усиления функций красного костного мозга, в крови увеличивается количество молодых форм лейкоцитов. В норме соотношение между молодыми и старыми формами лейкоцитов составляет 0,065 и называется индексом регенерации. За счет наличия ряда физиологических особенностей лейкоциты способны выполнять множество функций. Важнейшими из свойств являются амебовидная подвижность, миграция (способность проникать через стенку неповрежденных сосудов), фагоцитоз.
Лейкоциты выполняют в организме защитную, деструктивную, регенеративную, ферментативную функции.
Защитное свойство связано с бактерицидным и антитоксическим действием агранулоцитов, участием в процессах свертывания крови и фибринолиза.
Деструктивное действие заключается в фагоцитозе отмирающих клеток.
Регенеративная активность способствует заживлению ран.
Ферментативная роль связана с наличием ряда ферментов.
Мануальные и автоматические методы исследования количества лейкоцитов.
Виды физиологических лейкоцитозов.
Пищевой. Возникает после приема пищи. При этом число лей-коцитов увеличивается незначительно (в среднем на 1—3 тыс. в мкл) и редко выходит за границу верхней физиологической нормы.
Миогенный. Наблюдается после выполнения тяжелой мышечной работы. Число лейкоцитов при этом может возрастать в 3—5 раз.
Эмоциональный. Как и лейкоцитоз при болевом раздражении, носит перераспределительный характер и редко достигает высоких показателей.
При беременности. Большое количество лейкоцитов скаплива-ется в подслизистой основе матки. Этот лейкоцитоз в основном носит местный характер. Его физиологический смысл состоит не только в предупреждении попадания инфекции в организм роженицы, но и в стимулировании сократительной функции матки.
Лейкопении встречаются только при патологических состо-яниях. Особенно тяжелая лейкопения может наблюдаться в случае поражения костного мозга -— острых лейкозах и лучевой болезни. При этом изменяется функциональная активность лейкоцитов, что приводит к нарушениям в специфической и неспецифической за-щите, попутным заболеваниям, часто инфекционного характера, и даже смерти.
Виды зернистых лейкоцитов, их функции.
гранулоциты — клетки, имеющие крупные сегментированные ядра и обнаруживающие специфическую зернистость цитоплазмы; в зависимости от способности воспринимать красители они подразделяются на
Нейтрофилы (фагоциты) составляют примерно 70% от общего числа лейкоцитов. Они способны протискиваться между клетками, образующими стенки капилляров и мигрировать по межклеточным пространствам различных тканей, направляясь к инфицированным участкам тела. 2. Эозинофилы отличаются присутствием в цитоплазме гранул, окрашивающихся эозином в красный цвет. Обычно на их долю приходится всего 1,5% от общего числа лейкоцитов, но при аллергических состояниях (например при астме или сенной лихорадке) их количество возрастает.. 3. Базофилы составляют 0,5% обшей популяции лейкоцитов. Базофилы синтезируют гепарин, белок, препятствующий свертыванию крови, и гистамин, инициирующий в частности воспалительную реакцию в поврежденных тканях, которая способствует их скорейшему заживлению
Виды незернистых лейкоцитов, их функции.
агранулоциты — клетки, не имеющие специфической зернистости и содержащие простое несегментированное ядро, к ним относятся
Моноциты (4%) образуются в костном мозге и содержат ядро бобовидной формы. В кровотоке они проводят всего 30- 40 ч, а затем выходят в окружающие ткани, становясь макрофагами.
Макрофаги фагоцитируют бактерии и другие относительно крупные частицы.
Лимфоциты (24%) образуются в тимусе (вилочковой железе) и лимфоидной ткани из клеток костномозгового происхождения. Различают два их основных типа — Т- и В-лимфоци-ты. Они индуцируют иммунные реакции или участвуют в них (способствуют образованию антител, отторжению трансплантатов и уничтожению опухолевых клеток). . Продолжительность жизни отдельного лимфоцита широко варьирует — от считанных дней до десяти с лишним лет.
Лейкопоэз и факторы его обеспечивающие.
— образование лейкоцитов; обычно протекает в кроветворной ткани костного мозга.
Процессы лейкопоэза
Лейкоцитопоэз (лейкопоэз) включает гранулоцитопоэз (гранулопоэз), лимфоцитопоэз (лимфопоэз) и моноцитопоэз (монопоэз).
Неспецифическая резистентность организма и ее механизмы.
Основное назначение лейкоцитов —участие в защитных реакциях организма против чужеродных агентов, способных нанести ему вред. Различают специфическую защиту, или иммунитет, и неспе-цифическую резистентность организма. Последняя, в отличие от иммунитета, направлена на уничтожение любого чужеродного агента. К неспецифической резистентности относятся фагоцитоз и пиноцитоз, система комплемента, естественная цитотоксичность, действие интерферонов лизоцима, (3-лизинов и других гуморальных факторов защиты.
Механизмы неспецифической резистентности, обеспечивающие устойчивость организма к действию инфекционных агентов.
1. Ареактивность клеток. 2. Физические и физико-химические факторы. 3. Биологические барьеры. 4. Антагонистические взаимоотношения между нормальной и патогенной микрофлорой. 5. Функционирование физиологической системы соединительной ткани. 6. Гуморальные факторы неспецифической резистентности. 7. Фагоцитоз. 8. Воспаление
Фагоцитоз— процесс, при котором специально предназначенные для этого клетки крови и тканей организма (фагоциты) захватывают и переваривают твёрдые частицы.
Фагоцитоз, его стадии и механизмы.
Основные этапы фагоцитарной реакции сходны для клеток обоих типов. Реакция фагоцитоза может быть подразделена на несколько этапов:
Хемотаксис. Ранее других клеток в очаг воспаления мигрируют нейтрофилы, существенно позже поступают макрофаги.
Адгезия фагоцитов к объекту. Обусловлена наличием на поверхности фагоцитов рецепторов для молекул, представленных на поверхности объекта (собственных или связавшихся с ним). При фагоцитозе бактерий или старых клеток организма хозяина происходит распознавание концевых сахаридных групп — глюкозы, галактозы, фукозы, маннозы и др., которые представлены на поверхности фагоцитируемых клеток.
Активация мембраны. На этой стадии осуществляется подготовка объекта к погружению. Происходит активация протеинкиназы С, выход ионов кальция из внутриклеточных депо..
Погружение. Происходит обволакивание объекта.
Образование фагосомы. Замыкание мембраны, погружение объекта с частью мембраны фагоцита внутрь клетки.
Образование фаголизосомы. Слияние фагосомы с лизосомами, в результате чего образуются оптимальные условия для бактериолиза и расщепления убитой клетки.
киллинг и расщепление. Велика роль клеточной стенки перевариваемой клетки. Основные вещества участвующие в бактериолизе: пероксид водорода, продукты азотного метаболизма, лизоцим и др.
Выброс продуктов деградации.
Фагоцитоз может быть:
завершённым (киллинг и переваривание прошло успешно);
незавершённым (для ряда патогенов фагоцитоз является необходимой ступенью их жизненного цикла, например, у микобактерий и гонококков).
Система комплемента, ее состав и функции.
Система комплемента — комплекс сложных белков, постоянно присутствующих в крови. Это каскадная система протеолитических ферментов, предназначенная для гуморальной защиты организма от действия чужеродных агентов, она участвует в реализации иммунного ответа организма. Является важным компонентом как врождённого, так и приобретённого иммунитета.
Функции системы комплемента:
усиление процессов Фагоцитоза путем выделения веществ, покрывающих патогенны или иммунные комплексы;
участие в воспалительных реакциях путем влияния на интенсивность выделения базофилами биологически активных веществ;
цитотоксическая функция, которая проявляется в образовании мембраноатакующего комплекса из поздних компонентов комплемента.
Понятие об иммунитете. Роль антигенов и антител.
Иммунитет— невосприимчивость, сопротивляемость организма к инфекциям и инвазиям чужеродных организмов (в том числе — болезнетворных микроорганизмов), а также воздействию чужеродных веществ, обладающих антигенными свойствами. Иммунные реакции возникают и на собственные клетки организма, измененные в антигенном отношении Антитела(иммуноглобулины)— особый класс гликопротеинов, присутствующих на поверхности В-лимфоцитов в виде мембраносвязанных рецепторов и в сыворотке крови и тканевой жидкости в виде растворимых молекул, и обладающих способностью очень избирательно связываться с конкретными видами молекул, которые в связи с этим называют антигенами. Антитела являются важнейшим фактором специфического гуморального иммунитета. Антитела используются иммунной системой для идентификации и нейтрализации чужеродных объектов — например, бактерий и вирусов. Антитела выполняют две функции: антиген-связывающую и эффекторную (вызывают тот или иной иммунный ответ, например, запускают классическую схему активации комплемента).
Антиген— это любая молекула, которая специфично связывается с антителом. По отношению к организму антигены могут быть как внешнего, так и внутреннего происхождения. Антиген, способный вызывать иммунный ответ организма, называют иммуногеном[1].
Антигены, как правило, являются белками или полисахаридами и представляют собой части
Взаимодействие клеток иммунной системы в иммунном ответе.
Иммунный ответ возможен в результате активации клонов лимфоцитов и состоит из двух фаз. В первой фазе Аг активирует те лимфоциты, которые его распознают. Во второй (эффекторной) фазе эти лимфоциты координируют иммунный ответ, направленный на устранение Аг. Гуморальный иммунный ответ В гуморальном иммунном ответе эффекторными клетками являются антигенпредставляющие клетки и В- лимфоциты, регуляцию антителообразования осуществляют Т-хелперы и Т-супрессоры. Антигенпредставляющие клетки Макрофаг поглощает вторгшийся в организм Аг и подвергает его процессингу — расщеплению на фрагменты. Фрагменты Аг выставляются на поверхности клетки вместе с молекулой МНС. Комплекс «Аг-молекула МНС класса II» предъявляется Т-хелперу. Т-хелперы Т-хелпер распознаёт комплекс «Аг-молекула МНС класса II» на поверхности антигенпредставляющей клетки. Для активации Т-хелпера специфическое узнавание Т-хелпером фрагмента Аг на поверхности антигенпредставляющей клетки оказывается недостаточным. Активацию Т-хелперов обеспечивает взаимодействие молекулы В7 (расположена на поверхности антигенпредставляющей клетки) с молекулой CD28 на поверхности Т-хелпера. Узнавание Т-хелпером нужных молекул на поверхности антигенпредставляющей клетки стимулирует секрецию ИЛ-1. Активированный ИЛ-1 Т-хелпер синтезирует ИЛ-2 и рецепторы ИЛ-2, через которые агонист стимулирует пролиферацию Т-хелперов и цитотоксических Т-лимфоцитов. В случае Т-хелпера речь идёт об аутокринной стимуляции, когда клетка реагирует на тот агент, который сама же синтезирует и секретирует. Таким образом, после взаимодействия с антигенпредставляющей клеткой Т-хелпер приобретает способность отвечать на действие ИЛ-2 всплеском пролиферации. Биологический смысл этого процесса состоит в накоплении такого количества Т-хелперов, которое обеспечит образование в лимфоидных органах необходимого количества плазматических клеток, способных вырабатывать АТ против данного Аг.
Цитокины, их свойства и функциональное значение.
— небольшие пептидные информационные молекулы. Цитокины имеют молекулярную массу, не превышающую 30 kD
свойства:
синтезируются в процессе реализации механизмов естественного или специфического иммунитета; проявляют свою активность при очень низких концентрациях (порядка 10-11 моль/л);
служат медиаторами иммунной и воспалительной реакций и обладают аутокринной, паракринной и эндокринной активностью;
действуют как факторы роста и факторы дифференцировки клеток (при этом вызывают преимущественно медленные клеточные реакции, требующие синтеза новых белков);
образуют регуляторную сеть, в которой отдельные элементы обладают синергическим или антагонистическим дейст-вием; обладают плейотропной (полифункциональной) активностью.
Иммуноглобулины, их классификация, значение.
Иммунитет – способность организма защищаться от генетически чужеродных веществ и тел. В зависимости от происхождения может быть наследственным и приобретенным. Он основан на выработке антител на действие антигенов. Выделяют клеточное и гуморальное звенья иммунитета. Клеточный иммунитет обеспечивается активностью Т-лимфоцитов, а гуморальный – В-лимфоцитов.
Регуляция иммунного ответа.
Роль иммунной системы в регуляции физиологических функций.
Суспензионная устойчивость крови и ее механизмы.
Скорость оседания эритроцитов в зависимости от пола и возраств.
Методика определения СОЭ.
Значение определения СОЭ в клинике.
Гемоглобин, его строение, функции.
Гемоглобин относится к числу важнейших дыхательных белков, принимающих участие в переносе кислорода от легких к тканям. Он является основным компонентом эритроцитов крови, в каждом из них содержится примерно 280 млн молекул гемоглобина.
Находится в эритроцитах, а не в плазме, так как: 1)Около 3% проходящего ННb через почки фильтровалось бы через почечный фильтр; 2)Резко бы возросло онкотическое давление крови и фильтрация через стенку капилляра отсутствовала бы; 3)Резко бы возросла вязкость крови.
Гемоглобин является сложным белком, который относится к классу хромопротеинов и состоит из двух компонентов:
1) железосодержащего гема – 4 %;
2) белка глобина – 96 %.
Гем является комплексным соединением порфирина с железом. Это соединение довольно неустойчивое и легко превращается либо в гематин, либо в гемин. Строение гема идентично для гемоглобина всех видов животных. Отличия связаны со свойствами белкового компонента, который представлен двумя парами полипептидных цепей. Различают HbA, HbF, HbP формы гемоглобина.
В крови взрослого человека содержится до 95–98 % гемоглобина HbA. Его молекула включает в себя 2 α– и 2 β-полипептидные цепи. Фетальный гемоглобин в норме встречается только у новорожденных. Кроме нормальных типов гемоглобина, существуют и аномальные, которые вырабатываются под влиянием генных мутаций на уровне структурных и регуляторных генов.
Внутри эритроцита молекулы гемоглобина распространяются по-разному. Вблизи мембраны они лежат к ней перпендикулярно, что улучшает взаимодействие гемоглобина с кислородом. В центре клетки они лежат более хаотично. У мужчин в норме содержание гемоглобина примерно 130–160 г/л, а у женщин – 120–140 г/л.
Содержание гемоглобина в крови в зависимости от пола и возраста.
Количество у женщин 120-150 г/л, у мужчин 130-160 г/л.
Фракции гемоглобина, возрастные особенности их процентное содержание.
Фракции ННb: ННbА (взрослый – на него приходится 95-98% всего ННb), ННbА 2 и ННbF (фетальный).
Соединение гемоглобина с различными газами.
Выделяют четыре формы гемоглобина:
Оксигемоглобин (ННbO2) – с кислородом
Карбгемоглобин (ННbСO2) – с СO2
Карбоксигемоглобин (ННbСO) – с СО (угарным газом)
Метгемоглобин – прочное соединение окисленного гемоглобина (Fe3+) с кислородом, т.е., кислород тканям не отдается. Образуется под влиянием сильных окислителей, например, гептила – компонента ракетного топлива
Оксигемоглобин содержит двухвалентное железо и способен связывать кислород. Он переносит газ к тканям и органам. При воздействии окислителей (перекисей, нитритов и т. д.) происходит переход железа из двухвалентного в трехвалентное состояние, за счет чего образуется метгемоглобин, который не вступает в обратимую реакцию с кислородом и обеспечивает его транспорт. Карбоксигемоглобин образует соединение с угарным газом. Он обладает высоким сродством с окисью углерода, поэтому комплекс распадается медленно. Это обусловливает высокую ядовитость угарного газа. Миоглобин по структуре близок к гемоглобину и находится в мышцах, особенно в сердечной. Он связывает кислород, образуя депо, которое используется организмом при снижении кислородной емкости крови. За счет миоглобина происходит обеспечение кислородом работающих мышц.
Гемоглобин выполняет дыхательную и буферную функции. 1 моль гемоглобина способен связать 4 моля кислорода, а 1 г – 1,345 мл газа. Кислородная емкость крови – максимальное количество кислорода, которое может находиться в 100 мл крови. При выполнении дыхательной функции молекула гемоглобина изменяется в размерах. Соотношение между гемоглобином и оксигемоглобином зависит от степени парциального давления в крови. Буферная функция связана с регуляцией pH крови.
Методы определения количества гемоглобина.
Важнейшие из методов определения концентрации гемоглобина — колориметрические. Они широко применяются на прак-тике ввиду их простоты и доступности.
Определение уровня гемоглобина крови по гематиновому методу Сали основан на превращении гемоглобина при прибавлении к крови хлористоводородной кислоты в хлоргемин коричневого цвета, интенсивность окраски которого пропорциональна содержанию гемоглобина. Полученный раствор хлорида гематита разводят водой до цвета стандарта, соответствующего известной концентрации гемоглобина.
На данный момент это производится с помощью автоматизированных систем
Раньше с помощью гемометра Сали (методику см. в практической тетради)
Цветовой показатель, его величина и способ определения.
Содержание HHb в эритроците называется цветовым показателем или фарб-индексом; это относительный показатель.
Рассчет: за 100% HHb (или за 1) принимается 167 г/л HHb, а за 100% эритроцитов принимается 5*1012 в литре. Если в исследуемой крови 167 г/л HHb, а эритроцитов 5*1012 в литре, то ЦП будет равным 1 (1/1=1). Допустим, показатели 140 г/л и 4,5*1012, тогда цветовой показатель рассчитывается следующим образом: 140 г/л – 0,83 (140/167), а 4,5*1012 – 0,9 (4,5/5); 0,83 делим на 0,9, получаем значение ЦП 0,92, что соответствует норме (0,85-1,05; по другим данным норма 0,75-1). Эти эритроциты будут нормохромными, с показателем менее 0,75 – гипохромные (при железодефицитной анемии), более 1 – гиперхромные (при В12-дефицитной анемии).
Понятие об антигенах системы резус.
Карл Ландштайнер обнаружил, что эритроциты одних людей склеиваются плазмой крови других людей. Ученый установил существование в эритроцитах особых антигенов – агглютиногенов и предположил наличие в сыворотке крови соответствующих им антител – агглютининов. Он описал три группы крови по системе АВ0. IV группа крови была открыта Яном Янским. Групповую принадлежность крови определяют изоантигены, у человека их около 200. Они объединяются в групповые антигенные системы, их носителем являются эритроциты. Изоантигены передаются по наследству, постоянны на протяжении жизни, не изменяются под воздействием экзо– и эндогенных факторов.
Антигены – высокомолекулярные полимеры естественного или искусственного происхождения, которые несут признаки генетически чужеродной информации. Организм реагирует на антигены образованием специфических антител.
Антитела – иммуноглобулины образуются при введении антигена в организм. Они способны взаимодействовать с одноименными антигенами и вызывать ряд реакций. Различают нормальные (полные) и неполные антитела. Нормальные антитела (α– и β– агглютинины) находятся в сыворотке крови людей, не иммунизированных антигенами. Неполные антитела (антирезус-агглютинины) образуются в ответ на введение антигена. В антигенной системе АВ0 четыре группы крови. Антигены (агглютиногены А, В) – полисахариды, они находятся в мембране эритроцитов и связаны с белками и липидами. В эритроцитах может содержаться антиген 0, у него слабовыраженные антигенные свойства, поэтому в крови нет одноименных ему агглютининов.
Антитела (агглютинины α и β) находятся в плазме крови. Одноименные агглютиногены и агглютинины не встречаются в крови одного и того же человека, так как в этом случае произошла бы реакция агглютинации.
Она сопровождается склеиванием и разрушением (гемолизом) эритроцитов.
Антигены – высокомолекулярные полимеры естественного или искусственного происхождения, которые несут признаки генетически чужеродной информации.
Антитела – это иммуноглобулины, образующиеся при введении антигена в организм.
Изоантигены (внутривидовые антигены) – антигены, происходящие от одного вида организмов, но генетически чужеродные для каждого индивидуума. Наибольшее значение имеют эритроцитарные антигены, особенно антигены системы АВ0 и системы Rh-hr.
Иммунологический конфликт в системе АВ0 происходит при встрече одноименных антигенов и антител, вызывает агглютинацию эритроцитов и их гемолиз. Иммунологический конфликт наблюдается:
1) при переливании группы крови, несовместимой в групповом отношении;
2) при переливании в больших количествах группы крови людям с другими группами крови.
При переливании крови учитывают прямое и обратное правило Оттенберга.
Прямое правило Оттенберга: при переливании малых объемов крови (1/10 объема циркулирующей крови) обращают внимание на эритроциты донора и плазму реципиента – человек с I группой крови – универсальный донор.
Обратное правило Оттенберга: при переливании больших объемов крови (более 1/10 объема циркулирующей крови) обращают внимание на плазму донора и эритроциты реципиента. Человек с IV группой крови – универсальный реципиент.
В настоящее время рекомендуется переливать только одногруппную кровь и только в небольших количествах.
Антигенная система Rh открыта в 1940 г. К. Ландштайнером и А. Винером.
Они обнаружили в сыворотке крови обезьян—макак, резусов антитела – антирезусагглютинин.
Антигены системы резус – липопротеиды. Эритроциты 85 % людей содержат резус-агглютиноген, кровь их резус-положительна, у 15 % людей резус-антигена нет, их кровь резус-отрицательна. Описаны шесть разновидностей антигенов системы Rh. Наиболее важными являются Rh0 (D), rh`(C), rh»(E). Наличие хотя бы одного из трех антигенов указывает, что кровь резус-положительна.
Особенность системы Rh заключается в том, что она не имеет естественных антител, они являются иммунными и образуются после сенсибилизации – контакта Rh– крови с Rh+.
При первичном переливании Rh– человеку Rh+ кровь резусконфликт не развивается, так как в крови реципиента нет естественных антирезус-агглютининов.
Иммунологический конфликт по антигенной системе Rh происходит при повторном переливании Rh(—) крови человеку Rh+, в случаях беременности, когда женщина Rh(—), а плод Rh+.
При первой беременности Rh(—) матери Rh+ плодом резусконфликт не развивается, так как титр антител невелик. Иммунные антирезус-агглютинины не проникают через плацентарный барьер. Они имеют большой размер белковой молекулы (иммуноглобулин класса М).
При повторной беременности титр антител увеличивается. Антирезус-агглютинины (иммуноглобулины класса G) имеют небольшую молекулярную массу и легко проникают через плацентарный барьер в организм плода, где вызывают агглютинацию и гемолиз эритроцитов.
Система резус состоит из более чем 40 разновидностей антигенов. Наиболее часто встречающиеся, по классификации Ландштейнера и Фишера - Rh 50 0 и rh 50 0; Rh 5i 0 и rh 5i 0; RH 5ii 0 и rh 5ii 0. По классификации Фишера и Рейса это соответствует обозначениям D и d, C и c, E и e. Наиболее активен агглютиноген D (Rh 50 0), который и учитывают при определении резус-принадлежности реципиента. При определении резус-принадлежности донора принимают во внимание все резус - антигены.
Значение резус-фактора при гемотрансфузиях.
Лицо, у которого берут кровь, называют 1 донором, 0а того, кому её переливают, - 1реципиентом 0.
_ 1Переливание крови . 0.
_1) Показано .:
а) для возмещения крови (при массивной кровопотере, длительной кровоточивости);
б) для стимуляции кроветворения при его угнетении или расстройствах иммунитета (по принципу обратной связи);
в) для поддержания гомеостаза (нарушения рН и электролитного баланса);
г) для дезинтоксикации.
_2) Противопоказано .:
1) при нарушениях кровобращения - мозгового, коронарного, НК;
2) при тяжёлых заболеваниях печени и почек;
3) при тромбоэмболиях;
4) при острых инфекциях;
5) при аллергических состояниях.
Переливают кровь (свежую или консервированную, в том числе трупную) или эритроцитарную массу.
При переливании крови пользуются 1 правилом Оттенберга 0: в крови донора учитываются агглютиногены, но не агглютинины. Причина этого - наличие в крови 1 антиагглютининов А и В 0, которые связывают агглютинины и гемолизины альфа и бета - 1правило разведения 0.
Таким образом, I группу крови можно переливать к любой, II - ко II и IV, III - к III и IV, а IV - к любой. Человек с I группой крови называется поэтому универсальным донором, а с IV - универсальным реципиентом.
Однако по этим правилам можно переливать не более 200-500мл крови, потому что:
1) при большем объёме переливаемой крови количество антиагглютининов недостаточно для свяэывания агглютининов и гемолизинов;
2) у 10-20% людей с I группой концентрация агглютининов и гемолизинов настолько высока, что они не связываются антиагглютининами, и при переливании такой крови возникают
тяжёлые осложнения;
3) у людей с I группой крови есть Н - антиген (скрыто он находится и у лиц с другими группами крови), который при переливании к реципиенту с другой группой крови связывается с существующими у него Н - антителами (особенно часто они есть у людей со II и IV группами крови), что вызывает осложнения.
Люди с I группой крови, относящиеся к пунктам 2) и 3), называются 1опасными 0 1универсальными донорами 0.
Эти соображения послужили причиной отказа от классических правил переливания крови. В настоящее время всегда, когда возможно, переливают только одногруппную кровь.
При переливании несовместимой крови возникает 1гемотрансфузионный шок 0, который проявляется гемолизом эритроцитов, а также выходом из тромбоцитов тромбопластина, что ведёт к внутрисосудистому свёртыванию крови и блокаде образовавшимися тромбинными и фибринными тромбами микроциркуляторного русла всех тканей и органов.
Перед переливанием обязательно проводят биологическую пробу на индивидуальную совместимость.
Роль резус-фактора в формировании иммунологически конфликтной беременности
беременность резус-отрицательной женщины резус-положительным плодом. У здоровой беременной кровь плода не проникает в организм матери, и первые роды часто заканчиваются благополучно (хотя у даже у здоровых первородящих женщин с резус-отрицательной кровью генетически плацента чаще бывает проницаема для эритроцитов плода).
Во время же родов в кровь матери обязательно проникают эритроциты новорождённого, на них вырабатываются антитела, и последующие беременности резус-положительным плодом вызывают резус-конфликт. У беременных с патологией плаценты резус-конфликт развивается при первой беременности. Последствия его разнообразны: выкидыши, мертворожденость, 1гемолитическая болезнь новорождённого 0 (желтуха, поражение ядер мозга билирубином). В случае ГБН единственный способ спасти ребёнка - обменное переливание крови.
Беременность резус-положительной женщины резус-отрицательным плодом не приводит к резус-конфликту, так как на эритроциты матери, проникающие в кровь плода, он не способен вырабатывать антитела.
Определение резус-принадлежности крови.
Количество антигенов, обнаруженных в эритроцитах людей на сегодняшний день, более 500. Их объединяют в десятки групп крови (МNS, H, Келл-Келлано [Кк], Лютеран [Lu], и др.). Распространённость этих антигенов различна в разных географических регионах. Например, в основном у людей преобладает антиген М над N (особенно у эскимосов Гренландии и индейцев Америки, что говорит о родстве этих народов). Однако в Австралии, Новой Гвинее и у басков преобладает антиген N. У австралийцев отсутствует антиген S. Некоторые группы крови есть лишь у ограниченной популяции: Система Диего - у 36% южноамериканских индейцев и около 10 % жителей Восточной Азии и т.п. Кроме эритроцитов, антигены есть и на других клетках крови. Учитывая все известные сейчас антигены, можно составить 700 млрд. различных комбинаций, то есть сбылись слова К. Ландшейнера о том, что у каждого человека - своя группа крови. Все эти агглютиногены имеют значение при беременности, несовместимой по какому-либо из них, или при частых переливаниях крови, в связи с чем не рекомендуется повторное переливание крови от одного и того же донора.
Принципы разделения крови людей на группы по системе АВО.
Деление по группам крови системы АВ0 основано на комбинациях агглютиногенов эритроцитов и агглютининов плазмы.
I (0) – в мембране эритроцитов нет агглютиногенов, в плазме крови присутствуют α– и β-агглютинины.
II (A) – в мембране эритроцитов присутствует агглютиноген.
A, в плазме крови – α-агглютинин.
III (B) – в мембране эритроцитов присутствует агглютиноген.
B, в плазме крови – β-агглютинин.
IV (AB) – в мембране эритроцитов присутствует агглютиноген А и агглютиноген В, в плазме нет агглютининов.
Для определения группы крови используют стандартные гемагглютинирующие сыворотки I, II, III, IV групп двух серий с разным титром антител.
При смешивании крови с сыворотками происходит реакция агглютинации или она отсутствует. Наличие агглютинации эритроцитов указывает на наличие в эритроцитах агглютиногена, одноименного агглютинину в данной сыворотке. Отсутствие агглютинации эритроцитов указывает на отсутствие в эритроцитах агглютиногена, одноименного агглютинину данной сыворотки.
Тщательное определение групп крови донора и реципиента по антигенной системе АВ0 необходимо для успешной гемотрансфузии.
Агглютинины и агглютиногены крови и их свойства.
Агглютиногены — антигены, вызывающие в организме образование агглютининов (изоантител).
Агглютиногены содержатся в клетках (например, в эритроцитах человека) и обозначаются прописными латинскими буквами А и В.
У одних людей в эритроцитах имеется агглютиноген А, у других — В, у третьих — А и В, у четвёртых он вообще отсутствует (0).
Агглютинины — антитела, вызывающие агглютинацию, то есть наступающее под действием иммунной сыворотки склеивание (скучивание) корпускулярных антигенов (клеток, микробов), а также растворимых антигенов, адсорбированных на эритроцитах или частицах инертного носителя, вследствие чего образуются комочки, выпадающие в осадок.
Агглютинины принадлежат к иммуноглобулинам классов M и G.
Методика определения групп крови.
Техника определения групп крови с помощью гемоагглютинирующих сывороток.
Этот способ в настоящее время наиболее распространён в клинической и лабораторной практике.
Суть метода сводится к обнаружению в исследуемой крови групповых антигенов А и В с помощью стандартных изогемагглютинирующих сывороток. Для этого используют реакцию агглютинации. Постановку реакции проводят в помещении с хорошим освещением при температуре 15-25?С.
Необходимое оснащение
1. Стандартные изогемагглютинирующие сыворотки групп 0(I), A(II), В(III) и АВ(IV) двух различных серий.
2. Белые фарфоровые или эмалированные тарелки, или любые другие; пластинки со смачиваемой поверхностью, маркированные 0(I), А(П), В(Ш), AB(IV).
3. Изотонический раствор хлорида натрия.
4. Иглы, пипетки, стеклянные палочки (предметные стёкла).
Методика проведения реакции
1. Перед началом реакции подписывают тарелку (наносят фамилию и инициалы исследуемого), после чего на неё под соответствующие обозначения наносят стандартные изогемагглютинирующие сыворотки I, II и III групп в объёме 0,1 мл (капля около 1 см в диаметре). Во избежание ошибок наносят две серии сывороток каждой из групп, так как одна из серий может иметь низкую активность и не дать чёткой агглютинации. Всего получается шесть капель, образующих два ряда по три капли в следующем порядке слева направо: 0(I), А(П), В(Ш).
2. Кровь для исследования берут из пальца или из вены. Шесть капель исследуемой крови величиной приблизительно с булавочную головку (0,01 мл, маленькая капля) последовательно переносят сухой стеклянной палочкой на пластину в шесть точек, каждую - рядом с каплей стандартной сыворотки (количество исследуемой крови должно быть приблизительно в 10 раз меньше количества стандартной сыворотки, с которой её смешивают), потом их осторожно с помощью стеклянных палочек с закруглёнными краями перемешивают.
3. После смешивания тарелку периодически покачивают.
Агглютинация начинается в течение первых 10-30 с, однако наблюдение следует обязательно вести до 5 мин ввиду возможности более поздней агглютинации, например с эритроцитами группы A2(II).
4. В те капли, где произошла агглютинация, добавляют по одной капле изотонического раствора хлорида натрия, после чего оценивают результат реакции.
Трактовка результатов
Реакция агглютинации может быть положительной или отрицательной. При положительной реакции обычно в течение первых 10- 30 с в смеси появляются видимые невооружённым взглядом мелкие красные зёрнышки (агглютинаты), состоящие из склеенных эритроцитов. Мелкие зёрнышки постепенно сливаются в более крупные зёрна, а иногда в хлопья неправильной формы. При этом сыворотка частично или полностью обесцвечивается. Положительная реакция может быть пескообразной или лепестковой.
При отрицательной реакции капля остаётся равномерно окрашенной в красный цвет, в ней не обнаруживают никаких зёрнышек (агглютинатов).
Результаты реакций в каплях с сыворотками одной и той же группы (двух серий) должны совпадать.
+Принадлежность исследуемой крови к соответствующей группе определяют по наличию или отсутствию агглютинации при реакции с соответствующими сыворотками после наблюдения в течение 5 мин
Основные правила переливания консервированной донорской крови.
Определение годности крови к переливанию.
При визуальном контроле необходимо отметить:
-правильность паспортизации (наличие этикетки с номером, даты заготовки, обозначения группы крови и резус-принадлежности, наименования консерванта, Ф.И.О. донора, наименования учреждения-заготовителя, подпись врача);
-срок годности обозначен на этикетке рядом с датой заготовки;
-герметичность упаковки. Недопустимо малейшее нарушение ее целостности, в том числе следов прокалывания крышки флакона иглой и подтекания.
Кровь должна быть разделена на 3 слоя:
-внизу красные эритроциты;
-выше - узкая серая полоска лейкоцитов и тромбоцитов; - над ними - желтая прозрачная плазма.
Трехслойность характерна только для цельной крови, хранящейся в стеклянных флаконах. Плазма должна быть прозрачной, не содержащей пленок, хлопьев, сгустков, не иметь красной окраски (гемолиз). Плазма может быть непрозрачна при хиллезной крови (высокое содержание нейтральных жиров). При нагревании до 37°С становиться прозрачной.
Консервирование крови – это комплекс воздействий на нее, имеющих своей целью создание условий для длительного хранения крови вне организма в стерильном состоянии с максимальным сохранением ее биологических свойств (как форменных элементов, так и жидкой части крови). Для консервирования крови используются два метода:
консервирование при положительных температурах;
консервирование при отрицательных температурах.
Консервирующие растворы
Для увеличения продолжительности сроков хранения крови вне организма используют специальные растворы – гемоконсерванты.
В качестве обязательного компонента во все консервирующие растворы входят особые химические вещества – стабилизаторы. Широкое распространение в практической деятельности получили такие стабилизаторы как лимонная кислота и цитрат натрия. Они связывают ионы кальция, что способствует подавлению одного из этапов процесса гемостаза – образования тромбина. Важным свойством цитрата натрия является то, что через 20–30 мин после трансфузии крови, стабилизированной с его помощью, он почти полностью (не менее 90%) выводится из организма.
К другой разновидности стабилизаторов относится гепарин. Он препятствует свертыванию крови, непосредственно связывая и инактивируя тромбин. Существенным недостатком гепарина при использовании его в качестве стабилизатора является то, что он не позволяет длительно сохранять консервированную с его помощью кровь, потому что по мере увеличения срока хранения происходит инактивация гепарина. В результате этого уже через сутки образуются мелкие, а через двое суток и крупные сгустки крови.
При консервировании крови должны быть обеспечены: 1) апирогенность консервированной крови (тщательная обработка посуды и систем, использование для консервации высококачественной апирогенной воды); 2) отсутствие в ней сгустков и гемолиза (безупречная техника пункции вен донора, осторожное покачивание сосуда во время взятия крови); 3) стерильность (закрытый метод взятия крови, боксированная операционная, надежная герметизация сосуда с консервированной кровью).
+Консервированная кровь должна храниться при температуре от 4 до 8°. Хранение при комнатной температуре сокращает срок годности на 7—10 дней. Перегревание крови (выше 38°) ведет к денатурации белков, что может привести к развитию у больного (реципиента) тяжелых посттрансфузионных осложнений. Охлаждение ниже 0° вызывает разрушение эритроцитов, что делает кровь негодной. Для транспортировки крови используют специальные контейнеры
Понятие о гемостазе.
Гемостаз – сложная биологическая система приспособительных реакций, обеспечивающая сохранение жидкого состояния крови в сосудистом русле и остановку кровотечений из поврежденных сосудов путем тромбирования. Система гемостаза включает следующие компоненты:
1) cосудистую стенку (эндотелий);
2) форменные элементы крови (тромбоциты, лейкоциты, эритроциты);
3) плазменные ферментные системы (систему свертывания крови, систему фибринолиза, клекреин-кининовую систему);
4) механизмы регуляции.
Функции системы гемостаза.
1. Поддержание крови в сосудистом русле в жидком состоянии.
2. Остановка кровотечения.
3. Опосредование межбелковых и межклеточных взаимодействий.
4. Опсоническая – очистка кровяного русла от продуктов фагоцитоза небактериальной природы.
5. Репаративная – заживление повреждений и восстановления целостности и жизнеспособности кровеносных сосудов и тканей.
Факторы, поддерживающие жидкое состояние крови:
1) тромборезистентность эндотелия стенки сосуда;
2) неактивное состояние плазменных факторов свертывания крови;
3) присутствие в крови естественных антикоагулянтов;
4) наличие системы фибринолиза;
5) непрерывный циркулирующий поток крови.
Тромборезистентность эндотелия сосудов обеспечивается за счет антиагрегантных, антикоагулянтных и фибринолитических свойств.
Антиагрегантные свойства:
1) синтез простациклина, который обладает антиагрегационным и сосудорасширяющим действием;
2) синтез оксида азота, обладающего антиагрегационным и сосудорасширяющим действием;
3) синтез эндотелинов, которые сужают сосуды и препятствуют агрегации тромбоцитов.
Антикоагулянтные свойства:
1) синтез естественного антикоагулянта антитромбина III, который инактивирует тромбин. Антитромбин III взаимодействует с гепарином, образуя антикоагуляционный потенциал на границе крови и стенки сосуда;
2) синтез тромбомодулина, который связывает активный фермент тромбин и нарушает процесс образования фибрина за счет активации естественного антикоагулянта протеина С.
Фибринолитические свойства обеспечиваются синтезом тканевого активатора плазминогена, который является мощным активатором системы фибринолиза. Различают два механизма гемостаза:
1) сосудисто-тромбоцитарный (микроциркулярный);
2) коагуляционный (свертывание крови).
Полноценная гемостатическая функция организма возможна при условии тесного взаимодействия этих двух механизмов.
Сосудисто-тромбоцитарный гемостаз и его механизмы.
Сосудисто-тромбоцитарный механизм гемостаза обеспечивает остановку кровотечения в мельчайших сосудах, где имеются низкое кровяное давление и малый просвет сосудов. Остановка кровотечения может произойти за счет:
1) сокращения сосудов;
2) образования тромбоцитарной пробки;
3) сочетания того и другого.
Сосудисто-тромбоцитарный механизм обеспечивает остановку кровотечения благодаря способности эндотелия синтезировать и выделять в кровь биологически активные вещества, изменяющие просвет сосудов, а также адгезивно-агрегационной функции тромбоцитов. Изменение просвета сосудов происходит за счет сокращения гладкомышечных элементов стенок сосудов как рефлекторным, так и гуморальным путем. Тромбоциты обладают способностью к адгезии (способностью прилипать к чужеродной поверхности) и агрегацией (способностью склеиваться друг с другом). Это способствует образованию тромбоцитарной пробки и запускает процесс свертывания крови. Остановка кровотечения за счет сосудисто-тромбоцитарного механизма гемостаза осуществляется следующим образом: при травме происходит спазм сосудов за счет рефлекторного сокращения (кратковременный первичный спазм) и действия биологически активных веществ на стенку сосудов (серотонина, адреналина, норадреналина), которые освобождаются из тромбоцитов и поврежденной ткани. Этот спазм вторичный и более продолжительный. Параллельно происходит формирование тромбоцитарной пробки, которая закрывает просвет поврежденного сосуда. В основе ее образования лежит способность тромбоцитов к адгезии и агрегации. Тромбоциты легко разрушаются и выделяют биологически активные вещества и тромбоцитарные факторы. Они способствуют спазму сосудов и запускают процесс свертывания крови, в результате которого образуется нерастворимый белок фибрин. Нити фибрина оплетают тромбоциты, и образуется фибрин-тромбоцитарная структура – тромбоцитарная пробка. Из тромбоцитов выделяется особый белок – тромбостеин, под влиянием которого происходит сокращение тромбоцитарной пробки и образуется тромбоцитарный тромб. Тромб прочно закрывает просвет сосуда, и кровотечение останавливается
Тромбоциты, их количество, структура, функции.
Тромбоциты – безъядерные клетки крови, диаметром 1,5–3,5 мкм. Они имеют уплощенную форму, и их количество у мужчин и женщин одинаково и составляет 180–320 × 109/л. Эти клетки образуются в красном костном мозге путем отшнуровывания от мегакариоцитов.
Тромбоцит содержит две зоны: гранулу (центр, в котором находятся гликоген, факторы свертывания крови и т. д.) и гиаломер (периферическую часть, состоящую из эндоплазматического ретикулума и ионов Ca).
Мембрана построена из бислоя и богата рецепторами. Рецепторы по функции делятся на специфические и интегрированные. Специфические способны взаимодействовать с различными веществами, за счет чего запускаются механизмы, аналогичные действию гормонов. Интегрированные обеспечивают взаимодействие между тромбоцитами и эндотелиоцитами.
Для тромбоцитов характерны следующие свойства:
1) амебовидная подвижность;
2) быстрая разрушаемость;
3) способность к фагоцитозу;
4) способность к адгезии;
5) способность к агрегации.
Тромбоциты выполняют трофическую и динамическую функции и осуществляют регуляцию сосудистого тонуса и принимают участие в процессах свертывания крови.
Трофическая функция заключается в обеспечении сосудистой стенки питательными веществами, за счет которых сосуды становятся более упругими.
Регуляция сосудистого тонуса достигается благодаря наличию биологического вещества – серотонина, вызывающего сокращения гладкомышечных клеток. Трамбоксан А2 (производный арахидоновой кислоты) обеспечивает наступление сосудосуживающего эффекта за счет снижения сосудистого тонуса.
Тромбоцит принимает активное участие в процессах свертывания крови за счет содержания в гранулах тромбоцитарных факторов, которые образуются либо в тромбоцитах, либо адсорбируются в плазме крови.
Динамическая функция заключается в процессах адгезии и агрегации тромбов. Адгезия – процесс пассивный, протекающий без затраты энергии. Тромб начинает прилипать к поверхности сосудов за счет интергиновых рецепторов к коллагену и при повреждении выделяется на поверхность к фибронектину. Агрегация происходит параллельно адгезии и протекает с затратой энергии. Поэтому главным фактором является наличие АДФ. При взаимодействии АДФ с рецепторами начинается активация J-белка на внутренней мембране, что вызывает активацию фосфолипаз А и С. Фосфолипаза а способствует образованию из арахидоновой кислоты тромбоксана А2 (агреганта). Фосфолипаза с способствует образованию иназитолтрифосфата и диацилглецерола. В результате активируется протеинкиназа С, повышается проницаемость для ионов Ca. В результате из эндоплазматического ретикулума они поступают в цитоплазму, где Ca активирует кальмодулин, который активирует кальцийзависимую протеинкиназу.
Тромбоцитопоэз и его регуляция.
Плазменные и клеточные факторы свертывания крови.
Гемолиз—разрушение эритроцитов крови с выделением в окружающую среду гемоглобина. В норме гемолиз завершает жизненный цикл эритроцитов (ок. 125 суток) и происходит в организме человека и животных непрерывно. Патологический гемолиз происходит под влиянием гемолитических ядов, холода, некоторых лекарственных веществ (у чувствительных к ним людей) и других факторов; характерен для гемолитических анемий. По локализации процесса выделяют несколько типов гемолиза:
Внутриклеточный(протекающий в клетках различных органов - печени, селезенке, костном мозге). Внутрисосудистый(протекающий в крови).
Коагуляционный механизм гемостаза обеспечивает остановку кровотечения в более крупных сосудах (сосудах мышечного типа). Остановка кровотечения осуществляется за счет свертывания крови – гемокоагуляции. Процесс свертывания крови заключается в переходе растворимого белка плазмы крови фибриногена в нерастворимый белок фибрин. Кровь из жидкого состояния переходит в студнеобразное, образуется сгусток, который закрывает просвет сосуда. Сгусток состоит из фибрина и осевших форменных элементов крови – эритроцитов. Сгусток, прикрепленный к стенке сосуда, называется тромбом, он подвергается в дальнейшем ретракции (сокращению) и фибринолизу (растворению). В свертывании крови принимают участие факторы свертывания крови. Они содержатся в плазме крови, форменных элементах, тканях.
В процессе свертывания крови принимают участие много факторов, они называются факторами свертывания крови, содержатся в плазме крови, форменных элементах и тканях. Плазменные факторы свертывания крови имеют наибольшее значение.
Плазменные факторы свертывания крови – белки, большинство из которых ферменты. Они находятся в неактивном состоянии, синтезируются в печени и активируются в процессе свертывания крови. Существует пятнадцать плазменных факторов свертывания крови, основными из них являются следующие.
I – фибриноген – белок, переходящий в фибрин под влиянием тромбина, участвует в агрегации тромбоцитов, необходим для репарации тканей.
II – протромбин – гликопротеид, переходящий в тромбин под влиянием протромбиназы.
IV – ионы Ca участвуют в образовании комплексов, входит в состав протромбиназы, связывает гепарин, способствует агрегации тромбоцитов, принимает участие в ретракции сгустка и тромбоцитарной пробки, тормозят фибринолиз.
Дополнительными факторами, ускоряющими процесс свертывания крови, являются акцелераторы (с V по XIII факторы).
VII – проконвертин – гликопротеид, принимающий участие в формировании протромбиназы по внешнему механизму;
X – фактор Стюарта—Прауэра – гликопротеид, являющийся составной частью протромбиназы.
XII – фактор Хагемана – белок, активируется отрицательно заряженными поверхностями, адреналином. Запускает внешний и внутренний механизм образования протромбиназы, а также механизм фибринолиза.
Факторы клеточной поверхности:
1) тканевой активатор, индуцирующий свертывание крови;
2) прокоагулянтный фосфолипид, выполняющий функцию липидного компонента тканевого фактора;
3) тромбомодулин, связывающий тромбин на поверхности эндотелиальных клеток, активирует протеин С.
Факторы свертывания крови форменных элементов.
Эритроцитарные:
1) фосфолипидный фактор;
2) большое количество АДФ;
3) фибриназа.
Лейкоцитарные – апопротеин III, значительно ускоряющий свертываемость крови, способствующий развитию распространенного внутрисосудистого свертывания крови.
Тканевым фактором является тромбопластин, который содержится в коре головного мозга, в легких, в плаценте, эндотелии сосудов, способствует развитию распространенного внутрисосудистого свертывания крови.
Механизм свертывания крови и его фазы.
Свертывание крови – это сложный ферментативный, цепной (каскадный), матричный процесс, сущность которого состоит в переходе растворимого белка фибриногена в нерастворимый белок фибрин. Процесс называется каскадным, так как в ходе свертывания идет последовательная цепная активация факторов свертывания крови. Процесс является матричным, так как активация факторов гемокоагуляци происходит на матрице. Матрицей служат фосфолипиды мембран разрушенных тромбоцитов и обломки клеток тканей.
Процесс свертывания крови происходит в три фазы.
Сущность первой фазы состоит в активации X-фактора свертывания крови и образовании протромбиназы. Протромбиназа – это сложный комплекс, состоящий из активного X-фактора плазмы крови, активного V-фактора плазмы крови и третьего тромбоцитарного фактора. Активация X-фактора происходит двумя способами. Деление основано на источнике матриц, на которых происходит каскад ферментативных процессов. При внешнем механизме активации источником матриц является тканевый тромбопластин (фосфолипидные осколки клеточных мембран поврежденных тканей), при внутреннем – обнаженные коллагеновые волокна, фосфолипидные осколки клеточных мембран форменных элементов крови.
Сущность второй фазы – образование активного протеолитического фермента тромбина из неактивного предшественника протромбина под влиянием протромбиназы. Для осуществления этой фазы необходимы ионы Ca.
Сущность третьей фазы – переход растворимого белка плазмы крови фибриногена в нерастворимый фибрин. Эта фаза осуществляется три 3 стадии.
1. Протеолитическая. Тромбин обладает эстеразной активность и расщепляет фибриноген с образованием фибринмономеров. Катализатором этой стадии являются ионы Ca, II и IX протромбиновые факторы.
2. Физико-химическая, или полимеризационная, стадия. В ее основе лежит спонтанный самосборочный процесс, приводящий к агрегации фибрин-мономеров, который идет по принципу «бок в бок» или «конец в конец». Самосборка осуществляется путем формирования продольных и поперечных связей между фибринмономерами с образованием фибрин-полимера (фибрина-S) Волокна фибрина-S легко лизируются не только под влиянием плазмина, но и комплексных соединений, которые не обладают фибринолитической активностью.
3. Ферментативная. Происходит стабилизация фибрина в присутствии активного XIII фактора плазмы крови. Фибрин-S переходит в фибрин-I (нерастворимый фибрин). Фибрин-I прикрепляется к сосудистой стенке, образует сеть, где запутываются форменные элементы крови (эритроциты) и образуется красный кровяной тромб, который закрывает просвет поврежденного сосуда. В дальнейшем наблюдается ретракция кровяного тромба – нити фибрина сокращаются, тромб уплотняется, уменьшается в размерах, из него выдавливается сыворотка, богатая ферментом тромбином. Под влиянием тромбина фибриноген вновь переходит в фибрин, за счет этого тромб увеличивается в размерах, что способствует лучшей остановке кровотечения. Процессу ретракции тромба способствует тромбостенин – контрактивный белок кровяных пластинок и фибриноген плазмы крови. С течением времени тромб подвергается фибринолизу (или растворению). Ускорение процессов свертывания крови называется гиперкоагуляцией, а замедление – гипокоагуляцией.
Понятие о фибринолизе и его механизмы.
Первичные и вторичные антикоагулянты и их физиологическая роль.
Система фибринолиза – ферментативная система, расщепляющая нити фибрина, которые образовались в процессе свертывания крови, на растворимые комплексы. Система фибринолиза полностью противоположна системе свертывания крови. Фибринолиз ограничивает распространение свертывания крови по сосудам, регулирует проницаемость сосудов, восстанавливает их проходимость и обеспечивает жидкое состояние крови в сосудистом русле. В состав системы фибринолиза входят следующие компоненты:
1) фибринолизин (плазмин). Находится в неактивном виде в крови в виде профибринолизина (плазминоген). Он расщепляет фибрин, фибриноген, некоторые плазменные факторы свертывания крови;
2) активаторы плазминогена (профибринолизина). Они относятся к глобулиновой фракции белков. Различают две группы активаторов: прямого действия и непрямого действия. Активаторы прямого действия непосредственно переводят плазминоген в активную форму – плазмин. Активаторы прямого действия – трипсин, урокиназа, кислая и щелочная фосфатаза. Активаторы непрямого действия находятся в плазме крови в неактивном состоянии в виде проактиватора. Для его активации необходимы лизокиназа тканей, плазмы. Свойствами лизокиназы обладают некоторые бактерии. В тканях находятся тканевые активаторы, особенно много их содержится в матке, легких, щитовидной железе, простате;
3) ингибиторы фибринолиза (антиплазмины) – альбумины. Антиплазмины тормозят действие фермента фибринолизина и превращение профибринолизина в фибринолизин.
Процесс фибринолиза проходит в три фазы.
Во время I фазы лизокиназы, поступая в кровь, приводят проактиватор плазминогена в активное состояние. Эта реакция осуществляется в результате отщепления от проактиватора ряда аминокислот.
II фаза – превращение плазминогена в плазмин за счет отщепления липидного ингибитора под действием активатора.
В ходе III фазы под влиянием плазмина происходит расщепление фибрина до полипептидов и аминокислот. Эти ферменты получили название продуктов деградации фибриногена / фибрина, они обладают выраженным антикоагулянтным действием. Они ингибируют тромбин и тормозят процесс образования протромбиназы, подавляют процесс полимеризации фибрина, адгезию и агрегацию тромбоцитов, усиливают действие брадикинина, гистамина, ангеотензина на сосудистую стенку, что способствует выбросу из эндотелия сосудов активаторов фибринолиза.
Различают два вида фибринолиза – ферментативный и неферментативный.
Ферментативный фибринолиз осуществляется при участии протеолитического фермента плазмина. Происходит расщепление фибрина до продуктов деградации.
Неферментативный фибринолиз осуществляется комплексными соединениями гепарина с тромбогенными белками, биогенными аминами, гормонами, совершаются конформационные изменения в молекуле фибрина-S.
Процесс фибринолиза идет по двум механизмам – внешнему и внутреннему.
По внешнему пути активация фибринолиза идет за счет лизокиназ тканей, тканевых активаторов плазминогена.
Во внутреннем пути активации принимают участие проактиваторы и активаторы фибринолиза, способные превращать проактиваторы в активаторы плазминогена или же действовать непосредственно на профермент и переводить его в плазмин.
Значительную роль в процессе растворения фибринового сгустка играют лейкоциты в силу своей фагоцитарной активности. Лейкоциты захватывают фибрин, лизируют его и выделяют в окружающую среду продукты его деградации.
Процесс фибринолиза рассматривается в тесной связи с процессом свертывания крови. Их взаимосвязи осуществляются на уровне общих путей активаций в реакции ферментного каскада, а также за счет нервно-гуморальных механизмов регуляции.
