
2553
.pdf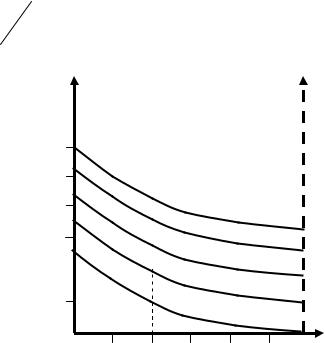
ствующего значения и Та, n1= К1 – (0,01-0,04) для двигателей легкого топлива.
n1= К1 0,02 – для дизельных двигателей. При одинаковых значениях и Та величина n1 у дизелей выше, т.к. у карбюраторных двигателей происходит понижение температуры за счет испарения топлива и за счет большой теплоемкости топливовоздушной смеси. При определении n1 по соответствующему показателю адиабаты необходимо учитывать скоростной режим двигателя, наддув двигателя, от-
ношение Sn Dц , температурный режим двигателя, тип системы охла-
ждения и другие факторы (рис. 12).
K |
Ta |
1,4
1,39
1,38 |
Та= 300 |
1,37
1,36 
1,35
Та=400
4 8 12 16 18
Рис. 12. Влияние степени сжатия на показатель политропы сжатия
Величина показателя политропы лежит в пределах: а) для карбюраторных двигателей n1 = 1,34–1,39; б) для дизельных двигателей n1 = 1,36–1,4;
в) для газовых двигателей n1 = 1,34–1,38.
Давление и температуру в конце сжатия определяют поформулам
P P n1 |
; |
T T n1 1. |
c a |
|
c a |
Значение температуры и давления в конце сжатия изменяется в пределах:
а) для карбюраторных и газовых двигателей Рс = 0,9–2,0 МПа,
Тс =600–800К;
б) для дизельных двигателей Рс = 3,5–5,0 МПа, Тс =750–950К.
30
После проведения расчета и получения значения параметров рабочего тела в точке С производят ориентировочное исправление линии сжатия. Это осуществляется в целях учета начала сгорания с определением угла опережения зажигания (впрыска топлива) и задержки воспламенения, причемдавлениевконцесжатияповышаютна15%.
3.9. Сгорание жидкого и газообразного топлива
Вместо внешнего подвода теплоты в термодинамических циклах процесс повышения температуры рабочего тела в действительных циклах происходит за счет сгорания топлива внутри цилиндра двигателя. Процесс сгорания является сложным и его возникновение, развитие и полнота определяются целым рядом факторов, а именно:
а) скоростью химических реакций; б) условиями теплообмена;
в) отдачей теплоты в окружающую среду; г) энергией источника зажигания и т.д.
Процесс сгорания топлива рассматривают по стехиометрическим уравнениям с целью определения количества кислорода для сгорания топлива, расхода воздуха, определения количества продуктов сгорания и изменения числа молей рабочего тела в процессе сгорания. Уравнения сгорания рассматривают или для 1 кг топлива, или для1м3, или для 1 моля топлива.
3.10. Сгорание жидкого топлива
Элементарный состав жидкого топлива, как правило, задают в килограммах.
Скг Нкг Окг 1кг.
Для бензина: С = 0,85 кг/кг топл.; Н = 0,15 кг/кг топл.;
О= 0 кг/кг топл. Для дизельного топлива: С = 0,87 кг/кг топл.;
Н = 0,126 кг/кг топл.;
О= 0,004 кг/кг топл.
Сгорание углерода С+О2=СО2.
Принимая во внимание молекулярные массы, будем иметь
12 кг С + 32 кг О2 = 44 кг СО2.
31

Так как уравнения рассматриваются из расчета 1кг топлива, то уравнение примет вид
1кг С + 1/12 моль О2 = 1/12 моль СО2.
Для С кг топлива С кг С + С/12 моль О2 = С/12 моль СО2.
Пренебрегая объемом жидкого топлива, получим:
а) количество молей кислорода М1 С12;
б) количество молей продуктов сгорания М2 С12; в) изменение число молей М М2 М1 0.
Неполное сгорание углерода:
2С + О2 = 2СО, 24 кг С + 32 кг О2 = 2 · 28 кг СО,
1кгС + 1/24 моль О2 = 2/24 моль СО, С кг С + С/24 моль О2 = С/12 моль СО.
М1 С24, |
М2 С12, |
М М2 М1 С12 С24 С24. |
Увеличение количества молей продуктов сгорания способствует увеличению давления в цилиндре двигателя и увеличению мощности двигателя. В двигателях это явление используют для получения максимальной мощности при полных нагрузках путем обогащения смеси. Однако обогащать смесь можно только до определенных пределов, т.к. могут оказать влияние теплотворная способность топлива, полнота сгорания и ряд других факторов.
Сгорание водорода
2Н2 + О2 = 2Н2О, 4 кг Н2 + 32 кг О2 = 2 · 18 кг Н2О,
1кг Н2 + 1/4 моль О2 = 2/4 моль Н2О,
Нкг Н2 + Н/4 моль О2 = Н/2 моль Н2О.
М1 Н 4, М2 Н 2,
М = Н/2 - Н/4 = Н/4.
32
Результаты расчета
Потребность в кислороде, состав продуктов сгорания, изменение объема при сгорании жидкого топлива можно представить в виде табл.1:
|
|
|
|
Таблица 1 |
Компоненты |
Расход О2 |
Состав |
Количество |
Изменения |
|
|
продуктов |
продуктов |
объема |
|
|
сгорания |
сгорания |
|
Углерод при сгорании в |
С/12 |
СО2 |
С/12 |
О |
СО2 |
|
|
|
|
Углерод при сгорании в |
С/24 |
СО |
С/12 |
С/24 |
СО |
|
|
|
|
Сгорание водорода |
Н/4 |
Н2О |
Н/2 |
Н/4 |
Таким образом:
–при полном сгорании углерода изменение числа молей равно
нулю;
–при неполном сгорании углерода имеет место увеличение числа молей продуктов сгорания на величину С/24;
–при сгорании водорода происходит увеличение числа молей продуктов сгорания на величину Н/4.
Увеличение числа молей продуктов сгорания при неполном сгорании углерода является одной из причин перехода на обогащенную смесь при максимальной загрузке двигателя.
Сгорание газообразного топлива
Элементарный состав газообразного топлива может быть задан в молях.
МСО+МН2+МСН4+МС2Н4+МС3Н8+МС4Н10=1 моль
1. Сгорание СО:
2 СО + О2 = 2СО2, 2 моль СО + 1 моль О2 = 2 моль СО2,
1 моль СО + 0,5 моль О2 = 1 моль СО2, МСО моль СО + 0,5 МСО моль О2 = МСО моль СО2,
М1 = МСО + 0,5 МСО = 1,5 МСО,
М2 = МСО,
М = М2 - М1 = МСО – 1,5 МСО = - 0,5 МСО.
33
При рассмотрении стехиометрических уравнений сгорания газообразного топлива (окиси углерода) его объемом пренебрегать нельзя. Поэтому при сгорании окиси углерода происходит уменьшение количества молей продуктов сгорания на величину – 0,5 МСО.
2. Сгорание Н2:
2 Н2 + О2 = 2Н2О, 1 моль Н2 + 0,5 моль О2 = 1моль Н2О,
МH2 моль Н2 +0,5 МH2 моль О2 = МH2 моль Н2О,
М1 = МH2 + 0,5 МH2 = 1,5 МH2 ,
М2 = МH2 ,
ММ2 М1= МH2 – 1,5 МH2 = – 0,5 МH2 .
При сгорании газообразного топлива (водорода) происходит уменьшение числа молей продуктов сгорания на величину – 0,5 МH2 .
Сгорание углеводородов:
1. Сгорание метана:
СН4 + 2О2 = СО2 + 2Н2О, 1 моль СН4 + 2моль О2 = 1 моль СО2 + 2моль Н2О,
МСH4 моль СН4 +2МСH4 моль О2 = МСH4 моль СО2 + 2МСH4 моль Н2О,
М1 = 3МСH4 ,
М2 = 3МСH4 ,
М М2 М1 0.
2. Сгорание этилена:
С2Н4 + 3О2 = 2СО2 + 2Н2О,
МС2H4 моль С2Н4 +3МС2H4 моль О2 = 2МС2H4 моль СО2 + +2МС2H4 моль Н2О,
М1 = 4МС2H4 ,
М2 = 4МС2H4 ,
ММ2 М1 0.
3.Сгорание пропана:
С3Н8 + 5О2 = 3СО2 + 4Н2О,
34

МС3H8 моль С3Н8 +5МС3H8 моль О2 = 3МС3H8 моль СО2 + +4МС3H8 моль Н2О,
М1 = МС3H8 + 5МС3H8 = 6МС3H8 ,
М2 = 3МС3H8 + 4МС3H8 = 7МС3H8 ,
М = М2 - М1 =7МС3H8 - 6МС3H8 = МС3H8 .
4. Сгорание бутана:
С4Н10 + 6,5О2 = 4СО2 + 5Н2О,
МС4H10 моль С4Н10 +6,5МС4H10 моль О2 = 4МС4H10 моль СО2 + +5МС4H10 моль Н2О,
М1 = МС4H10 + 6,5МС4H10 = 7,5МС4H10 ,
М2 = 4МС4H10 + 5МС4H10 = 9МС4H10 ,
М = М2 − М1 =1,5 МС4H10 .
При сжигании углеводородов происходит уменьшение числа молей продуктов сгорания, если m<(4 – 2r), т.е. если углеводород – Сn
Нm Оr.
Углеводород с формулой Сn Нm будет иметь уменьшение числа молей продуктов сгорания, если m<4.
Для углеводородов, где r = 0, изменение числа молей продуктов сгорания можно определить по уравнению М m4 1 MCnHm . Ес-
ли значение r не равно нулю, то М m |
4 r |
2 1 MCnHmOr . |
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 2 |
||
Компоненты |
Расход О2 |
Состав продук- |
|
Количество |
Изменение |
|||||||||||||
|
|
|
|
|
|
|
тов сгорания |
|
продуктов |
числа мо- |
||||||||
|
|
|
|
|
|
|
|
|
|
сгорания |
лей, |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
М |
|
|
СО |
0,5МСО |
СО2 |
|
|
МСО |
|
|
- 0,5МСО |
||||||||||
Н2 |
0,5М |
H2 |
Н2О |
|
|
М |
|
H2 |
|
|
- 0,5М |
H2 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
СН4 |
2 М |
СH4 |
СО2, Н2О |
|
3М |
СH4 |
0 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||||||
С2Н4 |
3М |
С2H4 |
СО2, Н2О |
|
4М |
С2H4 |
0 |
|
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||
С3Н8 |
5МС H |
8 |
СО2, Н2О |
|
7МС H |
8 |
МС H |
8 |
||||||||||
|
|
|
3 |
|
|
|
|
|
|
3 |
|
3 |
|
|||||
С4Н10 |
6,5МС |
H |
СО2, Н2О |
|
9МС |
H |
10 |
1,5МС H |
||||||||||
|
|
|
|
4 |
|
10 |
|
|
|
|
|
4 |
|
4 |
|
10 |
||
35

4. ОПРЕДЕЛЕНИЕ КОЛИЧЕСТВА ВОЗДУХА, НЕОБХОДИМОГО ДЛЯ СГОРАНИЯ ТОПЛИВА
1. Расход кислорода для сгорания жидкого топлива:
So |
C |
H |
|
|
|
O |
1 |
|
|
O |
|
|
|
моль/кг топл. |
|
|||||||
|
|
T |
C |
3 H |
T |
|
|
|
|
|
||||||||||||
|
12 |
|
|
4 |
|
|
32 |
12 |
|
|
|
|
8 |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
2. Расход воздуха: |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
S |
o |
|
|
|
|
1 |
|
|
|
O |
|
|
|
|
моль воздуха |
|
||||
L |
|
|
|
|
|
|
|
C 3 H |
T |
|
|
|
= |
|
|
. |
||||||
|
|
|
|
|
|
|
|
|
|
|||||||||||||
0 |
0,21 |
|
0,21 12 |
|
|
8 |
|
|
|
|
|
кг топливa |
|
|||||||||
|
|
|
|
|
|
|
|
|
||||||||||||||
Если обозначить действительный расход воздуха через L, то будем иметь:
LL0 − коэффициент избытка воздуха, L L0 .
–для бензиновых двигателей = 0,8-1,2
–для дизельных двигателей = 1,3-1,7
–для газовых двигателей = 1,0-1,25
При = 1,0 – нормальная рабочая смесь, при < 1,0 – богатая смесь и при > 1,0 – бедная смесь. При = 0,88 – 0,9 – имеет место наибольшая мощность за счет сгорания части углерода в СО. При = 1,08-1,11 – имеет место наиболее полное сгорание топлива, следовательно, и получение наибольшей экономичности.
Так как у дизельного двигателя регулировка мощности происходит за счет изменения количества подаваемого топлива, а объем воздуха остается в цилиндре постоянным, то коэффициент избытка воздуха лежит в пределах = 5-8 – на холостом ходу и = 1,3-1,7 – в режиме полной нагрузки. Большое значение для дизельных двигателей объясняется минимальным временем на смесеобразование.
Расход кислорода для сгорания газообразного топлива:
2 |
|
|
|
|
m |
|
r |
|
||
So |
0,5MCO |
0,5MH |
|
n |
|
|
|
MC H O . |
||
2 |
4 |
2 |
||||||||
|
|
|
|
|
|
n m r |
||||
Расход воздуха для сгорания газообразного топлива:
|
1 |
|
|
|
|
m |
r |
|
моль воздуха |
|
|||
L2o |
|
|
|
0,5 MCO |
MH2 |
n |
|
|
|
MCnHmOr |
|
. |
|
|
4 |
2 |
моль топлива |
||||||||||
|
0,21 |
|
|
|
|
|
|
|
|||||
36

4.1. Молекулярные изменения при сгорании топлива
Молекулярные изменения оцениваются коэффициентом молекулярного изменения. Отношение числа молей продуктов сгорания к числу молей свежей смеси называют коэффициентом молекулярного изменения.
M n M c – теоретический коэффициент молекулярного изме-
нения.
Для дизельных двигателей > 1, будем иметь L L0 .
M1 |
L |
1 |
, mt = 190, |
M2 M1 M , |
M H |
, |
|
||||||
|
|
mt |
|
4 |
|
|
М2 L H 4 1 H , если пренебречь mt.
М1 L 4L
Действительный коэффициент молекулярного изменения с учетом остаточных газов:
|
М2 |
Мr |
|
r |
, |
1,03 1,04. |
М1 |
|
|
||||
|
Мr |
1 r |
|
|||
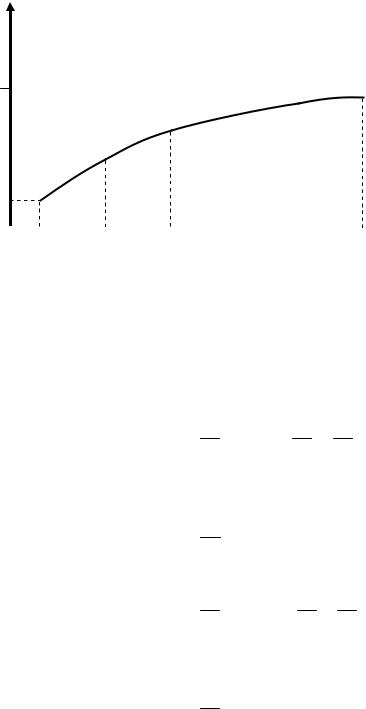
При сгорании топлива ( < 1) часть углерода сгорает в СО и часть водорода остаётся свободной, т.е. не реагирует с кислородом. Анализ отработавших газов показывает, что отношение числа молей водорода к числу молей окиси углерода в отработавших газах - примерно постоянная величина для данного вида топлива и не зависит от коэффициента избытка воздуха (рис. 13).
МН const K .
МСО
Для бензина: Н/С = 0,17- 0,19; K = 0,45- 0,50, при расчете K = 0,45. Для бутана: Н/С = 0,195; K = 0,51.
Для пропана: Н/С = 0,205; K = 0,53.
Для метана: Н/С = 0,33; K = 0,7.
37
K
0,7
|
|
|
|
|
|
0,6 |
|
|
|
Бензин |
Б n |
|
|
|
|||
0,40,5 |
|
|
|
||
|
|
||||
|
|
|
|||
0,3 |
|
|
|
|
|
|
|
|
|
 H/C
H/C
0,13 0,17 0,21 0,25 0,29 0,33
Рис. 13. Влияние состава топлива на величину К
Сгорание бензина при < 1
1.Определение числа молей СО2.
СС С
МCO MCO2 12 1 12 12,
где – количество молей СО; (1 ) – количество молей СО2.
С
MCO2 12 MCO .
2.Определение числа молей Н2О.
НН Н
MH2 MH2O 2 1 2 2 ,
где – количество молей водорода; (1 ) – количество молей Н2О.
Н
MH2O 2 MH2 .
Общее количество кислорода, участвующего в реакции:
|
|
|
|
|
М |
СО |
|
MH |
2 |
O |
|
|
|
|
|
|
O |
|
|
M |
CO |
|
|
|
|
|
|
|
0,21 L |
|
T |
, |
|||||||
|
|
|
|
|
|
|
|
||||||||||||
|
|
2 |
|
2 |
|
|
|
|
|
O |
|
32 |
|
||||||
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
MCO |
|
С |
MCO , |
|
MH |
O |
|
Н |
MH |
|
, |
||||||||
|
|
|
|
||||||||||||||||
|
2 |
|
12 |
|
|
|
|
|
2 |
|
2 |
|
|
|
2 |
||||
38

C |
|
|
|
M |
CO |
|
1 |
Н |
|
|
|
|
O |
||
|
M |
|
|
|
|
|
|
|
М |
Н2 |
|
0,21 L |
T |
. |
|
12 |
|
2 |
2 |
2 |
32 |
||||||||||
|
CO |
|
|
|
|
|
o |
|
|||||||
|
|
|
|
|
MH2 |
K MCO . |
|
|
|
|
|
|
||||
С |
|
H |
|
OT |
0,21 L |
MCO |
|
1 |
K M |
|
|
1 |
M |
|
1 K . |
|
|
|
|
|
|
|
|
|
|||||||||
12 4 32 |
o |
2 2 |
|
CO |
2 |
|
CO |
|
||||||||
С H OT 0,21Lo , 12 4 32
MCO
1
0,21Lo 1 2MCO 1 K ,
0,42Lo 1 .
1 К
Коэффициент молекулярного изменения определяется как частное от деления количества продуктов сгорания к количеству свежего заряда.
Количество продуктов сгорания
M2 MCO MCO |
MH |
|
MH O MN |
, |
|||||||||||||
|
|
|
2 |
|
|
2 |
|
2 |
|
|
2 |
||||||
M |
|
0,42L |
1 |
, MCO |
|
С |
MCO , |
||||||||||
CO |
|
||||||||||||||||
|
|||||||||||||||||
|
o |
1 К |
|
2 |
12 |
|
|
|
|||||||||
|
M |
K M |
|
|
, MH |
|
O |
Н |
MH |
, |
|
||||||
|
CO |
2 |
2 |
|
|||||||||||||
|
|
H2 |
|
|
|
|
|
|
|
|
2 |
|
|||||
|
|
MN2 0,79 Lo , |
L Lo , |
|
|
||||||||||||
|
|
M1 |
L |
1 |
, |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
mt |
|
|
|
|
|
|
||||
где mt – молекулярная масса бензина, для бензина mt = 124.
4.2. Термодинамика процесса сгорания
Теплота, выделенная при сгорании топливовоздушной смеси расходуется:
1)на изменение внутренней энергии;
2)совершение механической работы;
3)теплоотдачу в стенки;
4)неполноту сгорания;
5)утечку рабочего тела через неплотности;
6)диссоциацию молекул.
39
