
Скорость поглощения кальция
Первые предположения о величине скорости поглощения Са2+ ишемическим миокардом при реперфузии основывались на результатах, полученных авторами работы [11]. Они проследили изменения скорости поглощения Са2+ при восстановлении коронарного кровотока после 40-минутной ишемии и обнаружили, что установившееся значение достигается не позднее чем через 10 мин. Эти данные были затем подтверждены другими авторами [9]. Полученные результаты позволяют с уверенностью утверждать, что поглощение Са2+ является быстрым процессом. Тем не менее оно не происходит мгновенно, хотя и не исключено, что некоторые клетки, поврежденные сильнее других во время ишемии, при реперфузии сразу перегружаются Са2+, в то время как менее разрушенные клетки поглощают Са2+ медленнее или, возможно, с некоторой задержкой.
Специфичность прироста содержания кальция, вызванного реперфузией
Таблица 18.3. Влияние продолжительности ишемического эпизода на прирост содержания Са2+ в ткани при реперфузии
|
Перфузия |
Прирост Са2+ после 30 мин реперфузии (мкмоль/г сухой массы) |
|
30 мин ишемии |
4,0±0,2 |
|
60 мин ишемии |
6,7±0,7 |
Примечание. Данные получены на межжелудочковой перегородке кролика [9]. Ишемию препарата создавали при 28 °С в течение указанного в таблице времени, а затем проводили реперфузию в течение 30 мин.
Согласно мнению авторов работы [12], теоретически нет оснований полагать, что накопление Са2+ в кардиомиоцитах при постишемической реперфузии является следствием только нарушения регуляции входа ионов Са2+ в клетки. Определенную роль в этом случае может играть уменьшение выведения ионов Са2+ из клеток. Однако последнее предположение, по-видимому, неверно, так как выведение ионов Са2+ остается относительно неизменным к моменту, когда скорость входа ионов Са2+ значительно возрастает, как будто поступление Са2+ становится неуправляемым [2]. Количество аккумулированного кальция до некоторой степени зависит от продолжительности предшествующего периода ишемии. В табл. 18.3 в качестве примера показано, что межжелудочковая перегородка сердца кролика, реперфузированная после 30-минутной ишемии при 28 °С, накапливает Са2+ в количестве 4±0,2 мкмоль/г сухой массы, в то время как аналогичные препараты, реперфузированные через 60 мин ишемии, накапливают Са2+ в количестве 6,7±0,7 мкмоль/г сухой массы [9]. Процесс поглощения, по-видимому, не является специфическим для ионов Са2+. Если при ишемической реперфузии в перфузат вместо 45Са [1] или 47Са. [9] добавить 133Ва или 85Sr [12], то эти ионы накапливаются в ткани вместо кальция. В случае замены кальция барием реперфузия после 15-минутной ишемии при 37 °С не изменяет характера поглощения 133Ва; реперфузия после 30-минутной ишемии увеличивает скорость поглощения 133Ba на 33% [12], а после 60-минутной ишемии скорость его поглощения возрастает более чем вдвое. Если в качестве маркера использовать 85Sr, то влияние ишемической реперфузии будет выражено значительно слабее [12]: скорость поглощения 85Sr при восстановлении перфузии после 45-минутной ишемии не изменяется, и увеличение наблюдается лишь при продолжительности ишемического периода более 60—70 мин. Такое, отсутствие специфичности относится не только к двухвалентным ионам. Заметные изменения наблюдаются в тканевом содержании других электролитов. Содержание ионов Na+ возрастает, а ионов К+—уменьшается; наблюдается также увеличение тканевого содержания Н20 и потеря ионов Mg2+ [1]. Если сравнить распределение этих ионов в нормальном миокарде млекопитающих (рис. 18.2), то можно сделать вывод, что восстановление перфузии после длительного периода ишемии просто облегчает движение ионов по их электрохимическим градиентам. Может быть именно поэтому не наблюдается увеличения выхода ионов Са2+? Не потому ли это происходит, что существует внутрь направленная движущая сила для тонов Са2+ через поврежденную неселективно проницаемую мембрану? Прежде чем рассмотреть эту возможность более подробно, необходимо выяснить, что происходит в клетке с ионами Са2+, поглощенными при реперфузии.
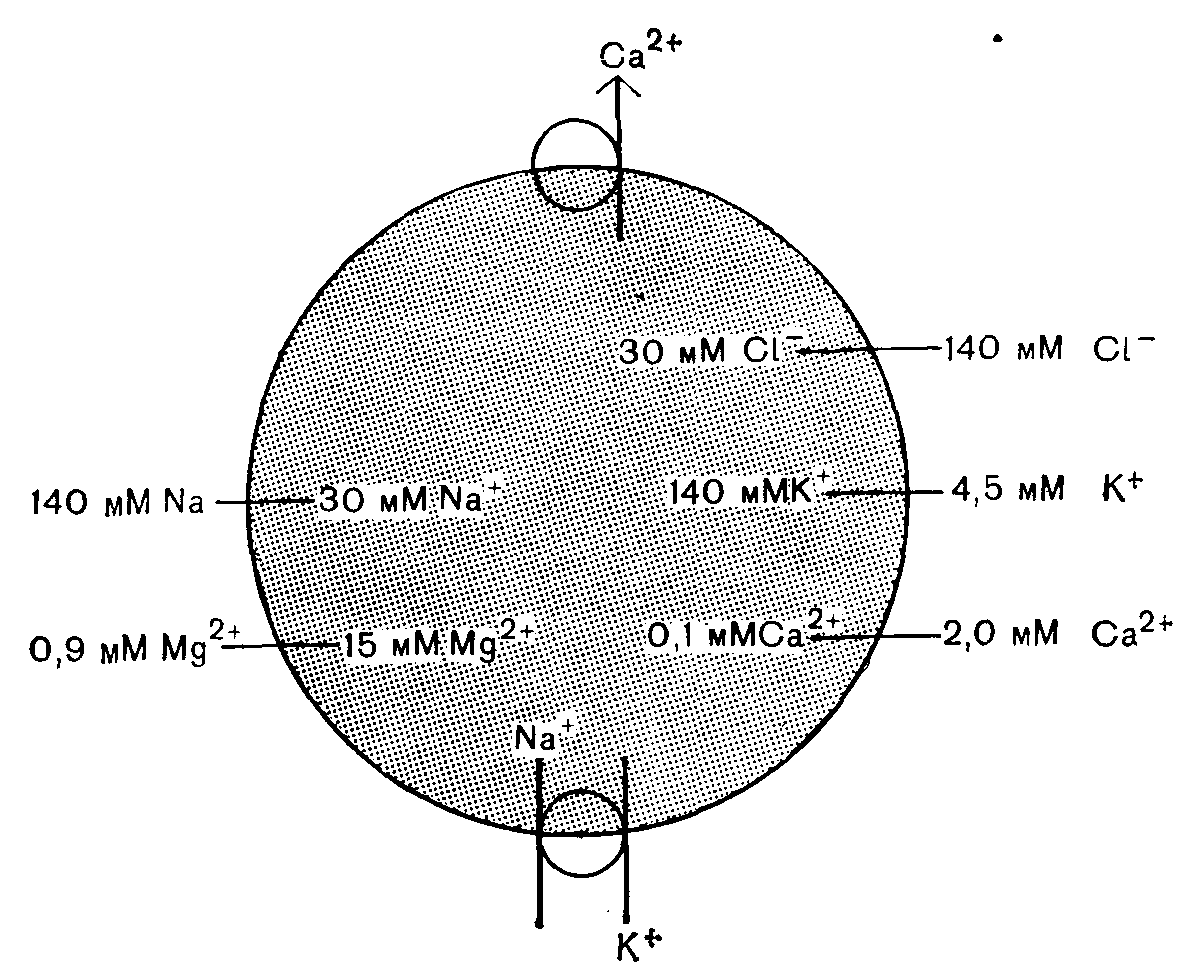
Рис. 18.2. Схема распределения ионов между миоплазмой кардиомиоцитов и внеклеточным пространством.
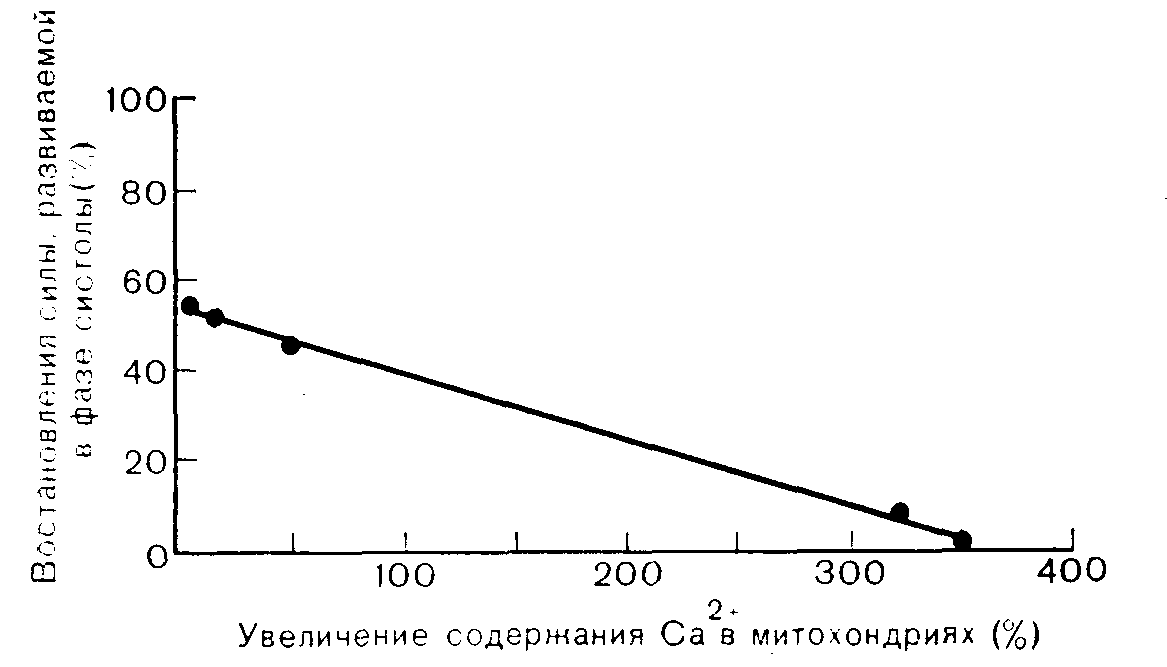
Рис. 18.3. Соотношение между содержанием Са2+ в митохондриях и восстановлением величины активной силы сокращения. Перед выделением митохондрий ткани сердца сначала помещали в условия тотальной ишемии при 37°С, а затем реперфузировали. Каждая точка отражает результаты отдельного эксперимента.
Локализация аккумулированного Са2+
Таблица 18.4. Влияние Са2+ на синтез АТФ в митохондриях ткани сердца
|
Са2+ (мкМ) |
Снижение активности синтеза АТФ (%) |
|
5 |
0 |
|
12,5 |
58 ±4 |
|
30 |
68±6 |
|
50 |
72±10 |
Примечание. Каждый результат представляет собой среднее значение ± стандартное отклонение для 6 независимых экспериментов. Использовали митохондрии, выделенные из свежеизолированной ткани сердца у 6 кроликов. Концентрация Са2+ — уровень ионизированного Са2+, получаемый при использовании ЭГТА в качестве буфера. Митохондрии инкубировали при 25 °С в присутствии указанного количества Са2+ в течение 10 мин прежде чем оценивали [8] активность синтеза в них АТФ.
Ионы Са2+, поглощаемые при реперфузии, преимущественно локализуются в митохондриях, где они откладываются в виде плотных розеткообразных частиц [8, 11]. Значение таких внутримитохондриальных отложений ионов Са2+ нужно определить как можно точнее, не допуская недооценки их роли, но не преувеличивая ее важность. Как показано на рис. 18.3, если измерить и нанести на график относительную величину восстановления активной сократительной способности сердца при постишемической реперфузии как функцию относительного прироста содержания ионов Са2+ в выделенных из сердца митохондриях, то и в этом случае получается линейная зависимость. Очевидно, что лучше восстанавливаются те ткани сердца, в митохондриях которых имеется меньший запас ионов Са2+. Не исключено, что в этом нет ничего необычного, так как митохондрии, подвергшиеся действию высокой концентрации ионов Са2+ в хорошо оксигенированной среде, богатой субстратом и предшественниками АТФ,. имеют более низкую активность синтеза АТФ, как показано в табл. 18.4. Одним из путей уменьшения скорости поглощения ионов Са2+ митохондриями ткани сердца является снижение температуры. На рис. 18.4 показано, что в зависимости от концентрации ионов Са2+ в инкубационной среде снижение температуры-среды реакции с 37 °С до 25 °С может уменьшить скорость поглощения ионов Са2+ митохондриями в 2 раза. Рассмотрение этого вопроса будет продолжено при обсуждении способов защиты миокарда от повреждений, вызванных постишемической реперфузией.
Изменения концентрации ионов Са2+ в цитозоле без прироста тканевого содержания кальция
До сих пор мы рассматривали вопрос о наблюдаемом при постишемической реперфузии увеличении тканевого содержания Са2+. Очевидно, что во время тотальной ишемии прирост тканевого содержания кальция может происходить только за счет ионов Са2+, находящихся во внеклеточном пространстве. Если предположить, что внеклеточная жидкость содержит около 2,5 мкмоль ионов Са2+ на 1 л, то за счет этого Са2+ можно объяснить поглощение только 0,35 мкм Са2+ на 1 г сырой массы ткани. Однако в этом случае может происходить перераспределение Са2+ в ткани, так что концентрация его ионов в цитозоле может увеличиться без какого бы то ни было прироста тканевого содержания кальция. Ряд причин свидетельствует в пользу такого механизма.

Рис. 18.4. Влияние температуры на скорость аккумуляции Са2+ митохондриями, выделенными из ткани сердца млекопитающего.
Например, вследствие снижения внутриклеточного уровня аденозинтри-фосфата (АТФ) и креатинфосфата (КФ) происходит нарушение работы ионных насосов, поддерживающих внутриклеточный баланс ионов. Некоторые из этих насосов схематически показаны на рис. 18.5. К ним относятся:
1. Расположенная на сарколемме Са2+-активируемая АТФаза, удаляющая ионы Са2+ из клетки против градиента концентрации [13]. При остановке этого насоса можно ожидать, что все входящие в клетку ионы Са2+ независимо от пути поступления будут захвачены клеткой, если не заместятся в ней ионами Na+ [14, 15].
2. Са2+-активируемая АТФаза саркоплазматического ретикулума. Функция этого насоса состоит в перемещении ионов Ca2+ в саркоплазматический ретикулум [16], поэтому прекращение его работы либо вследствие истощения источников энергии, либо по какой-то другой причине должно привести к повышению концентрации ионов Са2+ в цитозоле.
3. Расположенная на сарколемме (Na+, К+)-активируемая оуабаин-чувствительная АТФаза. Она удаляет из клетки ионы Na+ и вводит в нее ионы К+ против соответствующих градиентов концентрации, поэтому нарушение ее работы должно привести к уменьшению тканевого содержания ионов К+ и увеличению количества ионов Na+. Известно, что такое перераспределение ионов происходит при ишемии миокарда [1]. На первый взгляд увеличение концентрации ионов Na+ в цитозоле не является существенным фактором. Однако его возможное значение возрастает, если учесть, что повышение уровня ионов Na+ в цитозоле может привести к подъему ионов Са2+ в результате следующих наблюдений: а) ионы Na+ вытесняют ионы Са2+ из митохондрии [17]; б) ионы Са2+ могут поступать из внеклеточного пространства в обмен на ионы Na+ с помощью реакции Na+—Са2+-обмена [14, 15].
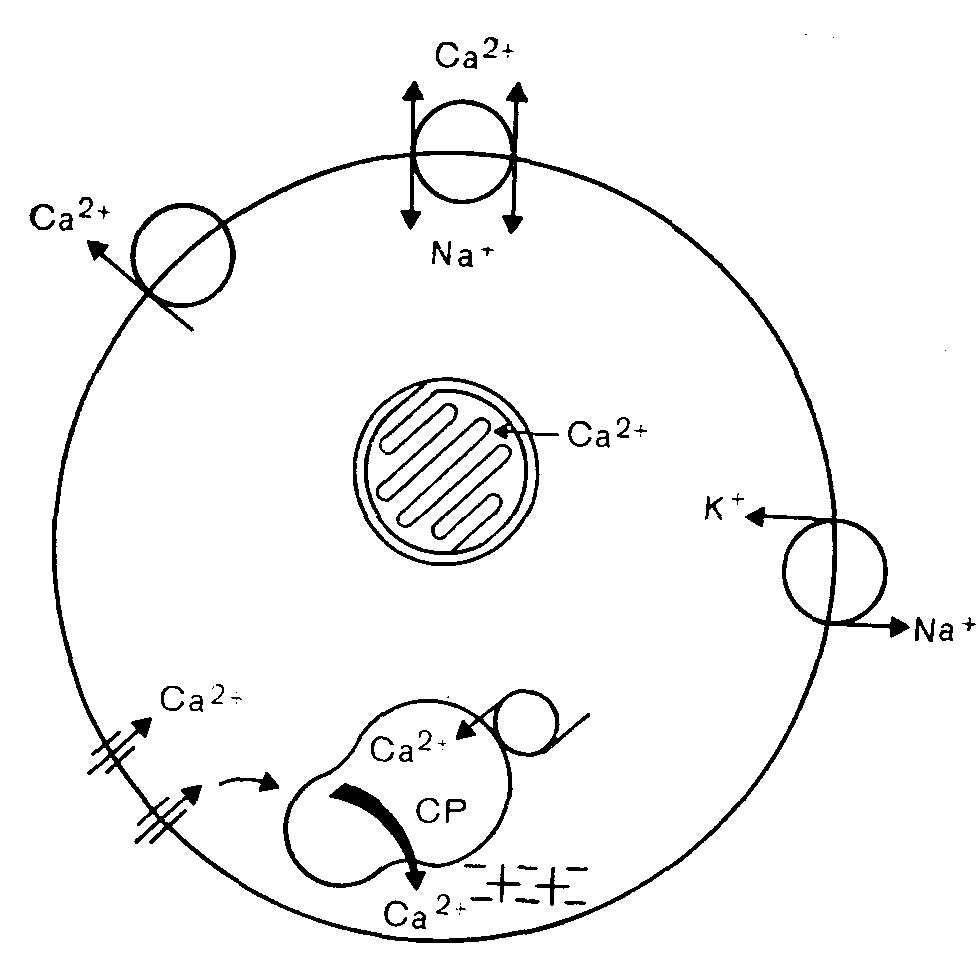
Рис. 18.5. Схема различных ионных насосов кардиомиоцитов, чувствительных к ионам Са2+ СР — саркоплазматический ретикулум.
