
- •Міністерство освіти і науки україни Запорізький національний технічний університет лекції з фізики
- •1.9 Додавання гармонічних коливань одного напрямку
- •1 Коливання
- •1.1 Комплексні числа та дії з ними
- •1.2 Порядок розв’язку лінійних диференціальних рівнянь другого прядку з постійними коефіцієнтами
- •1.3 Вільні незатухаючі гармонічні коливання. Диференціальне рівняння цих коливань (пружинний маятник, коливальний контур)
- •1.4 Розв’язок диференціального рівняння незатухаючих гармонічних коливань
- •1.5 Характеристики гармонічних коливань. Фазові співвідношення
- •1.6 Енергія гармонічних коливань
- •1.7 Фізичний і математичний маятники
- •1.8 Додавання гармонічних коливань одного напрямку однакових частот
- •1.9 Додавання гармонічних коливань одного напрямку близьких частот (биття коливань)
- •1.10 Додавання взаємно перпендикулярних гармонічних коливань (Фігури Ліссажу)
- •1.11 Затухаючі коливання. Диференціальне рівняння затухаючих коливань та його розв’язок
- •1.12 Характеристики затухаючих коливань та їх фізичний зміст
- •1.13 Вимушені коливання. Диференціальне рівняння вимушених коливань та його розв’язок
- •1.14 Резонанс напруг у коливальному контурі. Резонансні криві
- •1.15 Резонанс струмів у коливальному контурі
- •1.16 Векторні діаграми
- •2 Хвилі
- •2.1 Механізм утворення хвиль у пружному середовищі. Класифікація хвиль. Рівняння хвиль
- •2.2 Диференціальне хвильове рівняння
- •2.3 Дисперсія хвиль. Фазова швидкість хвиль
- •2.4 Швидкість передачі енергії хвилями. Групова швидкість
- •2.5 Когерентні хвилі. Утворення стоячих хвиль. Рівняння стоячих хвиль
- •2.6 Звукові хвилі. Характеристики звуку. Швидкість звуку в газах
- •2.7 Ефект Доплера
- •2.8 Основи теорії електромагнітного поля Максвела. Інтегральна форма рівнянь Максвела та їх фізичний зміст. Струм зміщення
- •2.9 Диференціальна форма рівнянь Максвела. Рівняння електромагнітних хвиль. Властивості електромагнітних хвиль
- •2.10 Енергія електромагнітних хвиль. Вектор Умова-Пойнтінга
- •3 Оптика
- •3.1 Розвиток поглядів на природу світла
- •3.2 Принцип Гюйгенса та його застосування до закону заломлення світла. Повне внутрішнє відбивання
- •3.3 Інтерференція світла. Умови максимумів і мінімумів інтерференційної картини. Інтерференція від двох джерел (дослід Юнга)
- •3.4 Інтерференція світла в плоско-паралельній пластинці і на клині. Лінії однакової товщини. Кільця Ньютона
- •3.5 Дифракція світла. Принцип Гюйгенса-Френеля. Метод зон Френеля для розрахунку дифракційної картини
- •3.6 Дифракція Френеля від круглого отвору та диску
- •3.7 Дифракція Фраунгофера на щілині
- •Дифракційна гратка да її роздільна здатність
- •3.9 Дифракція рентгенівських променів. Формула Вульфа-Бреггів
- •3.10 Поняття про голографію
- •Природне і поляризоване світло закони Малюса і Брюстера. Ефект Керра
- •4 Оптика рухомого середовища. Елементи спеціальної теорії відносності а.Ейнштейна
- •4.1 Швидкість світла та її вимірювання. Дослід Майкельсона
- •4.2 Постулати спеціальної теорії відносності. Перетворення координат Лорентца
- •4.3 Наслідки перетворення координат Лорентца
- •5 Квантові властивості випромінювання
- •5.1 Теплове випромінювання. Абсолютно чорне та сірі тіла. Закон Кірхгофа для теплового випромінювання
- •5.2 Розподіл енергії в спектрі абсолютно чорного тіла. Формули Віна, Релея-Джинса, Планка
- •5.3 Закони випромінювання абсолютно чорного тіла. Закон Стефана-Больцмана, закон Віна
- •5.4 Фотоефект. Закони Столетова. Рівняння Ейнштейна для фотоефекту. „Червона” межа фотоефекту
- •5.5 Ефект Комптона
- •Тиск світла
- •6 Фізика атомів
- •Дослід е.Резерфорда по розсіюванню α-частинок. Ядерна модель атома
- •Протиріччя резерфордовської моделі атома. Постулати н.Бора та їх дослідне обґрунтування (дослід Франка і Герца)
- •Борівська теорія воднеподібних атомів. Закономірності лінійчатих атомних спектрів
- •Елементи квантової механіки
- •Гіпотеза де-Бройля. Дослідне обґрунтування корпускулярно-хвильового дуалізму матерії. Хвильова функція
-
Борівська теорія воднеподібних атомів. Закономірності лінійчатих атомних спектрів
Воднеподібний атом (йон) – це йон із зарядом ядра +Ze навколо якого обертається лише один електрон, як і в атомі водню. До таких атомів відносяться йонізований гелій He+, двічі йонізований літій Li2+, тричі йонізований берилій Be3+, чотири рази йонізований бор B4+ і т.д.
Розглянемо електрон, що рухається в полі атомного ядра +Ze. Для спрощення розрахунків вважатимемо, що електрон масою m рухається по коловій орбіті радіусом rn із швидкістю υ під дією сили Кулона. Запишемо основне рівняння динаміки обертального руху і постулат квантування орбіт (6.2)
 Із
системи цих рівнянь знайдемо радіус
орбіти rn,
вилучивши швидкість υ. Із (6.5) знаходимо
швидкість і підставляємо в (6.4)
Із
системи цих рівнянь знайдемо радіус
орбіти rn,
вилучивши швидкість υ. Із (6.5) знаходимо
швидкість і підставляємо в (6.4)
![]() ;
;
![]()
![]() . (6.6)
. (6.6)
Для атома водню Z = 1. Радіус найближчої до ядра орбіти при n = 1
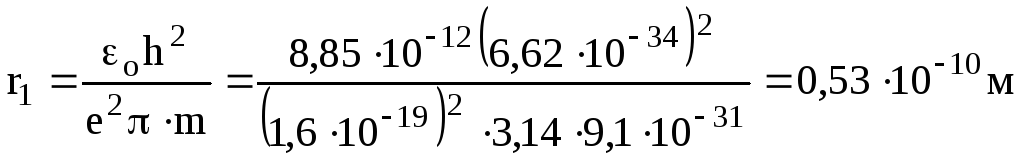 .
.
Це значення відповідає розмірам атома водню, які знайдені з кінетичної теорії газів.
Знайдемо повну енергію електрона, яка складається з потенціальної енергії взаємодії з ядром і кінетичної енергії руху по орбіті
![]() .
(6.7)
.
(6.7)
Підставляємо
із (6.4)
![]() , а потім радіус (6.6). Одержуємо
, а потім радіус (6.6). Одержуємо
![]() .
(6.8)
.
(6.8)
Для
атома водню Z = 1;
![]() .
При n = 1 одержуємо теоретичне значення
енергії іонізації атома водню 13,6 еВ, що
добре узгоджується з експериментом.
.
При n = 1 одержуємо теоретичне значення
енергії іонізації атома водню 13,6 еВ, що
добре узгоджується з експериментом.
Намалюємо
енергетичний спектр атома водню і
електронні п ереходи,
при яких енергія атомом випромінюється
(рис.6.7).
ереходи,
при яких енергія атомом випромінюється
(рис.6.7).
Експериментально певна закономірність в атомних спектрах у видимому діапазоні була вперше знайдена швейцарським вчителем у 1885 році І.Бальмером (1825-1898) як плід довготерпіння в переборі чисел. Він одержав формулу, яка носить його ім’я
![]() ,
(6.9)
,
(6.9)
де ν – частота спектральної лінії, Rν = 3,29∙1015 Гц – емпірично підібрана стала, яка називається сталою Рідберга, n = 3, 4, 5,…
У теорії Бора стала зрозумілою формула Бальмера (6.9), а також були передбачені спектральні серії в ультрафіолетовій області (див. рис.6.7 серія Лаймана) і в інфрачервоній області (див. рис.6.7 серії Пашена, Брекета.). Спектральні лінії систематизують по серіям, в залежності від того, на який енергетичний рівень переходить електрон із більш високих рівнів: на 1-й рівень – серія Лаймана, на 2-й – серія Бальмера , на 3-й – серія Пашена, на 4-й – серія Брекета і т.д.
Скориставшись формулами (6.3) та (6.8), знайдемо частоти спектральних ліній
![]() .
(6.10)
.
(6.10)
Тут
![]() –
теоретичне значення сталої
Рідберга,
яке, як видно, добре узгоджується із
емпіричним значенням.
–
теоретичне значення сталої
Рідберга,
яке, як видно, добре узгоджується із
емпіричним значенням.
Таким чином, теорія Бора пояснила механізм виникнення спектральних ліній та їх закономірності, одержане теоретичне значення сталої Ридберга, передбачила спектральні серії в невидимій області спектру. Але кількісного узгодження в спектрах уже для атома гелію не давала. В цьому полягає основний недолік теорії. Це обумовлене тим, що теорії Бора притаманна внутрішня суперечність. У ній класична фізика штучно поєднується з квантовими постулатами, тобто вона була ні послідовно класичною ні послідовно квантовою.
