
полезная метода
.pdf
N Иными словами, α - это доля молекул электролита,
N0
распавшихся на ионы.
По степени диссоциации в не очень разбавленных растворах электролиты подразделяют на сильные, слабые и средней силы.
Принято считать сильными те электролиты, для которых а>30%, слабыми - если a<3% и средней силы - если 3%<а <30%, причем все указанные значения а относятся к 0,1н раствору.
К сильным электролитам в водных растворах относятся почти все соли, многие неорганические кислоты (HNO3, H2SO4, HClO4, HCl, HBr, HI, и др.) и гидроксиды щелочных и щелочноземельных металлов. Электролитами средней силы являются некоторые органические и неорганические кислоты (щавелевая Н2С2О4, муравьиная НСООН, сернистая H2SO3, фосфорная Н3РО4, и др.). К слабым электролитам принадлежат такие кислоты, как H2S, HCN, Н2SiOз, Н3ВО3, гидроксиды многих d - элементов (Сu(ОН)2, Сг(ОН)з, и др.), а также некоторые соли
(HgCl2, CdCl2, Hg(CN)2, Fe(SCN)3 и др.).
§ 2. Константа диссоциации. Закон разведения Оствальда.
Диссоциация – обратимый процесс, (исключение составляет диссоциация некоторых сильных электролитов - галогенидов щелочных металлов. Ионизация их водном растворе практически необратима). Для диссоциации растворенных веществ на ионы справедливы общие законы равновесия. Так, для процесса
Kn Anm nKm mAnn
Уравнение, выражающее константу равновесия, запишется так:
K [Km ]n [Ann ]m
Kn Anm
Константу равновесия в данном случае называют константой ионизации. Уравнение закона действия масс справедливо лишь для разбавленных растворов слабых электролитов
Закон разведения Оствальда рассмотрим на примере реакции диссоциации слабого электролита CH3COOH в водном растворе:
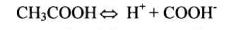 Kд [CH3COO ] [H ] [CH3COOH]
Kд [CH3COO ] [H ] [CH3COOH]
Пусть С – концентрация уксусной кислоты в растворе, а α – степень ее диссоциации. Тогда, число продиссоциировавших молекул кислоты и концентрация ионов СН3СОО– и Н+ равны (С·α), а непродиссоциировало (1– С·α), подставим в выражение константы:
61

2 С
Kд 1 С
Это соотношение называется законом разбавления (разведения) Оствальда. При небольших значениях а ~ 0.05, 1-а ~ 1, тогда получаем
 Kд
Kд
С
т. е. степень диссоциации возрастает обратно пропорционально корню квадратному из концентрации.
§ 3. Ионное произведение воды. рН и рОН
Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах. Водородный показатель обозначается рН.
Водородный показатель численно равен отрицательному десятичному логарифму активности или концентрации ионов водорода,
выраженной в молях на литр: pH = – lg[ H+ ]
Вводе концентрация ионов водорода определяется
электролитической диссоциацией воды (автопротолиз воды) по уравнению
2 Н2О H3О+ + OH –
Или H2O H+ + OH–
Константа диссоциации при 25° С составляет
Kд [H ] [OH ] 1.8 10 16 [H2O]
Пренебрегая незначительной долей распавшихся молекул, можно концентрацию недиссоциированной части воды принять равной обшей концентрации воды, которая составляет:
С(H2O) =·[H2O] = m/(M·V) = 1000 г/18г/моль·1л=55,56 моль/л. Тогда: [ H+ ]·[ OH– ] = K·[H2O]=1,8·10–16·· 55,56 = 10-14 = КВ
Для воды и ее растворов произведение концентраций ионов Н+ и ОН– величина постоянная при данной температуре. Она называется ионным произведением воды КВ и при 25° С составляет 10-14.
Постоянство ионного произведения воды дает возможность вычислить концентрацию ионов H+ если известна концентрация ионов OH– и наоборот.
Понятия кислая, нейтральная и щелочная среда приобретают количественный смысл.
В случае, если [ H+ ] =[ OH- ]эти концентрации (каждая из них)
равны 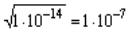 моль/л, т.е [ H+ ] =[ OH– ]=10–7моль/л и среда нейтральная, в этих растворах pH=–lg[H+]=7 и рОН=–lg[OH–]=7
моль/л, т.е [ H+ ] =[ OH– ]=10–7моль/л и среда нейтральная, в этих растворах pH=–lg[H+]=7 и рОН=–lg[OH–]=7
62

Если [H+]>10-7моль/л, |
[OH–]<10–7моль/л |
среда кислая; рН<7. |
|||||
Если [H+]<10–7 моль/л, |
[OH–]>10–7моль/л |
среда щелочная; рН>7. |
|||||
В любом водном растворе рН + рОН =14. |
|
|
|
|
|||
Таблица. Расчет водородного показателя в растворах кислот и |
|||||||
оснований. |
|
|
|
|
|
|
|
Сильная кислота |
|
|
pH lgCN(кисл) |
|
|||
|
|
|
|
|
|
|
|
Слабая кислота |
pH 1 |
(pK |
|
lgC |
|
) |
|
|
2 |
|
a |
|
N(кисл) |
, где рКа = –lgКд |
|
pH lg(CN )
Сильное основание |
|
|
pOH lgCN (основ) |
(щелочь) |
|
|
pH 14 pOH |
|
|
|
|
|
|
|
|
Слабое основание |
pOH 1 |
2 |
(pKb lgCN(основ)) |
|
|
|
pH 14 pOH 14 12(pKb lgCN(основ)) pH 14 lg(CN )
Величина рН имеет большое значение для биохимических процессов, для различных производственных процессов, при изучении свойств природных вод и возможности их применения и т.д.
Активная кислотность определяется эффективной концентрацией свободных водородных ионов в растворе. Она обусловлена наличием в растворе диссоциированных молекул кислоты. Кислотность, обусловленная наличием в растворе недиссоциированных молекул кислоты, называют потенциальной кислотностью. Общая кислотность
раствора включает в себя как диссоциированную, так и недиссоциированную часть кислоты. Общая кислотность определяется экспериментально путем титрования и поэтому называется иначе титруемой кислотностью.
Гомеостаз, гомеостазис (от гомео... и греч. stásis — состояние, неподвижность), в физиологии, относительное динамическое постоянство состава и свойств внутренней среды и устойчивость основных физиологических функций организма человека, животных и растений. Термин "Гомеостаз" предложен американским физиологом У. Кенноном в 1929. Однако представление о постоянстве внутренней среды было сформулировано ещё в 1878 французским учёным К. Бернаром. Гомеостаз
– результат сложных координационных и регуляторных взаимоотношений, осуществляемых как в целостном организме, так и на органном, клеточном и молекулярном уровнях. Благодаря приспособительным (адаптационным) механизмам физические и химические параметры, определяющие жизнедеятельность организма, меняются в сравнительно узких пределах, несмотря на значительные изменения внешних условий. У высокоорганизованных животных гомеостаз отличается наибольшим
63

совершенством. У человека, млекопитающих, птиц Г. включает поддержание постоянства концентрации водородных ионов (pH) и состава крови, осмотического давления (изоосмия), температуры тела (изотермия), кровяного давления и многих других функций. Гомеостаз обеспечивается нейро-гуморальными, гормональными, барьерными и выделительными механизмами.
Водная среда организма может иметь кислотные или щелочные свойства, которые определяются по специальной шкале, называемой pHфактором (pH — potential hydrogen — потенциальный водород). Среда может быть кислой (pH<7), нейтральной (pH=7–7,5) или щелочной
(pH>7,5).
Известно, что pH биологических жидкостей организма колеблется в пределах от 7,0 до 7,5, за исключением тех жидкостей, которые изначально имели кислую реакцию (желудочный сок и моча). Сдвиг кислотнощелочного равновесия в сторону закисления может привести к развитию болезней. Например, Ацидоз (от лат. acidus — кислый) — изменение кислотно-щелочного баланса организма в результате недостаточного выведения и окисления органических кислот. Алкало́—з увеличение pH крови (и других тканях организма) за счёт накопления щелочных веществ. Алкало́з(позднелат. alcali щелочь, от арабск. al-quali) — нарушение кислотно-щелочного равновесия организма, характеризующееся абсолютным или относительным избытком оснований.
Например, нормальное значение pH крови человека поддерживается в пределах 7,35—7,47. Несбалансированный pH-фактор — это уровень pH, при котором среда организма становится слишком кислой или слишком щелочной на длительный промежуток времени. Все регулирующие механизмы организма (включая дыхание, обмен веществ, производство гармонов) направлены на уравновешивание уровня pH путем удаления едких кислотных остатков из тканей организма, не повреждая живые клетки (гомеостаз).
64
Если уровень pH становится слишком низким (кислым) или слишком высоким (щелочным), то клетки организма отравляют сами себя своими токсичными выбросами и погибают. Разрушаются внутренние органы: печень, почки, кровеносная система, сердце. В кислой среде лучше размножаются раковые клетки.
Значение pH для различных видов напитков
|
|
Напитки типа кола |
2,5 pH |
|
|
|
|
Овощной сок |
3,9–4,3 pH |
|
|
|
|
Дистиллированная вода |
7,0 pH |
|
|
Каждую неделю вода нашего организма полностью обновляется в основном за счет жидкости, которая попадает в организм с напитками и едой. Исследования показывают, то после усвоения и переваривания пищи остаются определенные химические и металлические остатки, которые в сочетании с жидкостью в организме, приводят к кислотному или щелочному pH-уровню. Определенные продукты питания и напитки являются кислотообразующими, другие являются щелочеобразующими (см. таблицу).
В идеале человеку необходимо соблюдать баланс в употреблении разных видов напитков и продуктов. В реальности наш ежедневный рацион способствует сдвигу рН в кислую сторону. Мясо, курица, рыба, сладости, пастеризованные молочные продукты, мучные изделия и крупы
– все это поставляет в кровь кислоту. Большая часть консервантов и пищевых добавок тоже окисляют кровь, также как и алкогольные напитки, кофе, чай, шоколад, и табак. Более того, ежедневный стресс, физические нагрузки, загрязненный уличный воздух, плохая экология мегаполисов так же приводят к окислению организма.
Медики советуют отдавать предпочтение продуктам и напиткам, обеспечивающим щелочной резерв крови:
|
|
|
|
Кислотообразующая |
пища и |
Щелочеобразующая |
|
напитки |
|
|
(восстанаваливающая пища |
|
|
|
и напитки) |
|
|
||
|
|
||
Мясо животных, мясо домашней |
Фрукты, овощи, травы, орехи, |
||
птицы, кофе, газированные напитки, |
семечки, бобовые, молоко, |
||
алкоголь, никотин, яйца, злаки, |
йогурт, зеленый чай. |
||
сахар, |
мучные |
изделия, |
|
морепродукты, сыр. |
|
|
|
|
|
|
|
65

§4. Примеры решения задач.
1.Вычислите водородный показатель рН раствора гидроксида натрия,
содержащегося в растворе 4,2.10-3 моль/л.
Решение.
Исходя из ионного произведения воды Кв, находим концентрацию
ионов водорода, учитывая, что СОН- = 4,2.10-3 моль/л.
СН+ = К(Н2О)/СОН- = 10-14/4,2.10-3 = 0,24.10-11.
Водородный показатель раствора КОН равен:
рН = lgH+ = lg(0,24.10-11) = 11,62.
2. Рассчитайте концентрацию ионов ОН- в растворе, рН которого равен
3,28.
Решение По значению рН определяем концентрацию ионов Н+ в растворе:
рН = lgCH+; lgCH+ = 3,28 , отсюда СН+ = 5,25.10-4 моль/л.
Концентрацию ионов ОН- определяют по значению ионного
произведения воды:
СОН-=10-14/(5,25.10-4) = 0,19.10-10 моль/л.
3. Рассчитайте степень ионизации уксусной кислоты в водном растворе с концентрацией 0,100 моль/л и рН данного раствора (Кд = 1,75 10 5).
Решение:
1. Рассчитываем степень ионизации и равновесную концентрацию ионов оксония в растворе:
|
Ka |
|
1,75 10 |
5 |
-2 |
|
|
αa |
|
|
|
|
= 1,32·10 |
|
или 1,32% |
Ca |
0,100 |
|
|
||||
|
|
|
|
|
|
||
[H3O+] = Caαa = 0,100·1,32·10-2 = 1,32·10-3 моль/л 2. Вычисляем рН раствора:
рН = – lg a(H3O+) = – lg [H3O+] = – lg 1,32·10-3 = 2,88
§5. Задачи для самостоятельного решения
1.Для вывода из обморочного состояния в медицине используют раствор аммиака в воде – нашатырный спирт, 10 % раствор аммиака. Определите
степень диссоциации гидроксида аммония, если его рН равен 10,3 при
25 oС.
66
2. Вычислите концентрацию ионов гидроксила в биологических объектах при указанных значениях pH (таблица).
Биожидкость |
РН в норме |
Сыворотка крови |
7,4±0,05 |
Слюна |
6,35-6,85 |
Чистый желудочный сок |
1,5-1,8 |
Моча |
4,8-7,5 |
Спинно-мозговая жидкость |
7,4±0,05 |
Сок поджелудочной железы |
7,5-8,0 |
Содержимое тонкого кишечника |
7,4—8,0 |
Желчь в протоках |
7,4-8,5 |
Желчь в пузыре |
5,4-6,9 |
Молоко |
6,6-6,9 |
3.Вычислите pH водного раствора в 0,01М раствора КОН, считая, что щелочь продиссоциировала полностью.
4.Вычислите рН раствора, полученного при смешении равных объемов 0.04М раствора гидроксида натрия и 0.02 М раствора бромоводородной кислоты.
5.Рассчитайте концентрацию ионов ОН- в растворе, рOН которого равен
3,28.
6.Расчитайте рН 0,023 М раствора сахарина, если Кд для этого сахаразаменителя 2,1·10–12.
7.На предприятии не хватило запаса соды для нейтрализации кислотных
отходов, и 3,15 кг азотной кислоты были вылиты в канализацию, а оттуда попали в пруд емкостью 10000 м3. После этого в пруду погибла вся рыба. Определите водородный показатель воды, загрязненной азотной кислотой.
8.Самый дешевый щелочной реагент для нейтрализации кислотных промышленных стоков - гашеная известь (гидроксид кальция). Используют как суспензию гидроксида кальция ("известковое молоко"), так и прозрачный раствор ("известковую воду"). Рассчитайте рН 0,02М раствора Ca(OH)2.
9.Уксусная кислота - слабая (диссоциирует в водном растворе только частично). Тем не менее, поскольку кислотная среда подавляет жизнедеятельность микроорганизмов, уксусную кислоту используют при консервировании пищевых продуктов, например, в составе маринадов.
67
Установлено, что в 0,01 M растворе уксусной кислоты степень диссоциации a составляет 4,2%. Рассчитайте рН этого раствора.
§6. Лабораторная работа «Определение рН растворов»
Цель работы: Научиться определять рН растворов с помощью индикаторов.
Опыт 1 Определение реакции растворов с помощью индикаторных полосок.
Этот метод достаточно широко вошел в практику, и выполним в любых условиях. Определение реакции растворов производят, используя монофункциональные или полифункциональные индикаторные полоски. Большинство полосок рассчитано на определение рН растворов в диапазоне от 0 до 14 и основано на индикаторном методе, суть которого заключается в использовании в качестве реагента индикаторной зоны для pH красителя лакмуса. Лакмус - это красящее вещество, добываемое из некоторых видов лишайника. Состав его сложен. Лакмус – слабая кислота, которой пропитывают бумагу. В зависимости от рН индикаторная зона приобретает соответствующий цвет. Значение pH определяется визуально (в соответствии со шкалой сравнения, где указано, какое значение pH какой окраске соответствует). Метод достаточно прост
ибыстр в исполнении. При его использовании необходимо соблюдать все требования, предъявляемые в инструкции к данному виду индикаторных полосок.
Ход работы: Полоску индикаторной бумаги обмакнуть в исследуемые растворы: кислота, основание/щелочь, соль, затем быстро положить на белую подложку. Быстро нужно класть потому, что индикатор растворится в жидкости и бумага станет белой. Далее сравнить окраску бумаги с эталоном цветной шкалы.
Опыт 2. Унифицированный метод определения рН с индикатором.
Практическое выполнение этого эксперимента очень просто и при большом количестве исследований значительно экономит время, однако дает только ориентировочное представление о кислой или щелочной реакции.
Ход работы: По 1 мл исследуемых растворов помещают в пробирки
идобавляют по 1 – 2 капли раствора индикатора. Граница переходных цветов индикатора указан в таблице; этот диапазон обеспечивает определение кислой и щелочной реакции. Например, желтый цвет метилоранжа соответствует слабощелочной и щелочной реакции, оранжевый – слабокислой, красный – кислой.
68

69
ТЕМА 6. БУФЕРНЫЕ РАСТВОРЫ
Вопросы к занятию
1.Буферные системы, их классификация и механизм действия.
2.Основное уравнение теории буферного действия: уравнение Гендерсона – Гассельбаха.
3.Буферная емкость и ее определение.
4.Кислотно-щелочное равновесие в организме человека. Буферные системы и регуляции кислотно-основного равновесия в организме.
§1. Состав и классификация буферных растворов.
Буферными называют растворы, рН которых практически на изменяется от добавления к ним небольших количеств сильной кислоты или щелочи, а также при разведении.
Простейший буферный раствор это смесь слабой кислоты и соли, имеющей с этой кислотой общий анион (например, смесь уксусной кислоты СН3СООН и ацетата натрия СН3СООNa), либо смесь слабого основания и соли, имеющей с этим основанием общий катион (например, смесь гидроксида аммония NH4OH с хлоридом аммония NH4Cl).
С точки зрения протонной теории буферное действие растворов обусловлено наличием кислотно-основного равновесия общего типа: В основание + ВН+ сопряженная кислота НА кислота + А– сопряженное основание. Сопряженные кислотно-основные пары В /ВН+ и А– /НА называют буферными системами.
Буферные растворы играют большую роль в жизнедеятельности. К числу исключительных свойств живых организмов относится их способность поддерживать постоянство рН биологических жидкостей, тканей и органов кислотно-основной гомеостаз. Это постоянство обусловлено наличием нескольких буферных систем, входящих в состав этих тканей.
Буферные системы могут быть четырех типов: 1. Слабая кислота и ее анион А– /НА:
ацетатная буферная система СН3СОО–/СН3СООН в растворе СН3СООNa и СН3СООН, область действия рН 3,8–5,8.
Бикарбонатная система НСО3–/Н2СО3 в растворе NaНСО3 и Н2СО3, область её действия рН 5,4–7,4.
2. Слабое основание и его катион В/ВН+:
аммиачная буферная система NH3/NH4+ в растворе NH3 и NH4Cl, область ее действия рН 8,2–10,2
3. Солевые системы - анионы кислой и средней соли или двух кислых солей:
70
