
полезная метода
.pdf
В анионе H2 на двух молекулярных орбиталях необходимо разместить уже три электрона (рисунок 10).
Рис.10. Энергетическая диаграмма образования аниона молекулы H2 по методу МО ЛКАО
Если два электрона, опустившись на связывающую орбиталь, дают выигрыш в энергии, то третьему электрону приходится повысить свою энергию. Однако энергия, выигранная двумя электронами, больше, чем проигранная одним. Такая частица может существовать.
Известно, что щелочные металлы в газообразном состоянии существуют в виде двухатомных молекул. Попробуем убедиться в возможности существования двухатомной молекулы Li2, используя метод МО ЛКАО. Исходный атом лития содержит электроны на двух энергетических уровнях – первом и втором (1s и 2s) (рисунок 11).
Рис.11. Энергетическая диаграмма образования двухатомной молекулы Li2 по методу МО ЛКАО
141

Перекрывание одинаковых 1s-орбиталей атомов лития даст две молекулярные орбитали (связывающую и разрыхляющую), которые согласно принципу минимума энергии будут полностью заселены четырьмя электронами. Выигрыш в энергии, получаемый в результате перехода двух электронов на связывающую молекулярную орбиталь, не способен компенсировать ее потери при переходе двух других электронов на разрыхляющую молекулярную орбиталь. Вот почему вклад в образование химической связи между атомами лития вносят лишь электроны внешнего (валентного) электронного слоя. Перекрывание валентных 2s-орбиталей атомов лития приведет также к образованию одной -связывающей и одной разрыхляющей молекулярных орбиталей. Два внешних электрона займут связывающую орбиталь, обеспечивая общий выигрыш в энергии (кратность связи равна 1).
-связывающей и одной разрыхляющей молекулярных орбиталей. Два внешних электрона займут связывающую орбиталь, обеспечивая общий выигрыш в энергии (кратность связи равна 1).
Используя метод МО ЛКАО, рассмотрим возможность образования молекулы He2 (рисунок 12).
Рис.12. Энергетическая диаграмма, иллюстрирующая с помощью метода МО ЛКАО невозможность образования химической связи между атомами He
В этом случае два электрона займут связывающую молекулярную орбиталь, а два других – разрыхляющую. Выигрыша в энергии такое заселение двух орбиталей электронами не принесет. Следовательно, молекулы He2 не существует.
§14. Водородная связь
Водородная связь – это разновидность ковалентной связи, образованной по донорно-акцепторному механизму.
Если водород в соединении взаимодействует с сильно электроотрицательным элементом (F, O, N, S, Cl), то он может образовывать дополнительную связь с этим атомом.
Энергия водородной связи невелика 8…40 кДж/моль, поэтому она легко образуется и легко разрушается.
H…F |
H…O |
H…N |
40 кДж/моль |
20 кДж/моль 8 кДж/моль |
|
142

С уменьшение электроотрицательности атома, энергия связи также уменьшается.
Так при образовании молекулы воды, ковалентная связь О – Н сильнополяризована за счёт электроотрицательности атома кислорода. Электронное облако связи смещено к кислороду, и вследствие этого, кислород приобретает эффективный отрицательный заряд –δ, а водород +δ, т.е. водород почти лишается электронного облака. Между Н одной молекулы и О другой молекулы возникает электростатическое притяжение и , как следствие, водородная связь.
Образуется молекула состава (Н2О)n.
Благодаря водородным связям температура плавления и кипения в таких соединениях значительно выше, чем у аналогичных соединений без водородных связей.
Водородная связь бывает двух видов:
1. Внутримолекулярная – связь, образованная между атомами одной молекулы
 O H
O H
.
:
C O
O
HO
143

2. Межмолекулярная – между атомами разных молекул. За счёт таких связей удерживаются спирали белков, нуклеиновых кислот.
§15. Примеры решения задач.
1. Какую ковалентность может проявлять бром в своих соединениях?
Решение В атоме брома распределение электронов внешнего энергетического
уровня по орбиталям следующее:
 Ковалентность брома, определяемая по методу валентных связей (ВС) числом неспаренных электронов, равна единице. Но бром может проявлять и большую ковалентность, а именно, 3 и выше. У атомов брома есть свободные d-орбитали на 4-м энергетическом уровне. Если, например, один из электронов 4-го энергетического уровня перейдет с р-орбитали на d-орбиталь, то ковалентность брома будет равной 3:
Ковалентность брома, определяемая по методу валентных связей (ВС) числом неспаренных электронов, равна единице. Но бром может проявлять и большую ковалентность, а именно, 3 и выше. У атомов брома есть свободные d-орбитали на 4-м энергетическом уровне. Если, например, один из электронов 4-го энергетического уровня перейдет с р-орбитали на d-орбиталь, то ковалентность брома будет равной 3:
 Аналогичным образом объясняется ковалентность 5 и 7. 2. Электроны каких состояний (s-, px-, py-, pz-) второго энергетического уровня атома углерода участвуют в образовании - и -связей в молекуле этилена Н2С = СН2?
Аналогичным образом объясняется ковалентность 5 и 7. 2. Электроны каких состояний (s-, px-, py-, pz-) второго энергетического уровня атома углерода участвуют в образовании - и -связей в молекуле этилена Н2С = СН2?
Решение. Электронная конфигурация возбужденного атома углерода может быть представлена следующим образом:
 В образовании химической связи атомов углерода участвуют четыре непарных электрона 2-го энергетического уровня: один электрон в s- и три электрона в р-состоянии.
В образовании химической связи атомов углерода участвуют четыре непарных электрона 2-го энергетического уровня: один электрон в s- и три электрона в р-состоянии.
В молекуле этилена между атомами углерода две связи: одна - связь и одна - связь. -связь осуществляется при перекрывании sp2гибридных облаков соединяющихся атомов углерода. sp2-гибридизация происходит при перекрывании облаков электронов в s-, py- и рх-
144
состояниях. Атомы водорода к атомам углерода присоединяются также за счет -связи, которая создается перекрыванием sp2-гибридного облака атома углерода и s-облака атома водорода. -связь образована при перкрывании "чистых" (негибридизованных) рz-электронов облаков связывающихся атомов углерода.
3. Объясните изменение валентного угла между связями в ряду соединений: Н2О, H2S, H2Se, H2Te.
Решение. В ряду О - S - Se усиливается металлические свойства элементов. По мере увеличения размеров электронных облаков в этом ряду элементов полярность и прочность связи Э - Н уменьшаются. Поэтому участие s-орбиталей в гибридизации с р-орбиталями для этих элементов становится все менее характерным. Так, в молекуле Н2О связи О - Н
образованы электронами sp3-гибридных орбиталей. Для теллура sp3гибридное состояние практически не характерно. Это подтверждается уменьшением значения валентного угла от 104,50 у Н2О до 900 у Н2Те. 4. Расположите электроны на молекулярных орбиталях в молекуле F2.
Решение. В методе МО молекула рассматривается как единая система, содержащая ядра и электроны. При образовании молекулы возникают молекулярные орбитали двух видов связывающие и разрыхляющие. Если при образовании молекулы из атомов переход электрона на молекулярную орбиталь сопровождается уменьшением энергии, то такая молекулярная орбиталь будет связывающей, если увеличением энергии то, разрыхляющей.
Электроны в молекулах располагаются на -, - и -молекулярных орбиталях. -Орбиталь может быть скомбинирована из s-атомных орбиталей, причем образуются молекулярные орбитали двух типов: связывающие св - и разрыхляющие разр , -молекулярные орбитали могут быть образованы и перекрыванием 2рх-атомных орбиталей. При перекрывании 2ру- и 2рz-атомных орбиталей образуются y и z молекулярные орбитали.
Молекулярные орбитали в порядке возрастания энергии располагаются следующим образом (при большом энергетическом
различии 2s- и 2р-орбиталей):
1sсв 1sр 2sсв 2sр 2рхсв 2русв= 2рzсв 2рур= 2рzр 2рхр
Порядок размещения электронов по молекулярным орбиталям тот же, что и в случае атомных орбиталей: прежде всего заполняются орбитали с низкой энергией; заполнение орбиталей подчиняется принципу Паули (на каждой орбитали не может быть более двух электронов с противоположными спинами) и правилу Хунда.
Молекула фтора состоит из двух атомов, в ней 18 электронов. Реакцию образования молекулы F2 из атомов и распределение электронов
145
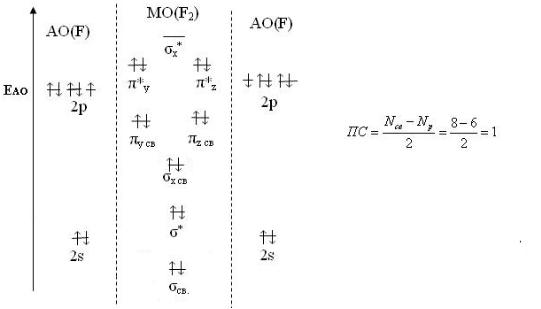
соединяющихся атомов на молекулярных орбиталях в системе обозначений метода молекулярных орбиталей можно записать следующим образом (цифра за скобкой показывает число электронов на орбитали):
2F[1s22s22p5]=
F2[( 1sсв)2( 1sр)2( 2sсв)2( 2sр)2( 2рхсв)2( 2ру, 2рzсв)4( 2ру, 2рzр)4
Cхему образования молекулярных орбиталей в молекуле можно представить диаграммой.
§16. Задачи для самостоятельного решения
1.Энергетическое состояние внешнего электрона атома описывается следующими значениями квантовых чисел: n=3, l = 0, m = 0. Атомы каких элементов имеют такой электрон? Составьте электронные формулы атомов этих элементов.
2.Напишите электронные формулы для атомов натрия, хрома, европия, железа, аргона.
3.Пользуясь правилом Гунда, распределите электроны по орбиталям, отвечающим низшему энергетическому состоянию атомов: марганца, азота, кислорода, кремния, кобальта.
4.Какой тип гибридизации электронных облаков в молекулах BeH2, SiH4,
CS2, BBr3? Какую пространственную конфигурацию имеют эти молекулы? 5. Как изменится значение угла между связями в ряду соединений NH3,
PH3, AsH3, SbH3?
6. Какие электроны (рх, ру, рz) участвуют в образовании - и -связей в молекуле азота?
7.Рассмотрите молекулы В2О3 и NH3 с позиций метода ВС. Отметьте:
1)из каких электронов образуются связывающие пары;
2)есть ли неподеленные пары и у каких атомов;
146
3)есть ли вакантные орбитали и у каких атомов;
4)возможно ли образование донорно-акцепторных связей.
8.Опишите методом МО молекулу N2. Изобразите схему образования
молекулярных орбиталей в молекуле из атомов азота.
9. Изобразите схему МО и определите порядок связи для частицы В2+.
147
ТЕМА 11. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
Вопросы к занятию
1.Координационная теория А.Вернера и ее развитие Л.А.Чугаевым.
2.Понятие о координационном числе, комплексообразователе и лигандах.
3.Классификация и номенклатура комплексных соединений. Внутрикомплексные соединения.
4.Понятие об изомерии комплексных соединений и ее типы.
5.Природа химической связи в комплексных соединениях в свете метода валентных связей, теории кристаллического поля, метода молекулярных орбиталей..
6.Факторы, влияющие на комплексообразующую способность d- элементов.
7.Ионные равновесия в растворах комплексных соединений. Константа нестойкости комплекса.
8.Значение комплексных соединений в биологии и медицине.
§1.Строение комплексных соединений. Основные положения теории Вернера о строении комплексных соединений
Многие процессы жизнедеятельности организма протекают с участием комплексных соединений. В живых организмах присутствуют комплексные соединения биогенных металлов с белками, витаминами и другими веществами, играющими роль ферментов или выполняющими специфические функции в обмене веществ.
В в. в химии было накоплено большое число фактов, необъяснимых с точки зрения существовавшей тогда теории валентности. Многие вещества, в которых элементы, казалось бы, уже полностью использовали свои валентности, сохраняли способность к дальнейшему присоединению различных ионов и молекул. При этом новые, «незаконные» (с точки зрения теории валентности) связи оказывались не менее прочными, чем «обычные» валентные связи. Некоторые из вновь открытых соединений были названы двойными солями (например, 3КF·AlF3), другие – аммиакатами, (например CuSO4·4NH3), третьи – кристаллогидратами (CuCl2∙·6H2O) и т. д.
Крупнейший русский химик Лев Александрович Чугаев, получивший мировое признание за работы по химии комплексных соединений, писал, что эта область «по своей запутанности, по противоречивости фактических данных и отсутствию какой-либо общей
148
руководящей идеи казалась совершенно безнадежной для систематической разработки».
Такой «общей руководящей идеей» стала разработанная к 1893 г. швейцарским химиком Альфредом Вернером теория строения
комплексных (или координационных) соединений
Вернер разделил все неорганические вещества на так называемые соединения первого и высшего порядка. К соединениям первого порядка он отнес главным образом достаточно простые по своей структуре вещества (H2O, NaCl, PCl3). Соединениями высшего порядка ученый предложил считать продукты взаимодействия между собой соединений первого порядка – кристаллогидраты, аммиакаты, полисульфиды, двойные соли, а также комплексные соединения.
Комплексное соединение, по Вернеру, имеет в своей структуре центральный атом (ион), названный комплексообразователем, который равномерно окружен различными ионами или нейтральными молекулами.
Комплексообразователь (центральный атом) – атом или ион,
предоставляя свободные атомные орбитали, является акцептором электронных пар и занимает центральное положение в комплексном соединении.
Молекулы или ионы, которые окружают комплексообразователь, позднее названные лигандами (от лат. ligare – «связывать») являются донорами электронных пар и непосредственно связанны с центральным атомом (ионом) ковалентной связью, образованной по донорноакцепторному механизму.
Роль комплексообразователя может играть любой элемент периодической системы. В соответствии со своей химической природой неметаллические элементы обычно дают анионные комплексы, в которых роль лигандов играют атомы наиболее электроотрицательных элементов. Типичные металлические элементы (щелочные и щелочноземельные металлы) проявляют слабую способность к комплексообразованию. Амфотерные элементы, которые занимают промежуточное положение между типичными металлическими и неметаллическими элементами, образуют как катионные, так и анионные комплексные соединения, например [Al(H2O)6]Cl3 и K[Al(OH)4]. Наиболее выраженную способность к комплексообразованию проявляют атомы или ионы d-, и f-элементов, так как они имеют достаточно большой заряд ядра и способны предоставлять необходимое количество вакантных орбиталей для образования связей с лигандами.
Число донорных атомов лигандов, непосредственно связанных с центральным атомом, называется его координационным числом. Значение координационного числа комплексообразователя зависит от многих факторов, но обычно оно равно удвоенному заряду иона комплексообразователя.
149

Вернер предложил в каждом комплексном соединении различать две координационные сферы: внутреннюю и внешнюю. Внутренняя сфера комплексного соединения есть совокупность центрального атома и лигандов. При записи состава комплексных соединений принято центральный атом вместе со всеми ионами и молекулами, входящими во внутреннюю сферу, заключать в квадратные скобки. Вне скобок остаются лишь ионы внешней сферы, нейтрализующие заряд комплексного иона; в ряде комплексных соединений внешняя сфера может отсутствовать. Ионы внешней сферы связаны с комплексным ионом посредством ионной связи.
Именно внешние ионы при растворении комплексного соединения в воде легко отщепляются и находятся в растворе самостоятельно, обуславливая (совместно с комплексным ионом) его электропроводность. Лиганды внутренней координационной сферы связаны с центральным атомом настолько прочно, что, по меткому выражению Вернера, словно «исчезают» внутри комплекса, не проявляя себя ни в аналитических реакциях, ни в электропроводности раствора. Именно поэтому,
комплексными Вернер назвал соединения, устойчивые в растворах и не проявляющие свойств исходных для них соединений первого порядка.
центральный атом (комплексообразователь) лиганды
[Cu(NH3)4(H2O)2]SO4
внутренняя сфера |
ионы внешней сферы |
Рис.1.Общее строение комплексных соединений.
§2. Классификация комплексных соединений
По характеру электрического заряда комплексного иона различают катионные, анионные и нейтральные комплексные соединения.
Заряд комплексного иона определяется алгебраической суммой зарядов комплексообразователя и всех лигандов.
Например, комплексный ион [Cu+2(NH3)4]z, z = +2 + 4∙0 = +2, то есть
[Cu+2(NH3)4]2+.
Внутренняя сфера может быть:
А) заряжена положительно – такие комплексы называют катионными: [Al(H2O)6]Cl3 – хлорид гексаакваалюминия (ІІІ), [Zn(NH3)4]SO4 –сульфат тетраамминцинка (ІІ).
150
