
полезная метода
.pdf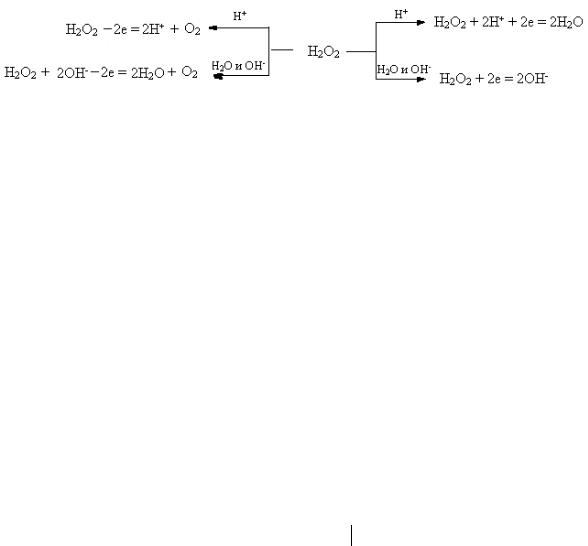
3C0 + 6H2O + 4NO3- + 16H+ → 3CO2 + 12H+ + 4NO + 8H2O или 3C0 + 4NO3- + 4H+ → 3CO2 + 4NO + 2H2O
2)
3P0 + 5HN+5O3 + 2H2O → 3H3P+5O4 + 5N+2O
электронный баланс: |
|
|
|
P0 - 5ē → P+5 |
3 |
|
|
N+5 + 3ē → N+2 |
5 |
|
|
метод полуреакций: |
|
|
|
P0 + 4H2O - 5ē →PO43- + 8H+ |
|
3 |
|
|
|||
NO3- + 4H+ + 3ē → NO+ 2H2O |
|
5 |
|
–––––––––––––––––––––––––––––––––––––––––––––––– |
|
|
|
3P0 + 12H2O + 5NO3- + 20H+ → 3PO43- + 24H+ + 5NO + 10H2O или 3P0 + 2H2O + 5NO3- → 3PO43- + 4H+ + 5NO
Пероксид водорода в окислительно-восстановительных реакциях может быть и окислителем и восстановителем.
1.Обычно пероксид водорода используют как окислитель:
H2O2 + 2HI-1 → I20 + 2H2O
электронный баланс: |
|
|
|
2I- - 2ē → I20 |
1 |
|
|
[O2]-2 + 2ē → 2O-2 |
1 |
|
|
метод полуреакций: |
|
|
|
2I- - 2ē → I20 |
|
|
1 |
|
|||
H2O2 + 2H+ + 2ē → 2H2O |
|
1 |
|
–––––––––––––––––––––– |
|
|
|
2I- + H2O2 + 2H+ → I2 + 2H2O |
|||
При действии сильных окислителей пероксид водорода может окисляться, образуя кислород и воду.
5H2O2 + 2KMn+7O4 + 3H2SO4 → 5O20 + K2SO4 + 2Mn2+SO4 + 8H2O
электронный баланс:
[O2]-2 - 2ē→ O20 5
111

Mn+7 + 5ē → Mn+2 2
метод полуреакций:
MnO4- + 8H+ + 5ē → Mn2+ + 4H2O 2 |
|
H2O2 - 2ē → O2 + 2H+ |
5 |
––––––––––––––––––––––––––––––––––––––––––
2MnO4- + 5H2O2 + 16H+ → 2Mn2+ + 8H2O + 5O2 + 10H+ или 2MnO4- + 5H2O2 + 6H+ → 2Mn2+ + 8H2O + 5O2
§4. Окислительно-восстановительный потенциал.
Окислительную способность веществ характеризует окислительновосстановительный потенциал E. В справочниках приведены стандартные окислительно-восстановительные потенциалы Eo, измеренные относительно обратимого водородного электрода.
В любой окислительно-восстановительной реакции как в исходных веществах, так и в продуктах реакции, имеются сопряженные пары окислитель-восстановитель. Направление окислительновосстановительной реакции обусловливает тот окислитель, у которого значение электродного потенциала больше.
Например, в смеси веществ: K2Cr2O7, HCl, CrCl3, Cl2 окислителями являются K2Cr2O7 и Cl2. Их стандартные окислительно-восстановительные потенциалы соответственно равны:.
Cr2O7 |
2– + 14H+ +6e = 2Cr 3+ + 7H2O |
Eo= +1,33В |
Cl2 +2e = 2Cl– |
Eo = +1,36В |
|
У хлора стандартный электродный потенциал выше, следовательно в стандартных условиях он является более сильным окислителем, чем дихромат калия. Соответственно в смеси веществ при стандартных условиях должна идти реакция:
2CrCl3 + 3Cl2 + 7H2O → K2Cr2O7 + 14HCl
Окислительно-восстановительные реакции протекают самопроизвольно, если разность стандартных электродных потенциалов окислителя и восстановителя, или э.д.с. окислительно-восстановительной реакции
 E = φox – φred > 0.
E = φox – φred > 0.
112
§4. Примеры решения типовых задач
1. Составление уравнений реакций межмолекулярного окисления -- восстановления.
Составьте уравнение реакции
NaNO2 + KMnO4 + H2SO4 → NaNO3 + MnSO4 + K2SO4 + + H2O.
Решение К межмолекулярным окислительно-восстановительным реакциям относятся реакции, в которых меняются степени окисления атомов элементов в молекулах (ионах) разных веществ.
Изменение степеней окисления реагирующих веществ принято изображать с помощью электронно-ионных схем реакций. В электронноионную схему реакции кроме частиц, подвергшихся окислительновосстановительному изменению, включаются молекулы и ионы, характеризующие среду: кислую ион Н+, щелочную ион ОН-, нейтральную молекулы Н2О. Электронно-ионные уравнения составляют отдельно для окислительного и восстановительного процессов. Для данной реакции электронно-ионная схема имеет вид:
NO2 + H2O - 2e → NO3- + 2H+ (окисление)
MnO4 + 8H+ + 5e → Mn2+ + 4H2O (восстановление)
Число электронов, отдаваемых восстановителем, всегда равно числу электронов, принимаемых окислителем. Исходя из равенства отданных и принятых электронов, определяем основные коэффициенты уравнения:
NO2 + H2O - 2e → NO3 + 2H+ |
| 5 |
MnO4 + 8H+ + 5e → Mn2+ + 4H2O |
2 |
В реакции пять молей нитрита натрия окисляются двумя молями перманганата калия. Складываем алгебраически уравнения, выражающие процесс окисления и восстановления. Электронно-ионный баланс реакции:
5NO2 –10e + 5H2O +2MnO4 +10e +16H+ → 5NO3 + 10H+ +2Mn2++8H2O
После преобразований получаем:
5NO2 + 2MnO4 + 6H+ → 5NO3 + 2Mn2+ + 3H2O.
Окончательный вид уравнения реакции:
5NaNO2 + 2KMnO4 + 3H2SO4 → 5NaNO3 + 2MnSO4 + + K2SO4 ++3H2O.
Признаком правильности подбора коэффициентов уравнения является одинаковое число атомов каждого элемента в левой и правой частях уравнения.
2. Составление уравнений окислительно-восстановительных реакций диспропорционирования.
Составьте уравнение реакции диспропорционирования азотистой кислоты.
Решение Реакция диспропорционирования заключается в том, что молекулы одного и того же вещества реагируют друг с другом как
113
окислитель и восстановитель, так как в них содержатся атомы элементов с промежуточной степенью окисления, способные отдавать и принимать электроны. Схема реакции диспропорционирования азотистой кислоты в молекулярном виде:
HNO2 + HNO2 → HNO3 + NO + H2O |
|
|
Электронно-ионная схема реакции: |
|
|
(окисление) |
NO2 + H2O - 2e → NO3 + 2H+ |
| 1 |
(восстановление) |
NO2 + 2H+ + e → NO + H2O |
2 |
Электронно-ионный баланс реакции:
NO2 - 2e + H2O + 2NO2 + 2e + 4H+ → NO3 + 2H+ + + 2NO + 2H2O
3NO2 + 2H+ → NO3 + NO + H2O
Таким образом, из каждых трех молекул азотистой кислоты в двух азот (+3) проявляет окислительные свойства, а в одной восстановительные. Окончательный вид уравнения реакции диспропорционирования азотистой кислоты:
3HNO2 → HNO3 + NO + H2O.
3. Составление уравнений реакций внутримолекулярного окислениявосстановления.
Составьте уравнение реакции внутримолекулярного окислениявосстановления дихромата аммония.
Решение
Кэтому виду реакций относят такие реакции, в которых окислитель
ивосстановитель находятся в составе одной и той же молекулы. Схема реакции внутримолекулярного окисления-восстановления дихромата аммония:
(NH4)2Cr2O7 N2 + Cr2O3 + H2O
Для составления уравнений окислительно-восстановительных реакций, протекающих в отсутствие воды, применяется метод электронного баланса.
Схема электронного баланса реакции:
(окисление) |
2N3 6e → N2 |
||
(восстановление) |
2Cr6+ + 6e → 2Cr3+ |
||
|
|
|
|
2N3 + 2Cr6+ → N2 + 2Cr3+
По числу атомов водорода в молекуле (NH4)2Cr2O7 определяем, что при разложении 1 моль дихромата аммония образуется 4 моль воды. В окончательном виде уравнение реакции:
(NH4)2Cr2O7→ N2 + Cr2O3 + 4H2O.
4. Определение направления окислительно-восстановительной реакции по значению окислительно-восстановительных потенциалов реагирующих веществ.
Можно ли в качестве окислителя в кислой среде использовать
114
K2Cr2O7 в следующих процессах при стандартных условиях: |
|
||
а) 2F – 2e → F2, |
0 |
= 2,85B; |
|
б) 2Cl – 2e → Cl2, |
0 |
= 1,36B; |
|
в) 2Br – 2e → Br2, |
0 |
= 1,06B; |
|
г) 2I – 2e → I2, |
0 |
= 0,54B. |
|
Стандартный окислительно-восстановительный потенциал 0 |
системы |
||
Cr2O72 + 14H+ + 6e = 2Cr3+ + 7H2O равен 1,33 В |
|
||
Решение |
|
|
|
Мерой окислительно-восстановительной способности |
веществ |
||
служат их окислительно-восстановительные потенциалы (табл.). Чем больше алгебраическая величина стандартного окислительновосстановительного потенциала данного атома или иона, тем больше его окислительные свойства, а чем меньше алгебраическое значение окислительно-восстановительного потенциала атома или иона, тем больше его восстановительные свойства.
Для определения направления окислительно-восстановительной реакции необходимо найти ЭДС гальванического элемента, образованного из данного окислителя и восстановителя. ЭДС (Е) окислительно-
восстановительного гальванического элемента равна: E 1 2 где |
10, |
20 соответственно потенциалы окислителя и восстановителя. Если Е > 0, то данная реакция возможна. Для выяснения возможности использования
K2Cr2O7 |
|
в качестве окислителя определим ЭДС следующих |
||||||||||||
гальванических элементов: |
|
|
||||||||||||
|
|
|
|
|
|
2 |
|
|
|
|
3+ |
Е = 1,33 - 2,85 = – 1,52В; |
||
F2 F Cr2O7 |
|
Cr |
3+ |
|||||||||||
|
|
|
|
|
|
|
|
2 |
Cr |
Е = 1,33 - 1,36 = – 0,03В; |
||||
Cl2 Cl Cr2O7 |
|
|
3+ |
|||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
Е = 1,33 - 1,06 =+0,27В; |
|||
Br2 Br Cr2O7 |
|
|
Cr |
|||||||||||
J |
J Cr |
2 |
O |
7 |
2 Cr3+ |
|
Е = 1,33 - 0,54 = +0,79В. |
|||||||
2 |
|
|
|
|
|
|
|
|
|
|
|
|
||
|
Дихромат калия может быть использован в качестве окислителя |
|||||||||||||
только для процессов: 2Br – 2e → Br2; |
2I – 2e = I2. |
|||||||||||||
§5. Задачи для самостоятельного решения
1. Составьте электронно-ионные схемы и закончите уравнения следующих
реакций:
а) H2S + HNO3 = S + NO2 + ...
б) HClO3 = НClO2 + HClO4 + ...
в) KClO3 = O2 + КCl
г) HIO3 + H2O2 = I2 + O2 + H2O
д) NaBr + MnO2 + H2SO4 = MnSO4 + Br2 + ...
е) Al + HNO3 = NH4NO3 + ...
115
2. Возможна ли реакция между KClO3 и MnO2 в кислой среде? Подтвердите ответ значениями окислительно-восстановительного потенциала.
3.Какой из окислителей MnO2, PbO2,K2Cr2O7 является наиболее эффективным по отношению к HCl при получении Cl2?
4.Составьте электронно-ионные схемы и закончите уравнения следующих реакций:
а) H2S + HNO3 = S + NO2 + ...
б) HClO3 = НClO2 + HClO4
в) KClO3 = O2 + КCl
г) HIO3 + H2O2 = I2 + O2 + H2O
д) NaBr + MnO2 + H2SO4 = MnSO4 + Br2 + ...
е) Al + HNO3 = NH4NO3 + ...
§6. Лабораторная работа «Окислительно-восстановительные реакции
I Реакции межмолекулярного окисления-восстановления.
Опыт 1. Поместите в пробирку несколько кусочков медной стружки и облейте их концентрированной азотной кислотой. Обратите внимание на цвет выделяющегося газа и изменение цвета раствора.
Опыт 2. Налейте в пробирку 1 мл раствора сероводородной воды, добавьте 1 мл сульфита натрия. Что наблюдается?
Опыт 3. Возьмите 2 пробирки, в одну из них налейте бромид калия, а в другую -- йодид калия. Добавьте в каждую пробирку по 3-5 капель бензола и по 1-2 мл хлорной воды, встряхните и наблюдайте появление окраски бензольного кольца. Объясните наблюдаемое явление, написав уравнение реакции.
Опыт 4. Налейте в две пробирки по 3-4 капли раствора дихромата калия, добавьте в одну из пробирок 2-3 капли 2н раствора серной кислоты, в другую -- 2-3 капли 2н раствора щелочи. Обратите внимание на изменение цвета раствора во второй пробирке. Добавьте в обе пробирки нитрита натрия. Дайте объяснение наблюдаемым явлениям.
Опыт 5.
а) К подкисленному серной кислотой раствору перманганата калия добавьте раствор сульфита натрия. Как изменится цвет раствора?
б) Проделайте эту же реакцию без подкисления. Как в этом случае меняется цвет раствора? Обратите внимание на образование осадка.
в) К сильно щелочному раствору сульфита натрия прибавьте раствор перманганата калия. Как изменится цвет раствора? Влияет ли изменение кислотности среды на протекание исследуемой реакции?
116
II. Окислительно-восстановительная двойственность.
Опыт 6.
а) К подкисленному серной кислотой раствору KMnO4 добавьте до обесцвечивания раствора NaNO2.
б) К подкисленному серной кислотой раствору йодида калия добавьте несколько капель NaNO2. Что наблюдаете? Какова функция
NaNO2 в опытах (а) и (б) ?
Опыт 7.
а) К подкисленному серной кислотой раствору KMnO4 добавьте небольшой объем раствора Н2О2. Обратите внимание на выделение газа; испытайте его предварительно подготовленной тлеющей лучинкой.
б) К подкисленному серной кислотой раствору КI добавьте небольшой объем раствора Н2О2. Какова функция Н2О2 в опытах (а) и (б)?
III. Реакции диспропорционирования.
Опыт 8. Налейте в пробирку 1 мл перекиси водорода, опустите в горячую воду. Объясните происходящее явление. Напишите уравнение реакции. Определите окислитель и восстановитель.
Опыт 9. Несколько кристаллов дихромата аммония поместите в сухую пробирку и нагрейте до начала реакции разложения. Обратите внимание на характер образующихся продуктов реакции и закончите уравнение реакции:
(NH4)2Cr2O7 = Cr2O3 + ...
Опыт 10. Осторожно нагрейте в сухой пробирке небольшое количество перманганата калия до разложения и закончите уравнение реакции:
KMnO4 = K2MnO4 + MnO2 + ...
Полученную соль растворите в воде. Напишите уравнение реакции.
117
ТЕМА 10. СТРОЕНИЕ АТОМОВ. ХИМИЧЕСКАЯ СВЯЗЬ
Вопросы к занятию
1.Основные положения квантовой механики (двойственная корпускулярно-волновая природа микрочастиц, соотношение неопределенностей Гейзенберга, уравнение Шредингера).
2.Квантовые числа электронов в атомах.
3.Заполнение электронных слоев и оболочек в атомах.
4.Энергетические характеристики атомов -- энергия ионизации, сродство к электрону, электроотрицательность.
5.Структура периодической системы элементов.
6.Характеристики химической связи: длина, энергия, кратность, полярность.
7.Гибридизация атомных орбиталей.
8.Основные типы химической связи (ковалентная, ионная, металлическая), их свойства.
9.Методы, описывающие химическую связь: МВС и ММО, основные положения этих методов.
§1. Сложность структуры атома. Ядерная модель Э. Резерфорда
В основе атомно-молекулярной теории строения вещества лежит представление о возможности разделения физического тела на малые части, каждая из которых сохраняет химические свойства тела. Эти части были названы молекулами.
Предполагалось, что молекулы сложного состава можно разделить на части, называемые атомами. Атомы в химических реакциях не изменяются. Если допустить существование движущихся атомов и молекул, то можно объяснить многие наблюдаемые на опыте свойства физических тел. При этом считалось, что опытные факты можно истолковать, считая атомы и молекулы точечными телами. Однако в конце XIX – начале XX в. были открыты явления, заставляющие сделать предположение о сложности строения атомов и молекул.
Изучение прохождения электрического тока через газы и растворы позволило обнаружить одну из составных частей атома и молекулы – электрон.
При изучении прохождения электрического тока через растворы электролита были открыты законы электролиза и введено представление о существовании положительного и отрицательного заряженных атомов или групп атомов – катионов и анионов.
Эти факты привели к мысли о том, что атом можно представить как сложное образование, состоящее из электронов и области, несущей
118
положительный заряд. Возник вопрос об относительном расположении электронов и положительно заряженной остальной части атома.
В. Томсон и Д. Д. Томсон предложили модель строения атома. Атом представляет положительно заряженный шар, в котором вкраплены отрицательно заряженные электроны.
Втом же году японский физик Х. Нагаока предложил иную модель строения атома: атом имеет строение, напоминающее строение планеты Сатурн с её кольцами спутников. Основная часть атома - положительно заряженный шар, вокруг которого по кольцевым орбитам вращаются электроны.
Позднее в лаборатории Э. Резерфорда было изучено прохождение через фольгу дважды ионизированных атомов гелия – α-частиц. Оказалось, что область положительного заряда атома очень невелика по размерам, что противоречило модели В. Томсона и Д. Д. Томсона. Э. Резерфорд использовал планетарную модель Х. Нагаоки. Однако он предложил в отличие от Нагаоки, что масса атома почти целиком сосредоточена в области положительного заряда. Эта область была названа ядром атома. Ядерная модель атома предложена Э. Резерфордом в 1911 г. Но она не могла объяснить факта устойчивости атома: ведь согласно законам электродинамики электроны должны были бы излучать электромагнитные волны, теряя кинетическую энергию и уменьшая свою скорость, пока не упадут на ядро.
Вдальнейшем изучение строения атома развивалось по двум направлениям – исследование атомного ядра и электронной оболочки атома. Первая количественная теория простейшего атома водорода была разработана Н. Бором в 1913г.
Н. Бор предложил модель атома водорода, исходя из гипотезы Резерфорда, дополненной новыми положениями:
1.Электрон может вращаться по определённым круговым орбитам, не излучая энергии.
2.Ближайшая к ядру орбита отвечает нормальному, наиболее устойчивому состоянию атома.
3.Поглощение и излучение атомом энергии происходят лишь при перескоке электрона с одной орбиты на другую.
§2. Начала волновой механики.
Открытия физики конца XIX - начала XX в. привели к выводу о том, что свет, который раньше рассматривался как пример волнового процесса, можно рассматривать как совокупность частиц (фотонов), обладающих механическими характеристиками движения – массой, энергией и импульсом. В 1900 г. М. Планком было предположено, что процесс излучения атомами световой энергии происходит не непрерывно, а
119

порциями, квантами, величина которых зависит от частоты испускаемого света:
E h , где c
В 1905 г. А. Эйнштейн показал, что масса тела связана с его энергией
соотношением E mc2 . Уравнения Планка и Эйнштейна дают возможность получить соотношение между массой фотона и длиной волны света, или частотой световых колебаний:
E= hν = mc2
В1924 г. Луи де Бройль предположил, корпускулярно волновая природа присуща не только свету, но и любым другим микрочастицам. При этом длина волны, соответствующая данной частице:
h m V
В1927 г. Девиссон и Джермер обнаружили, что при дифракции электронов на никеле возникает дифракционная картина, сходная с дифракцией света на кристаллической решетке. Это явление получило название дифракции электронов. Оно считается экспериментальным доказательством существования волн де Бройля или корпускулярноволнового дуализма электронов.
Вволновых свойствах электрона заложен один из принципов волновой механики.
Вторым является принцип неопределённости Гейзенберга (1925г.).
Вмеханике наблюдение волнового процесса – периодического колебания сплошной среды – позволяет определить длину волны и скорость её распространения. Чем больше область пространства, в котором распространяется волна, тем точнее можно определить эти характеристики. Иначе обстоит дело при переходе к объектам микромира. Гейзенберг показал, что точное определение положения электрона на орбите и его скорость не могут быть зафиксированы. Произведение неопределённостей положения (Δx) и скорости (Δp) никогда не может быть меньше, чем h/me:
p x h me
или
p x h
2
120
