
полезная метода
.pdfчто при соединении органических веществ с хлором образуются тригалометаны. Эти производные метана обладают выраженным канцерогенным эффектом, что способствуют образованию раковых клеток.
При кипячении хлорированной воды в ней образуется сильнейший яд – диоксин. Уменьшить содержание тригалометанов в воде можно, снизив количество используемого хлора или заменив его другими дезинфицирующими веществами, например, применяя гранулированный активированный уголь для удаления образующихся при очистке воды органических соединений. И, конечно, нужен более детальный контроль за качеством питьевой воды.
Однако, в питьевой воде должны быть микроэлементы, такие как фтор и йод, кальций, магний, железо, медь, цинк. Минерализация воды (количество растворенных в воде солей) является неоднозначным параметром. Исследования, проведенные в последние годы, показали неблагоприятное воздействие на организм человека питьевой воды с минерализацией свыше 1500 мг/л и ниже 30-50 мг/л. Такая питьевая вода плохо утоляет жажду, ухудшает работу желудка, нарушает водно-солевой обмен в организме. До недавнего времени на высокую минерализацию воды – жесткость – обращали внимание лишь из-за ее влияния на пригодность воды для мытья волос и стирки, а также на интенсивность образования накипи при кипячении воды. Теперь благодаря полученным научным данным стало ясно, что очистка воды необходима, т. к. жесткость питьевой воды имеет большое значение для поддержания здоровья. Например, повышенное содержание солей кальция и магния в воде способствует развитию атеросклероза, мочекаменной болезни, вызывает нарушение обменных процессов. С другой стороны, смертность от сердечно-сосудистых заболеваний на 25-30% выше среди людей, употребляющих для питья мягкую воду, содержащую менее 75 миллиграммов кальция и магия в литре воды.
Дистиллированная вода (в ГФ - Aqua purificata или Aqua distillatа, рН
= 5,0 – 6,8) – это вода, практически полностью очищенная от растворенных в ней минеральных солей, органических и других примесей. Поскольку дистиллированная вода практически лишена минеральных солей и микроэлементов, она служит отличным растворителем, но именно это делает ее непригодной для питья. Основными способами получения
дистиллированной |
воды |
является |
мембранная |
очистка |
или |
||
выпаривание. Оборудование, |
при |
помощи |
которого |
получают |
|||
дистиллированную воду, называют дистиллятор (аквадистиллятор). Качество дистиллята регламентируется ГОСТ 6709-72 «Вода дистиллированная». Самый важный показатель качества дистиллированной воды - электропроводность дистиллированной воды = 5•10-4См\м.
211
Апирогенная вода и вода для инъекций (Aqua pro injectionibus). Апирогенностью называется отсутствие в инъекционных растворах продуктов метаболизма микроорганизмов - так называемых пирогенных веществ, или пирогенов. Свое название пирогены (от лат. руг - жар, огонь) получили за способность вызывать повышение температуры при попадании в организм. Пирогенные вещества хорошо растворимы и легко проходят сквозь фильтры, величина пор которых превышает 50 нм. Величина же самих пирогенов составляет 1-50 нм. Они дают положительную реакцию на углерод с реактивом Молиша. Для их полного разрушения необходимо автоклавирование при 120 °С в течение нескольких часов.
В соответствии с требованиями Государственной Фармакопеи инъекционные растворы не должны содержать пирогенных веществ. Для обеспечения этого требования инъекционные растворы готовят на апирогенной воде для инъекций (или маслах) с использованием медикаментов и других вспомогательных веществ, не содержащих пирогенов. Основным способом получения апирогенной воды для медицины, фармацевтической и других отраслей промышленности является двухступенчатым методом обратного осмоса и может быть использовано, где требуется вода без микроорганизмов. С целью повышения качества получаемой воды после ее предварительной очистки проводят разделение на мембранах под действием разности давлением с последующей обработкой активированным углем. Дезинфекцию с помощью ионов серебра.
§3. Жесткость воды.
Виды жесткости и единицы ее измерения.
Воду с растворенными в ней солями называют жесткой, а совокупность свойств такой воды – жесткостью. В жесткой воде плохо развариваются продукты питания, так как катионы кальция с белками пищи образуют нерастворимые соединения. Постоянное употребление жесткой воды может привести к отложению солей (мочекаменная болезнь) в организме человека. В ней труднее развариваются многие продукты, их питательная ценность уменьшается. Жёсткая вода непригодна для многих технических целей. Из-за образования накипи непригодна для использования в паровых котлах, вредна для металлических конструкций, трубопроводов. В жесткой воде плохо мылится мыло и возрастает его расход. Жёсткой водой нельзя пользоваться при проведении некоторых технологических процессов, например при крашении.
Согласно ГОСТ 6055 – 86 различают:
212

карбонатную жесткость – это совокупность свойств воды, обусловленных присутствием в ней гидрокарбонатов кальция, магния и железа. Часто этот вид жесткости называют временной или устранимой;
некарбонатную жесткость – совокупность свойств воды, обусловленных присутствием в ней сульфатов, хлоридов, силикатов, нитратов и фосфатов кальция, магния и железа. Этот вид жесткости также называют постоянной или неустранимой;
общую жесткость, складывающуюся из карбонатной и
некарбонатной жесткости. Она равна сумме концентраций ионов Са2+, Mg2+, Fе2+.
Количественно жесткость воды выражают единицами жесткости. За единицу жесткости принимают один миллимоль (ммоль) эквивалент ионов Са2+ или Mg2+ в одном литре. Числовое значение жесткости, выраженное в ммоль/л, совпадает со значением в моль/м3. Одна единица жесткости
соответствует массовой концентрации ионов Са2+, равной 20, 4 мг/л или ионов Mg2+, равной 12, 15 мг/л.
Зная молярные массы эквивалентов ионов Са2+ и Mg2+ (соответственно равны 20,04 и 12,16 мг/дм3), можно рассчитать общую жесткость воды (в ммоль/дм3):
Ж |
|
[Ca2 ] |
[Mg2 |
] |
|||
общ |
|
|
|
|
|
|
|
|
|
|
|||||
|
20.04 |
|
12.16 |
|
|||
Часто в расчетах жесткости используют формулу:
Ж |
mсоли |
1000 |
|
|
|
M(1 |
соли) V |
|
|
||
|
z |
|
|
|
|
По величине жесткости различают воду: |
|||||
очень мягкую |
< 1, 5 |
единиц (ммоль экв/л); |
|||
мягкую |
|
1, 5 – |
3 единиц; |
||
среднюю |
3, 6 – 6, 0 единиц |
||||
жесткую |
|
6, 0 |
– 9, 0 единиц |
||
очень жесткую |
> 9, |
0 единиц. |
|||
Методы устранения и снижения жесткости воды.
Устранение или снижение жесткости воды называют умягчением. Его осуществляют различными методами.
Термическая обработка воды.
Сущность этого метода заключается в предварительном нагревании воды до 70 – 80о С или ее кипячении. Метод позволяет устранить только временную (карбонатную) жесткость, обусловленную наличием в воде хорошо растворимых гидрокарбонатов кальция, магния и железа. При этом катионы Са2+, Mg2+, Fe2+ осаждаются в виде нерастворимых соединений.
Распад гидрокарбонатов магния и железа, в отличии от гидрокарбоната кальция, протекает сложнее: он одновременно сопровождается процессами гидролитического разложения их карбонатов.
213
Это объясняется тем, что карбонаты магния и железа, в отличие от карбоната кальция, более растворимы, чем их гидроксиды.
Если временная жесткость предварительно не была устранена, то вышеприведенные процессы протекают при нагревании воды в паровых котлах, системах водяного отопления и охлаждения, бытовой металлической посуде с образованием в них слоя накипи из нерастворимых соединений. Это снижает коэффициенты теплопередачи и ухудшает их теплотехнические характеристики. При этом происходит перерасход топлива и перегрев металлических поверхностей. Чем больше железа содержится в воде, тем более бурым является цвет накипи.
При термической обработке воды удается также снизить и содержание в ней растворимых газов, т. к. их растворимость с увеличением температуры падает.
Химическая обработка воды (реагентный метод)
Этот метод позволяет устранить как временную жесткость, так и постоянную. Сущность его заключается в обработке воды специальными реагентами, образующими ионами, вызывающими жесткость, малорастворимые соединения. К числу таких реагентов относятся: сода Na2CO3, негашеная CaO и гашеная Ca(OH)2 извести, различные фосфаты натрия (Na3PO4, Na6P6O18) и др. При обработке воды известью (гашеной или негашеной) происходит устранение ее временной жесткости и одновременное снижение ее щелочности. Процесс называется известкованием или декарбонизацией.
Обработка известью позволяет связать и растворенный в воде углекислый газ. Использование фосфатов натрия предпочтительнее, так как образующие фосфаты кальция, магния и железа менее растворимы, чем соответствующие их карбонаты и гидроксиды. Для одновременного устранения карбонатной и некарбонатной жесткости широкое распространение в промышленности получил известково – содовый метод: обработка воды смесью СаО и Nа2СО3. Вода, умягченная этим способом, имеет остаточную жесткость равную 0, 5 – 0, 1 ммоль-экв/л. Он становится еще более эффективным, если его проводить при нагревании, сочетая достоинства химического и термического методов.
Ионообменный метод – современный физико – химический метод, широко используемый в промышленности, особенно в гидрометаллургии. Использование его для умягчения и деминерализации воды позволяет не только уменьшить ее жесткость, но достичь ее глубокой очистки. Вода, подвергшаяся такой обработке, практически не содержит посторонних ионов: ни катионов, ни анионов. Метод основан на способности некоторых веществ, не растворимых в воде, стехиометрически обменивать свои ионы на ионы внешней среды (воды, растворов электролитов). Вещества, обладающие такими свойствами, называют ионообменниками (ионообменными сорбентами) или сокращенно ионитами. Большинство
214
ионитов – твердые, ограниченно набухающие вещества, аморфной или кристаллической структуры. Они состоят из каркаса (матрицы) и закрепленных на нем иогенных (активных функциональных) или комплексообразующих групп. Эти группы диссоциируют, давая полионы (фиксированные ионы, ковалентно связанные с каркасом) и эквивалентное число подвижных противоионов, способных к обмену и компенсирующих своими зарядами заряды полионов.
Ионный обмен - это обратимая химическая реакция, при которой происходит обмен ионами между твердым веществом (ионитом) и раствором электролита.
В водоподготовке ионный обмен применяют для умягчения воды, обессоливания, селективного удаления из воды различных ионов и т.д. Умягчение воды представляет собой процесс обработки связанный со снижением концентрации находящихся в воде ионов кальция (Ca2+) и магния (Mg2+), обуславливающих жесткость воды. Подлежащая очистке вода проходит через один или систему фильтров, заполненных ионитами, подбираемыми в зависимости от требуемой задачи. Иониты удаляют из воды соответствующие ионы и обмениваются с водой эквивалентными количествами других ионов, которые первоначально находились в ионите. Обменивающиеся ионы называются противоионами. Иониты состоят из неподвижного каркаса - матрицы и функциональных групп - фиксированных ионов, которые жестко прикреплены к матрице и взаимодействуют с противоионами.
Большинство ионитов – твердые, ограниченно набухающие вещества, аморфной или кристаллической структуры. Они состоят из каркаса (матрицы) и закрепленных на нем ионогенных (активных функциональных) или комплексообразующих групп. Эти группы диссоциируют, давая полионы (фиксированные ионы, ковалентно связанные с каркасом) и эквивалентное число подвижных противоионов, способных к обмену и компенсирующих своими зарядами заряды полионов. В зависимости от знака заряда противоионов иониты делят на катиониты и аниониты. Если противоионы заряжены положительно, т.е. являются катионами (например, ионы водорода Н+ или ионы металлов), ионит называют катионитом. Если противоионы заряжены отрицательно, т.е. являются анионами (например, ион гидроксила ОН– или кислотные остатки), ионит называют анионитом. Т. е. по знаку заряду обменивающихся ионов, иониты делятся на катиониты, аниониты и амфолиты, по химической природе каркаса – на неорганические, органические и минерально – органические.
215

§3. Лабораторная работа «Жесткость воды»
Опыт 1. Определение временной жесткости воды.
Пипеткой на 100 мл отберем в две чистые плоскодонные конические колбы (на 250 мл) по 100 мл водопроводной воды. В каждую из колб добавим по 3 капли раствора индикатора – метилового оранжевого (щелочной раствор имеет желтую окраску, а кислый – красную). В бюретку на 50 мл нальем до приблизительного 0 значения 0, 1н раствор соляной кислоты и запишем точное значение начального положения уровня кислоты (по нижнему уровню мениска). Поставим обе колбы на лист белой бумаги. Одну из них оставим в сторону, она будет служит контрольным образцом для сравнения цвета растворов. Во вторую по каплям, при непрерывном вращательном перемешивании прильем из бюретки 0, 1 н раствора соляной кислоты до перехода окраски раствора от желтой до оранжево – красной и сравним с цветом раствора, находящимся
впервой колбе.
Вмомент изменения окраски запишем значение положения уровня раствора кислоты (по нижнему краю мениска) в бюретке и вычислим израсходованный на титрование объем соляной кислоты. Процесс титрования повторим еще 2 раза с новыми порциями воды. Результаты титрования не должны отличаться. Если такое произойдет, то эксперимент придется повторить. При добавлении метилового оранжевого индикатора в воду она становится желтой, а при добавлении потом туда соляной кислоты цвет меняется на красный.
Уравнение реакции.
CaCO3 + 2HCl = CaCl2 + CO2 ↑ + H2O Ca(HCO3)2 + 2HCl = CaCl2 + 2H2O + 2CO2 ↑
Проведение расчетов.
Рассчитаем среднее значение объема кислоты, пошедшей на титрование, и по нему вычислим временную жесткость воды.
V V V
VcpHCl 1 2 3
3
NBP NHCl VcpHCl 1000,ммоль экв/ л
VH2O
Вывод. По полученным данным о жесткости воды, можно утверждать, что вода очень мягкая, так как значение жесткости меньше 1, 5 единиц по ГОСТ.
Опыт 2. Определение общей жесткости воды. Ход эксперимента.
В бюретке (на 50 мл) заполним 0, 05н трилона Б до примерно нулевого деления и запишем точное положение уровня по нижнему краю
216

мениска. Пипеткой (на 100 мл) отберем в две чистые плоскодонные конические колбы (на 250 мл) по 100 мл водопроводной воды, добавим в них 5 мл буферного раствора и сухой соли эриохрома черного, и перемешаем.
Поставим обе колбы на лист белой бумаги, затем одну из колб будем использовать в качестве контрольного образца для сравнения цвета растворов. Во вторую, по каплям, при непрерывном вращательном перемешивании прильем из бюретки 0, 05 раствора трилона Б до перехода окраски от одной капли из винно – красной в фиолетовую. Подождем 1 – 2 минуты, перемешивая раствор. Если окраска не стала сине – голубой с зеленоватым оттенком, доведем ее до этого цвета, добавив еще несколько капель раствора трилона Б из бюретки. Сравним цвет рабочего раствора с окраской контрольного раствора в первой колбе. В момент изменения окраски запишем положение уровня раствора трилона Б в бюретки по нижнему мениску и вычислим израсходованный на титрование объем трилона Б.
Процесс титрования повторим еще 2 раза с новыми порциями воды. Результаты титрования не должны отличаться друг от друга. Если все же отличаются, опыт придется повторить. При добавлении эриохрома черного в раствор, цвет раствора становится розоватым. А при добавлении туда избытка раствора трилона Б цвет меняется на сине – голубой.
Рассчитаем среднее из близких результатов значение объема трилона Б, пошедшего на титрование, и по нему вычислим общую жесткость воды.
VcpТрилонБ V1 V2 V3
3
NBP NТрилонБ VcpТрилонБ 1000,ммоль экв / л
VH2O
Вывод. По полученному значению жесткости можно сделать вывод, что вода очень мягкая, так как значение жесткости меньше 1, 5 единиц по ГОСТ.
Опыт 3. Устранение некарбонатной жесткости. Ход эксперимента.
В чистую пробирку с помощью пипетки (на 5 мл) отмерим 5 мл раствора MgSO4. Добавим к нему 1 каплю 0, 2 н раствора Na2CO3 . При образовании осадка, перемешаем до его растворения. Добавляют раствор Na2CO3 до тех пор, пока осадок перестанет растворяться.
То же самое проделаем с растворами CaCl2 и CaSO4.
Результаты наблюдений и уравнения реакций запишите в таблицу 2.
217

Таблица 2. Результаты наблюдений и уравнения реакций
Состав |
Вид |
Уравнение реакции |
Число |
Хар- |
Вывод о раст – |
|
исходн |
осадител |
|
|
капель |
ка |
ти осадка |
ого |
я |
|
|
Na2CO3 |
осадка |
|
MgSO4 |
Na2CO3 |
MgSO4 + Na2CO3 = Na2SO4 + |
2 |
Белый |
Практически |
|
|
|
MgCO3↓ |
|
|
|
нерастворимый |
|
|
|
|
|
|
|
CaCl2 |
Na2CO3 |
Na2CO3 |
+ CaCl2 = CaCO3 ↓ + |
4 |
Белый |
Малораствор- |
|
|
+2NaCl |
|
|
|
имый |
CaSO4 |
Na2CO3 |
Na2CO3 |
+ CaSO4 = Na2SO4 + |
7 |
Белый |
Мало |
|
|
+CaCO3 ↓ |
|
|
растворимый |
|
Вывод. Так как осадок при взаимодействии MgSO4 практически нерастворим, то его концентрация выше, чем у осадков CaCl2 и CaSO4, а следовательно этот реагент эффективней устраняет жесткость воды, чем CaSO4 и CaCl2, и следовательно, хуже всех устраняет жесткость CaSO4.
§4. Примеры решения задач
Пример 1. Вычислите временную жесткость воды, зная, что в 500 л ее содержится 202,5 г Ca(HCO3)2.
Решение Временная жесткость воды обусловлена наличием соли гидрокарбоната
кальция |
|
и |
вычисляется: |
Молярная |
масса |
эквивалента |
Ca(HCO3)2 равна: |
|
|
, |
следовательно, жесткость |
воды:
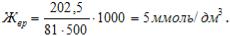 .
.
Пример 2. Сколько граммов CaSO4 содержится в 1 м3 воды, если жесткость, обусловленная присутствием этой соли, равна 4 ммоль/дм3? Решение
Молярная масса СаSO4 равна 136 г/моль; молярная масса эквивалента равна:
 . Затем находим, сколько граммов сульфата кальция содержится в 1 м3 (1м3 = 1000 дм3) воды:
. Затем находим, сколько граммов сульфата кальция содержится в 1 м3 (1м3 = 1000 дм3) воды:
Пример 3. Какую массу соды надо добавить к 500 л воды, чтобы устранить ее жесткость, равную 5 ммоль/дм3?
Решение
218

Находим количество моль эквивалентов солей, обусловливающих
жесткость |
воды |
из |
формулы: |
|
. |
Один из методов |
устранения |
жесткости воды – введение соды (Na2CO3). Согласно закону
эквивалентов |
, отсюда находим массу соды для |
устранения |
жесткости |
воды: |
, |
Пример 4. Вычислите |
карбонатную жесткость воды, зная, что на |
титрование 100 см3 этой воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см3 0,08 н. раствора HCl.
Решение Карбонатную (временную) жесткость рассчитывают умножением объема
кислоты (V, мл), пошедшего на титрование на концентрацию кислоты:
§5. Задачи для самостоятельного решения
1.Какую массу Na3РО4 надо прибавить к 500 л воды, чтобы устранить ее карбонатную жесткость, равную 5 ммоль/дм3?
2.Какие соли обусловливают жесткость природной воды? Какую жесткость называют карбонатной, некарбонатной? Как можно устранить карбонатную, некарбонатную жесткость? Напишите уравнения соответствующих реакций. Чему равна жесткость воды, в 100 л которой содержится 14,632 г гидрокарбоната магния?
3.Вычислите карбонатную жесткость воды, зная, что для реакции с
гидрокарбонатом кальция, содержащимся в 200 см3 воды, требуется 15 см3 0,08 н. раствора HCl.
4.В 1л воды содержится ионов магния 36,47 мг и ионов кальция 50,1 мг. Чему равна жесткость этой воды?
5.Какую массу карбоната натрия надо прибавить к 400 л воды, чтобы устранить жесткость, равную 3 ммоль/дм3?
6.Вода, содержащая только сульфат магния, имеет жесткость 7 ммоль/дм3. Какая масса сульфата магния содержится в 300 л этой воды?
7.Вычислите жесткость воды, зная, что в 600 л ее содержится 65,7 г гидрокарбоната магния и 61,2 г сульфата кальция.
8.В 220 л воды содержится 11 г сульфата магния. Чему равна жесткость этой воды?
219
9.Жесткость воды, в которой растворен только гидрокарбонат кальция, равна 4 ммоль/дм3. Какой объем 0,1 н. раствора HCl потребуется для реакции с гидрокарбонатом кальция, содержащимся в 75 см3 этой воды?
10.В 1м3 воды содержится 140 г сульфата магния. Вычислите жесткость этой воды.
220
