
- •Направление «Автоматика и электронное приборостроение»
- •Использование фпм в качестве критерия оценки качества изображения оэс
- •Применение геоинформационной системы для обеспечения виртуального туризма во время полета в рамках системы развлечений
- •Система измерения параметров нефти
- •Система тестирования помехоустойчивости приемников глобальной навигации gps/глонасс
- •Ультразвуковая система зондирования на фазированных решетках
- •Измерение эффективной площади рассеяния отражателя на основе линзы люнерберга путем измерения коэффициента усиления
- •Продвижения центра композитных технологий книту-каи: «мы создаем будущее сейчас»
- •Системы контроля бодрствования водителей
- •Прибор для определения тяжелых металлов в биологической жидкости
- •Применение резонаторов для отображения графической информации
- •Устройство и эксплуатация безрулонных монолитных кровель
- •Внедрение инновационных ресурсосберегающих технологий в инвестиционно-строительном комплексе на основе экологического девелопмента
- •Основные проблемы и рекомендованные пути их решения
- •Влияние активации воды затворения и ультразвуковой диспергации цементного теста на свойства цементных композиций
- •Разработка концепции адаптации пригородных поселков для комфортной жизни и развития детей
- •Совершенствование конструктивных свойств фасадных систем
- •Цели исследований
- •Задачи исследований
- •Бетоны на высокопрочном композиционном гипсовом вяжущем
- •Направление «Биология»
- •Изучение генетической структуры популяции татар
- •Изменение физиолого-биохимических характеристик Staphylococcus aureus при действии стрессоров различной природы
- •Диагностика экологического состояния высших водных растений по активности маркерных ферментов
- •Влияние гомоцистеина на активность кальций – активируемых калиевых каналов (вк-каналов) в gh3 клетках гипофиза крысы.
- •Влияние 4-холестен-3-она на экзоцитоз везикул рециклирующего и резервного пулов
- •Участие глутатиона в снятии токсического действия 2,4,6-тринитротолуола
- •Антимикробные свойства штамма pantoea vagans 3.2
- •1. Введение
- •2. Антибактериальные свойства штамма p. Vagans 3.2
- •3. Минимальная ингибирующая концентрация штамма p. Vagans 3.2
- •4. Фунгицидная активности штамма p. Vagans 3.2
- •Исследование влияния агонистов каннабиноидных рецепторов на секрецию медиатора в нервно-мышечном синапсе мыши
- •Долговременная потенциация и депрессия в соматосенсорной коре новорожденных крысят
- •Протеиназа htra из bacillus subtilis 168, как потенциальный ранозаживляющий агент
- •Направление «Ветеринария»
- •Влияние эми квч на неспецифическую резистентность крыс
- •Активность системы оксида азота у разных видов животных
- •Определение беременности у кошек на разных сроках с применением узи сканнера
- •Гельминтофауна птиц
- •Бактерии рода helicobacter у белых мышей и крыс
- •Загрязненность почвы тяжелыми металлами в закамской техногенной
- •Электромагнитное излучение крайне высоких частот – фактор, повышающий активность доноров оксида азота
- •Морфология симпатического ствола кошки
- •Особенности скелета и артериального русла головы у кролика
- •Эффективный способ лечения кошек и собак при конъюнктиво-кератите
- •Динамика массы тела и гематологических показателей белых крыс при исполоьзовании средств растительного происхождения
- •Направление «Высшая математика и кибернетика»
- •Об одном методе отсечений на основе аппроксимации надграфика с отбрасыванием секущих плоскостей и его численном исследовании
- •Прикладное назначение математики в логистической деятельности
- •Оптимизация гидродинамических расчетов нефтяных месторождений с использованием локального числа куранта
- •Направление «География и геология»
- •Зависимость химического состава тектитов метеоритного кратера жаманшин от их внешнего вида
- •Особенности формирования нефтей северо-татарского свода на основе комплекса геохимических исследований.
- •Геологическое строение черкашинской свиты ваделыпского нефтяного месторождения
- •Воссоздание фациальной обстановки образования и фильтрационно-емкостных свойств ачимовской толщи по каротажным диаграммам и по микроскопическому исследованию шлифов
- •Седиментогенез карбанатных отложений турнейского яруса и их петрофизические свойства (на примере скв. 1267 демкинского месторождения)
- •Влияние геологических особенностей эксплуатационных объектов покровского месторождения на успешность проведения геолого-технических мероприятий
- •Эффективность проведения геолого-технологических мероприятий на Покровском месторождении за 2003-2007 годы
- •Типоморфизм кварца гидротермальных жил арго-юряхского штока (магаданская область)
- •О гидрогеологических условиях одного из районов республики татарстан по данным численного моделирования
- •Моделирование фильтров нейтронов для аппаратуры импульсного нейтронного каротажа
- •Особенности минерального состава золоторудного проявления участка баяниха топольнинского гранодиоритового массива (горный алтай)
- •О формировании состава подземных вод по данным изучения водных вытяжек
- •Направление «Журналистика»
- •Функциональная специфика карикатуры на страницах печати
- •«Студенческий казанский вожатый отряд» как новое молодежное течение в татарстане
- •Радио « азатлык»: история и специфика вещания
- •Online издание как тип сми (на примере «газета.Ru» и «huffington post»)
- •Взаимоотношения сми и государства в россии
- •Направление «Иностранные языки»
- •Переводческий анализ китайского публицистического стиля в разрезе проблемы лакунарности
- •Заголовок англоязычного текста короткого рассказа в аспекте его структурной модели
- •Функционирование цветовых прилагательных в романе Colleen McCullough «The Thorn Birds»
- •Английский – международный язык общения
- •(Изучение лондона — моя страсть…)
- •Направление «Информатика и информационные технологии»
- •Помехоустойчивость электронных средств при воздействии импульсных кондуктивных электромагнитных помех по цепям заземления Введение
- •1.Показатели помехоустойчивости свт при воздействии кондуктивных помех по линиям связи
- •2.Результаты исследования помехоустойчивости свт при воздействии кондуктивных помех по линиям связи
- •Выводы по работе
- •Автоматизированное проектирование диаграммы классов uml на основе семантических моделей
- •Разработка базы данных учета инвентаря предприятия
- •Создание эмулятора вычислителя квантовых схем с использованием графического и центрального процессоров
- •Помехоустойчивость средств вычислительной техники при воздействии кондуктивных помех по линиям связи Введение
- •1.Показатели помехоустойчивости свт при воздействии кондуктивных помех по линиям связи
- •2.Результаты исследования помехоустойчивости свт при воздействии кондуктивных помех по линиям связи
- •Выводы по работе
- •Разработка электронно-цифровой подписи для 1с: бухгалтерия предприятия
- •Помехоустойчивость электронных средств при воздействии наносекундных электромагнитных импульсов по сети питания Введение
- •1.Показатели помехоустойчивости эс при воздействии наносекундных электромагнитных импульсов по сети питания
- •2.Результаты исследования помехоустойчивости свт при воздействии кондуктивных помех по линиям связи
- •Выводы по работе
- •Автоматизированная система дистанционных измерений и сбора измерительно-диагностической информации газоперекачивающей установки
- •Разработка модуля заработной платы на платформе 1с: бухгалтерия предприятия
- •Трехмерная реконструкция объекта по последовательности фотографий
- •Проектирование локально-вычислительной сети производственной компании
- •Навигация мобильного объекта с использованием камеры видеонаблюдения
- •Оптимизация гидродинамических расчетов нефтяных месторождений с использованием локального числа куранта
- •Направление «История»
- •Создание учебника по отечественной истории: преемственность традиций от 1930-х до 2010-х годов
- •Становление психиатрической службы «призрения душевнобольных» в Казанской Губернии (середина–конец XIX в.)
- •Моделирование длинных волн динамики хлебных цен россии XVIII – первой половины XIX в.
- •Женское лицо великой отечественной
- •Документы в социальных сетях как исторический источник.
- •Хозяйство и землевладение ярославского спасского монастыря по актовым источникам
- •Топонимика как отражение и сохранение культурно-исторической памяти города
- •Направление «Культура и искусство»
- •Мастер и ученик (творчество николая николаевича хохрякова)
- •Приобщение детей к культуре татарского народа на уроках технологии (на примере темы «вязание на спицах»)
- •Чистопольские страницы драматургии л.М. Леонова
- •Направление «Медицина»
- •Изменение физиолого-биохимических характеристик Staphylococcus aureus при действии стрессоров различной природы
- •Оценка нервно-психических расстройств при хронической ишемии головного мозга с недементными когнитивными расстройствами
- •Использование натрий карбоксиметилцеллюлозы для формирования матрикса при тестировании чувствительности опухолевых клеток к химиопрепаратам
- •Сердечная недостаточность и анемия: клинические параллели
- •Роль звёздчатых клеток поджелудочной железы в регенерации органа на фоне медь-дефицитной диеты у крыс
- •Морфометрический анализ изменений в мышечной ткани пациентов с хроническими облитерирующими заболеваниями артерий нижних конечностей после клеточной терапии
- •Ассоциация полиморфизма -308 a/g гена tnf-а с риском развития преэклампсии
- •Метод исследования вариабельности ритма сердца для персонифицированного подхода к лечению больных с ишемическим инсультом
- •Дифференцировка региональных стволовых клеток печени после трансплантации звёздчатых клеток печени крысам, перенесшим частичную гепатэктомию с одновременным введением 2-ацетиламинофлуорена
- •Показатели вегетативного гомеостаза и эмоционально-личностный профиль у пациентов с мигренью
- •Направление «Менеджмент»
- •Реклама как фактор повышения конкурентоспособности предприятия (на примере оао «башспирт»)
- •Особенности проведения маркетинговых исследований в ресторанном бизнесе
- •Процесс принятия решений в управленческой деятельности ооо «транстехсервис-нк»
- •Исследование имиджа чоу впо нчф «институт экономики, управления и права (г. Казань)» на локальном рынке
- •Инвестирование малых денежных средств
- •Управление налоговыми рисками
- •Особенности управления форматами магазинов при автозаправочных станциях (на примере азс «лукойл №16088»)
- •Специфика распространения наружной рекламы в г. Лениногорске
- •Проблемы управления малым бизнесом в России
- •Комплексный анализ торговой марки «chelny food»
- •Развитие персонала как фактор обеспечения качества производства
- •Применение принципов бережливого производства в образовательном процессе
- •Анализ конкурентоспособности торговой марки «chelny food»
- •Управление ассортиментом и разработка мероприятий по стимулированию продаж ооо «метро кэш энд керри»
- •Направление «Педагогика»
- •Занимательные задачи в обучении математике в 5-6 классах на примере темы «натуральные числа»
- •Глава 2. Натуральные числа [1, с. 23- 48].
- •Глава 3. Действие с натуральными числами [1, с. 49-80].
- •Глава 1. Натуральные числа и нуль [2, с. 3-63].
- •Глава 1. Натуральные числа [3, с. 5-127].
- •Организация художественно-проектной деятельности подростков в учреждениях дополнительного образования
- •Психолого-педагогическое сопровождение процесса адаптации младших школьников к обучению в условиях перехода в среднее школьное звено
- •Формирование инновационного мышления у учащихся старших классов
- •Эффективность комплексной коррекционно-оздоровительной программы физического воспитания учащихся младшего школьного возраста с нарушением слуха
- •Направление «Политология и международные отношения»
- •Применение теории игр в исследовании международных конфликтов
- •Геополитическая стратегия россии в отношении стран арабского востока
- •Французское направление испанской внешней политики
- •Смешанные выборы как свидетельство безыдейности российской оппозиции
- •Применение административного ресурса в процессе предвыборной агитации на примере российской федерации
- •Роль эфиопо-кенийского альянса в отношениях с сомали в период 1963-1991гг
- •Миротворческая миссия оон в дарфуре: предпосылки, ход, пути решения конфликта.
- •Принципы партийного строительства сша и Великобритании
- •«Франко-немецкие отношения первой половины 90-ых годов XX века»
- •Кризис мультикультуралиизма как кризис либеральных ценностей
- •Влияние тенденции расширения евросоюза на восток на отношения с россией в 2000-2008гг.
- •Направление «Психология»
- •Развитие речи детей раннего возраста в игровой деятельности
- •Влияние стиля лидерства преподавателя на студентов в учебном процессе
- •«Психологические типы личности и копинг-стратегии у младших школьников».
- •Роль игры в формировании эмоционально-волевой сферы ребенка
- •Влияние аморальных психологических инструментов маркетинга и рекламы на экономику российской федерации.
- •Стиль управления в условиях вахты
- •Особенности эмоциональной регуляции детей раннего возраста
- •Влияние черт характера и акцентуации личности на обучаемость
- •Личностные особенности и мотивация волонтеров XXVII всемирной летней универсиады 2013 года в г.Казани
- •Личностные характеристики молодёжи, имеющей татуировки
- •Направление «Сельское хозяйство»
- •Повышение ресурса работы топливных насосов высокого давления дизельных двигателей
- •Пути повышения экономической эффективности ооо тк «майский» зеленодольского района рт
- •Эффективность применения аммиака при стериализации зернофуража и семенного материала пораженного микромицетами
- •Пути повышения экономической эффективности использования земли в ооо «агрофирма мартен» сабинского района рт
- •Пути повышения производительности труда в растениеводстве в ооо «рыбно-слободская продовольственная корпорация»
- •Изучение состояния молоди рыб куйбышевского водохранилища как механизма оценки возможной продуктивности водоема
- •Пути повышения экономической эффективности производства продукции скотоводства в ооо «Агрофирма Северный» Арского района рт
- •Пути повышения рентабельности производства в молочном скотоводстве в обществе с ограниченной ответственностью «серп и молот» высокогорского района республики татарстан
- •Пути повышения производительности труда в растениеводстве в ооо «схп «камско-устьинское» камско-устьинского района рт
- •Технология безразборного восстановления изношенных поверхностей узлов трения машин и механизмов
- •Пути повышения эффективности производства продукции скотоводства в ооо «труд» балтасинского района рт
- •Исследование процесса разрушения структурных элементов зерна гречихи на предмет определения средней силы удара
- •Пути совершенствования использования социально – психологических методов менеджмента в ооо аф «зай» заинского района рт
- •Применение дистанционного зондирования для прогнозирования урожайности сельскохозяйственных культур (на примере нурлатского муниципального района республики татарстан)
- •Применение средств технической поддержки, обучение и консультирование информационно - консультационной службы в ооо «агрофирма мартен» сабинского района рт
- •Распределение зернового материала в вентиляторе броскового типа при его работе
- •Оптимизация методов определения свободных аминокислот для изучения биологической активности почв сельскохозяйственных угодий
- •Психологические аспекты информационно- консультационной деятельности кфх «шакирзянова д.Ф.» мамадышского района рт
- •Направление «Социология»
- •Миллениалы: особенности и поколения
- •Проблемы профессионально-трудовой мотивации и трудоустройства выпускников медицинских специальностей учреждений профессионального образования
- •Национализм в современной россии
- •Туризм: институциональные характеристики и тенденции развития
- •Исследование сферы образования в городе набережные челны
- •Социальная интеграция детей с ментальной инвалидностью в республике татарстан
- •Изучение проблемы обеспечения жильем молодых семей в городе лениногорске
- •Формирование образовательной инфраструктуры слабовидящих и незрячих граждан в контексте реализации долгосрочной целевой программы республики татарстан «доступная среда»
- •Специфика выражения молодежных гендерных проблем на женских и мужских интернет-форумах
- •Направление «Спорт и здоровый образ жизни»
- •Отношение студентов-спортсменов к интеграции спортивной подготовки и научно-образовательного процесса
- •«Сыграй свою роль»
- •Тенденции развития олимпийского бокса
- •Мотивационные составляющие спортивной деятельности у пауэрлифтеров
- •Совершенствование методики специальной физической подготовки фигуристов 7-8 лет
- •Уровень специальной физической подготовленности фигуристов утг-1 контрольной и экспериментальной групп в начале эксперимента (сентябрь 2012 г.)
- •Уровень специальной физической подготовленности фигуристов утг-1 контрольной и экспериментальной групп в начале эксперимента
- •Уровень специальной физической подготовленности фигуристов утг-1 контрольной и экспериментальной групп в конце эксперимента на начало уч. Года (сентябрь 2013 г.)
- •Выводы:
- •Особенности профессиональной подготовки судей к проведению спортивного соревнования (на примере бадминтона)
- •Методика развития скоростно-силовой подготовки в борьбе на поясах
- •План интегрированного тренировочного процесса в паркуре
- •Эффективность использования методики «активное переключение» в коррекции психомоторики детей среднего школьного возраста с легкой степенью умственной отсталости
- •Направление «Физика»
- •Кротовые норы с цилиндрической симметрией в шестимерной теории калуцы-клейна
- •Поиск переменных в окрестности звезд v523 cas и v520 cyg
- •Термодинамические свойства квазипериодических структур
- •Исследование протегрина pg-1 в водной среде методом спектроскопии ямр
- •Гидроизоляционные составы проникающего действия
- •Образование комплека полипептидного гормона с моделью биологической мембраны по данным спектроскопии ямр
- •Исследование циклических производных пиридоксина методом динамического ядерного магнитного резонанса
- •Направление «Филология»
- •Ә.Еники әсәрләренең рус теленә тәрҗемәләрендә милли-мәдәни колоритның бирелеше реалии в произведениях а.Еники и способы их перевода на русский язык
- •Татар фольклорында һәм әдәбиятында күке образы
- •Миңнуллин шигырьләрендә кабатлаулар
- •Удмурт һәм татар халкының календарь йолаларындагы уртаклыклар
- •«Студенты на страже правописания (на примере вывесок вахитовского района)»
- •Визуальная поэзия в аспекте изобразительно-вербальных средств
- •Особенности просторечной грамматики американского варианта английского языка
- •Проблема лексикографического описания понятия "святой" в межкультурном аспекте
- •Лексико-семантические средства создания портретных характеристик дмитрия карамазова по роману ф.М. Достоевского «братья карамазовы»
- •Организационно-педагогические условия реализации проектов дистанционного обучения иностранных студентов
- •Композиция и ее роль в раскрытии идейного замысла романа дорис лессинг «золотая тетрадь»
- •Креолизованный текст как лингвокультурный феномен: структурно-семантический и прагматический аспекты
- •Лексико-семантический и функциональный анализ шахматного дискурса
- •Лексические трансформации в произведении «тапшырылмаган хатлар» а.Кутуя и его переводе на русский язык
- •Топонимы в современной поэзии
- •Проблемы машинного перевода с татарского языка на русский и с русского языка на татарский (на примере программы «divar»)
- •I. Ошибки, связанные с недостаточным количеством слов в базовом словаре программы:
- •II. Морфологические ошибки:
- •3) Числительных
- •4) Глаголов:
- •III. Синтаксические ошибки.
- •Перевод с русского языка на татарский
- •Ошибки в переводе слов
- •II. Ошибки в переводе предложений/словосочетаний.
- •Языковое сознание автора и специфика его объективации в художественном дискурсе (на материале романа татьяны толстой «кысь»)
- •А.С.Пушкинның “Сказка о золотом петушке” әкияте тәрҗемәләрендә лексик узенчәлекләр
- •Структура университетской газеты (на материале газеты «Казанский университет»)
- •Эмпоронимы г. Елабуги в структурно-семантическом и функциональном аспектах
- •Лексико-семантическая группа «орнитонимы»: на материале категории сравненИй татарского языка
- •Направление «Философия»
- •Современная концепция антропоцентризма или антропный космологический принцип
- •Философия предпринимательства
- •Морально-нравственный компонент в системе средств предупреждения коррупции
- •Вера в жизни человека
- •Эвристическая значимость идеи о биполярности человека
- •Радикализация принципа историзма: от классики к неклассической философии
- •Историзация субъекта как процесс его истеризации
- •Развитие институтов гражданского общества как форма деконструкции идеологии коррупции
- •За кулисами картезианского театра. Концепция самости д. Деннета.
- •Философия и право, до и после
- •Направление «Химия»
- •Показатели компонентных составов безалкогольных и спиртных напитков на здоровье человека
- •Экологически безопасный метод синтеза бисфенольного стабилизатора для полиэтилена с использованием предшественников формальдегида
- •Оценка антиоксидантных свойств вин методом хронокулонометрии
- •Микрофотометр отражения для определения приоритетных экотоксикантов
- •Разработка новых экологичных полимерных древесно - наполненных материалов для городского хозяйства
- •Анализ спиртовых настоек
- •Синтез и свойства композиционных материалов на основе полибутилентерефталата
- •Исследование полимер-олигомерных комплексов в качестве защитных покрытий
- •Направление «Экология»
- •Научно-методические основы медико-биологического мониторинга безопасности человека
- •Использование генетических подходов в оценке экологического состояния водоемов г. Казани
- •Химическая коррозия стеклобоя и отходов стеклянной тары как фактор негативного влияния на окружающую среду
- •Пути совершенствования системы обращения с отходами в республике татарстан
- •Оценка риска здоровью населения г. Казани от употребления водопроводной воды
- •Лазерное сканирование почвенной эрозии
- •Cхема утилизации твердых отходов гипермаркета
- •Экотоксикологическая характеристика донных отложений в районе интенсивной нефтедобычи
- •Адаптация и этапы синантропизации кряквы (Anas platyrhynchos) в условиях города казани
- •Контроль запыленности цехов.
- •Антибиотики как фактор загрязнения экологических компонентов окружающей среды
- •Альтернативные источники энергии: будущее начинается сегодня
- •Направление «Экономика»
- •Финансовые аспекты вступления российской федерации во всемирную торговую организацию
- •Анализ конкурентоспособности розничных торговых предприятий
- •Проект литературного кафе на 40 мест
- •Совершенствование воспроизводственной функции общего благосостояния в системе национального накопления
- •Проблема интеграции математической и гуманитраной компонент в современном экономическом знании
- •Организация кафе быстрого питания
- •Личное страхование: проблемы и перспективы его развития в условиях вступления россии во всемирную торговую организацию (вто)
- •Оценка социально-экономической эффективности проектов государственно-частного партнерства
- •Линейные разностные уравнения, как инструмент построения математических моделей социально-экономических задач
- •Заключение
- •Динамика и проблемы развития регионов севера российской федерации
- •Экономические последствия вступления украины в ес
- •Пути повышения рентабельности производства в молочном скотоводстве в обществе с ограниченной ответственностью «серп и молот» высокогорского района республики татарстан
- •Анализ зарубежного опыта государственного регулирования инновационной деятельности
- •Роль межрайонной ифнс россии № 3 по рт в системе государственного финансового контроля
- •Кредитование малого и среднего бизнеса: основные практические аспекты, оценка текущего состояния и перспективы развития
- •Проблемы учета лизинга и аренды транспортных средств
- •Оценка состояния государственного внутреннего долга рф
- •Направление «Энергетика»
- •Энергосберегающие технологии в системах освещения
- •Высотный ветрогенератор
- •Разработка автоматизированного комплекса мониторинга и управления системой оборотного охлаждения тепловых электрических станций
- •Проблемы комплексной модернизации систем теплоснабжения
- •Ресурсосберегающие системы водоподготовки на основе баромембранных технологий на тэс
- •Оценка перспективы использования углистых сланцев татарстана в качестве альтернативного энергетического топлива
- •Ресурсосберегающая технология очистки сточных вод от ионов тяжелых металлов шламом химводоочитски тэс
- •Направление «Юридические науки»
- •Ответственность государства и его органов за вред, причиненный сторонам трудового договора при осуществлении правосудия
- •Антикоррупционная экспертиза нормативных правовых актов, проводимая органами прокуратуры республики татарстан: актуальные проблемы и пути решения
- •Деятельность уполномоченного по правам человека по защите прав и свобод человека (опыт республики татарстан)
- •Проблемы коммерциализации результатов интеллектуальной деятельности в республике татарстан
- •Проблемы понимания сущности административного процесса и его правовое регулирование в российской федерации
- •Правовое поведение в структуре правовой реальности
- •Проблемы внедрения процедуры семейной медиации
- •Категория правопонимания в системе социально-гуманитарного знания
- •Реализация принципа справедливости при освобождении виновного от уголовной ответственности в связи с истечением сроков давности
- •Некоторые особенности обращения взыскания на отдельные виды имущества должника
Протеиназа htra из bacillus subtilis 168, как потенциальный ранозаживляющий агент
Одной из актуальных задач в современной медицине является создание перевязочных средств, снижающих гноеобразование и омертвение тканей. Одним из подходов к решению этой задачи является использование протеиназных комплексов – ферментов, разлагающих белки. Хорошо известно, что протеиназы, расщепляя денатурированные белки, способствуют очищению ран, и следовательно, ускорению их заживления. Научная новизна работы определяется тем, что впервые в качестве ранозаживляющего препарата будет предложена температуро-зависимая протеиназа, обладающая специфичностью к поврежденным белкам. Использование данного фермента в качестве ранозаживляющего агента потенциально позволит получить низкую токсичность препарата за счет специфичности к денатурированным белкам, а также позволит получить препарат, проявляющий максимум активности при повышенных температурах, наблюдаемых при воспалительных процессах.
Для исследования свойств белка было необходимо получить штамм, обеспечивающий гиперпродукцию рекомбинантного белка HtrA со стреп-тагом на С-конце белка. Фрагмент ДНК, несущий ген htrA размером 1400 п.о., получали с помощью ПЦР с геномной ДНК B.subtilis 168, после чего клонировали в экспрессионный вектор pDG148. В плазмиде ген встроился таким образом, что встал под контроль SPAC-промотора и lac-оператора. Полученную плазмиду (далее pDG148-htrA), для её препаративной наработки, трансформировали в штамм E.coli XL1 Blue, а рекомбинатные штаммы затем отбирали на селективной среде с антибиотиком. Наличие и направление вставки гена проверяли с помощью ПЦР.
Для гиперпродукции белка HtrA, плазмиду pDG148-htrA трансформировали в штамм E.coli BL21, после чего отбирали колонии на среде с ампициллином. С 12 случайных колоний проводили скрининг на гиперпродукцию белка HtrA. Однопроцентную ночную культуру клеток инкубировали при 25ºС. По достижении культурой ОП590=0.8, индуцировали экспрессию целевого белка внесением ИПТГ до конечной концентрации 0,4 мМ. Количество белка анализировали с помощью SDS-ПААГ электрофореза.
Очистку рекомбинантного белка HtrA проводили на стреп-тактин сефарозе. В колонку с сорбентом заливали клеточный экстракт E.coli BL-21 pDG148-htrA. Белок HtrA, имеющий стреп-таг на С-конце, афинно связывался со стреп-тактином, что позволило разделить целевой белок от общей фракции.
Определение протеолитической активности проводили на хромогенном субстрате азоказеине (Fluka) in vitro. Максимум активности очищенной протеиназы наблюдался при рН Tris-HCl–буфера 7,0 и температуре 32°C, как видно на рисунке:
В
Б
А

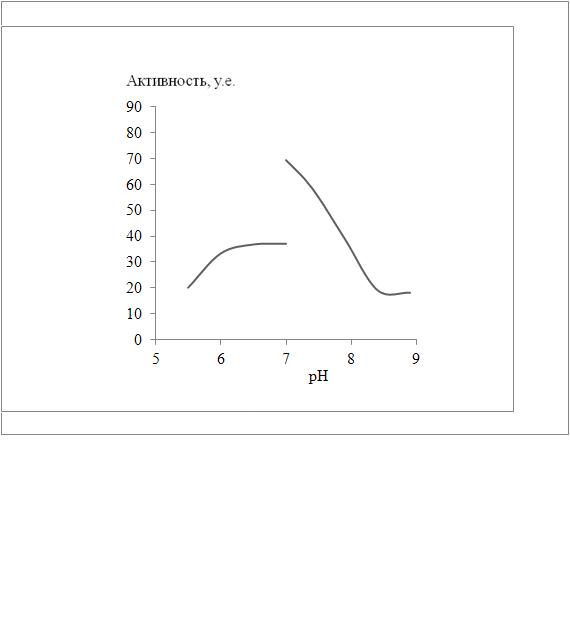

где, А – условия в фосфатном буфере при t=37°C. Б – условия в TrisHCl буфере при t=37°C. В – при различных температурах, и при рН=7,0.
Ввиду того, что уровень очистки белка HtrA с помощью стреп-тага не обеспечил ожидаемого уровня, было принято решение о модификации белка гистидиновым тагом с N-конца белка. ПЦР продукт гена htrA заклонировали в вектор pJET1.2/blunt. При замыкании данного вектора самого на себя активируется летальный для клетки-реципиента ген, что облегчает селекцию рекомбинантных плазмид. Дополнительным селективным фактором выступает среда с антибиотиком, на которой происходит высевание клеток после трансформации.
Протеиназа HtrA имеет два функциональных домена, один из которых - трипсиновый, выполняет протеолитическую функцию, в то время как PDZ-домен играет роль регулятора протеолитической активности. Интересно проверить значение PDZ-домена для функциональности белка и провести очистку белка HtrA, с делецией вышеупомянутого домена. Ген htrA, длиной 1400 п.о., лишенного кодирующей части в 400 п.о. регуляторного участка белка обозначили, как htrS (short), в конечном итоге имеющего размер около 1000 п.о.. ПЦР продукт данного гена также был заклонирован в вектор pJET1.2/blunt.
Полученные рекомбинантные вектора далее были трансформированы в клетки E.coli XL1 Blue для дальнейшей возможности нарабатывать плазмиду в препаративном количестве. Целевые гены вырезались из плазмиды по сайтам рестрикции BamH1 и далее клонировались в другой экспрессионный вектор pET15, имеющего закодированный гистидновый таг для афинной хроматографии белков HtrA и HtrS на Ni-NTAколонке. Полученные вектора далее были трансформированы в клетки E.coli Top10. Колонии, прошедшие селекцию на среде с антибиотиком были проверены на наличие рекомбинантных плазмид.
Далее будет проводиться очистка белка HtrA и рекомбинантного белка с делецией PDZ-домена, получившего условное название HtrS, на Ni-NTA сефарозе и будет дана сравнительная характеристика их физико-химических свойств. При условии, что протеолитическая активность белков окажется приемлемой для использования в энзимотерапии, далее будет проведена иммобилизация ферментов с последующими клиническими испытаниями.
