
- •Учебники и учебные пособия для студентов высших учебных заведений
- •Введение
- •Оборудование микробиологической лаборатории.
- •Правила работы в микробиологической лаборатории.
- •Тема 1. Микроскопический метод исследования микроорганизмов
- •Световая микроскопия.
- •Фазово-контрастное устройство
- •Темнопольный конденсор.
- •Люминесцентная микроскопия.
- •Электронная микроскопия.
- •Тема 2. Морфология микроорганизмов
- •2.1. Форма бактерий
- •Определение подвижности микроорганизмов.
- •Приготовление красителей и окраска мазков-препаратов. Методы пересева микроорганизмов.
- •Приготовление микроскопических препаратов.
- •Тема 3. Морфология грибов
- •Тема 4. Методы стерилизации
- •Стерилизация паром под давлением
- •Тема 5. Культивирование микроорганизмов
- •Тема 6. Методы выделения чистой культуры. Определение биохимических свойств микробов
- •Тема 7. Определение чувствительности микроорганизмов к антибиотикам. Бактериофаги
- •Тема 8. Определение биологических свойств микроорганизмов
- •Упаковка и пересылка патологического материала.
- •Принципиальная схема микробиологического исследования.
- •Определение патогенности.
- •Тема 9. Методы изучения генетики бактерий
- •Индукции мутаций под действием ультрафиолетового излучения
- •Постановка опыта трансформации.
- •Постановка опыта специфической трансдукции.
- •Определение Col-плазмид (колицикогенных факторов).
- •Метод генных зондов.
- •Тема 10. Микробиологические методы исследования объектов окружающей среды
- •Санитарно-бактериологическое исследование молока и молочных продуктов.
- •Санитарно-бактернологическое исследование мяса, колбасных изделий к мясных продуктов.
- •Тема 11. Изучение неспецифической резистентности организма и серологические методы диагностики инфекционных болезней
- •Количественное определение лизоцима в сыворотке крови.
- •Количественное определение комплемента в сыворотке крови.
- •Демонстрация фагоцитоза бактерии.
- •Методы оценки иммунного статуса макроорганизма.
- •Серологические методы исследования.
- •Реакция агглютинации (ра).
- •Реакция преципитации (рп).
- •Реакция связывания комплемента (рск).
- •Иммуноферментный метод.
- •Тема 12. Биологические препараты и их контроль
- •Тема 13. Стафилококки и стрептококки
- •Тема 14.Энтеробактерии
- •Тема 15. Бруцеллы и возбудитель туляремии
- •Тема 16. Пастереллы
- •Тема 17. Иерсинии
- •Тема 18. Возбудители рожи и листериоза
- •Тема 19. Псевдомонады
- •Тема 20. Возбудитель сибирской язвы
- •Тема 21. Патогенные анаэробы
- •Возбудитель дизентерии ягнят
- •Возбудитель брадзота овец
- •Возбудитель энтеротоксемии овец
- •Возбудитель эмфизематозного карбункула (эмкар)
- •Тема 22. Патогенные микобактерии Возбудитель туберкулеза.
- •Тема 23. Возбудитель актиномикоза
- •Тема 24. Патогенные спириллы
- •Тема 25. Микоплазмы
- •Тема 26. Риккетсии
- •Тема 27. Хламидии
- •Тема 28. Патогенные грибы
- •Приложение методические указания к проведению практических занятий для преподавателей
- •Частные методики.
- •Тема 3. Цель занятия: ознакомить студентов с особенностями морфологии и методами исследования микроскопических грибов различных таксономических групп.
- •Тема 4. Цель занятия: ознакомить студентов с назначением и основными методами стерилизации, применяемыми в микробиологии.
- •Тема 6. Цель занятия: ознакомить студентов с методами изучения ферментативной активности и принципами идентификации микроорганизмов.
- •Тема 7. Цель занятия, ознакомить студентов с методами определения чувствительности микроорганизмов к антибиотикам, а также с действием бактериофагов и их практическим использованием.
- •Тема 8. Цель занятия: ознакомить студентов с основными методами и показателями санитарно-микробиологической оценки состояния объектов окружающей среды.
- •Тема 9. Цель занятия: ознакомить студентов с фенотипической и генотипической изменчивостью, генетическими методами идентификации микроорганизмов.
- •Тема 12. Цель занятия: ознакомить студентов с вакцинами различных типов, лечебно-профилактическими и диагностическими иммунными сыворотками, антигенами, аллергенами и принципами их контроля.
- •Тема 13. Цель занятия: ознакомить студентов с этапами лабораторной диагностики, основными свойствами возбудителей стафи-лококкозов, стрептококкозов и биопрепаратами.
- •Тема 14. Цель занятия: ознакомить студентов с методами лабораторной диагностики и биологическими свойствами возбудителей эшерихиозов и сальмонелл; биопрепаратами.
- •Тема 15. Цель занятия: ознакомить студентов со свойствами возбудителей и лабораторной диагностикой бруцеллеза и туляремии, а также биопрепаратами.
- •Тема 17. Цель занятия: изучить свойства возбудителей и схемы лабораторной диагностики зооантропонозной чумы и псевдотуберкулеза.
- •Тема 18. Цель занятия: ознакомить студентов с этапами лабораторной диагностики и свойствами возбудителей рожи свиней, ли-стериоза, биопрепаратами.
- •Тема 19. Цель занятия: ознакомить студентов со свойствами возбудителей и лабораторной диагностикой сапа, мелиоидоза, псевдомоноза норок и биопрепаратами.
- •Тема 20. Цель занятия: ознакомить студентов со свойствами возбудителя, схемой лабораторной диагностики сибирской язвы, биопрепаратами.
- •Тема 21. Цель занятия: ознакомить студентов со свойствами возбудителей анаэробиозов, схемами лабораторного исследования, биопрепаратами.
- •Тема 22. Цель занятия: ознакомить студентов со свойствами возбудителей, методами лабораторной диагностики туберкулеза и паратуберкулеза, биопрепаратами.
- •Тема 23. Цель занятия: ознакомить студентов со свойствами возбудителя актиномикоза.
- •Тема 24. Цель занятия: ознакомить студентов с методами лабораторной диагностики лептоспироза, кампилобактериоза и дизентерии свиней, биологическими свойствами возбудителей, биопрепаратами.
- •Тема 25. Цель занятия: ознакомить студентов со свойствами возбудителей, методами лабораторной диагностики микоплазмозов.
- •Тема 27. Цель занятия: ознакомить студентов со свойствами возбудителей, методами лабораторной диагностики хламидиозов, биопрепаратами,
Тема 1. Микроскопический метод исследования микроорганизмов
При выполнении любых микробиологических исследований необходимо точно знать особенности строения микроорганизмов. Эти сведения могут быть получены только путем изучения данного организма с помощью микроскопа. Первый простейшего устройства оптический микроскоп был сконструирован Антони ван Левенгуком (рис. 1).
В настоящее время многие вопросы цитологии микробов решаются на уровне электронной микроскопии. Это, однако, не значит, что традиционная микроскопия в видимом свете потеряла свое значение. Первоначальный подсчет количества микроорганизмов, первичная их идентификация, изучение роста и отдельных элементов структуры производят с помощью светового микроскопа. Микробиологические лаборатории оснащены микроскопами различных моделей: МБР-1, МБИ-1, МБИ-2, МБИ-3, МБИ-6, «Биолам», Р-1 и др. Микроскопированием определяют морфологические особенности микроорганизмов, их тинктори-альные (способность окрашиваться теми или иными красителями) свойства, подвижность, наличие специальных структурных элементов (спора, капсула).
Современный микроскоп состоит из оптической и механической частей. К механической части относятся штатив, тубус (труба) с револьверным устройством, предметный столик, механизм тонкой и грубой наводки (рис. 2).Штатив состоит из двух частей: держателя трубы микроскопа
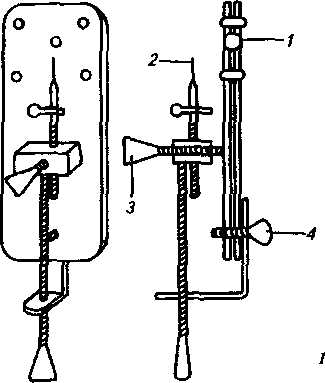
Рис 1. Микроскоп Левенгука:
1— линза; 2—- булавка, к которой крепится объект; З, 4— фокусирующие винты
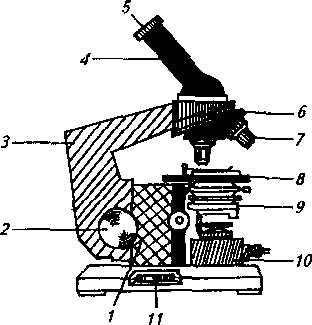
Рис. 2. Устройство оптического микроскопа;
/ — основание микроскопа; 2 — рукоятка мак-рометрнческого винта; 3 — тубусодержатсль; 4 — тубус; 5—окуляр; й—револьвер объективов; 7— объектив; 8— предметный столик; 9—конденсор; 10 — осветитель;11-рукоятка микрометрического винта
и массивной ножки, которая служит опорой микроскопа. На штативе укреплен подвижный столик, который приводится в движение двумя винтами, расположенными по его бокам. При помощи этих винтов препарат вместе со столиком вращается и перемешается в разных
направлениях, что облегчает его рассмотрение. Для этой цели предназначены крестообразные устройства, которые позволяют двигать препарат в двух взаимно перпендикулярных направлениях. С помощью двух шкал, имеющихся на таком столике, можно отмечать участки препарата, интересующие исследователя, и отыскивать их при повторных наблюдениях.
В тубусе находится оптическая система. Он перемешается вверх и вниз при помощи двух винтов. Для более грубого перемещения служит зубчатка, или кремальера. Точная установка достигается движением микровинта с мелкой нарезкой: полный оборот микровинта передвигает тубус на 0,1 мм.
В нижней части тубуса имеется револьверное устройство, в которое можно ввинчивать 4 объектива (на некоторых микроскопах 5) и переключать их во время работы. В верхнее отверстие тубуса вставляется окуляр.
Оптическая часть микроскопа состоит из окуляров, объективов, конденсора и зеркала.
Зеркало отражает падающий на него свет и направляет его в конденсор для освещения препарата. Одна сторона зеркала плоская; ею пользуются при любом источнике света и при любом увеличении. Другая, вогнутая, сторона зеркала предназначена для работы без конденсора при малых увеличениях.
Конденсор состоит из нескольких линз, собирающих отраженный зеркалом свет в пучок и направляющих его па плоскость препарата. В нижней части конденсора расположена ирисовая диафрагма, посредством которой можно менять угол лучей и количество пропускаемого конденсором света. Фокусировку конденсора осуществляют специальным микровинтом.
Наиболее важная часть микроскопа — объектив. Он представляет собой систему линз, строящих действительное увеличенное и перевернутое изображение объекта. Наружная, или передняя, линза носит название фронтальной. Даваемое ею изображение объекта страдает рядом аберраций, свойственных каждой простой линзе. Эти аберрации устраняются вышележащими коррекцион-ными линзами.
Объективы по способности устранять аберрации бывают следующие: ахроматы, апохроматы и с плоским изображением. Ахроматы более распространены вследствие простоты и дешевизны. В них 6 линз из оптического стекла, изображение наиболее резкое в центре. Апохроматы более совершенно устраняют хроматическую погрешность, их резкость и величина изображения более равномерная в лучах разной длины волн: их используют совместно со специальными компенсационными окулярами.
Каждый объектив характеризуется свойственным ему собственным увеличением, фокусным расстоянием, численной апертурой и некоторыми другими константами. Увеличение объектива и значение его апертуры обычно обозначены на оправе.
Под численной апертурой (А) объектива понимают произведение синуса половины угла лучей, входящих в объектив (и), и показателя преломления среды (п), находящейся между покровным стеклом препарата и фронтальной линзой объектива:
А = sin« ■ п.
Если этой средой является воздух, то ввиду того, что показатель преломления воздуха равен единице (1), численная апертура «сухих» объективов практически не может быть выше 0,95. Чтобы ее повысить, объектив иммерсируют, т. е. погружают в специальную среду (воду, глицерин, иммерсионное масло), показатель преломления которой больше такового воздуха.
Работа с иммерсионным объективом состоит в следующем. Предварительно наносят сверху на препарат каплю иммерсионного масла, а затем, опуская осторожно тубус, погружают в него объектив. Так как показатели преломления стекла и масла близки между собой, то таким образом устраняется возможность слишком большого рассеивания лучей (рис. 3 и 4).
Окуляр микроскопа — это увеличивающая оптическая система, через которую рассматривается действительное изображение объекта, которое дает объектив. Окуляр состоит из двух линз: собирающей, обращенной к объективу, и глазной, обращенной к глазу. Между ними находится диафрагма, которая задерживает боковые лучи и пропускает лучи, близкие к оптической оси и дающие более контрастное изображение. Окуляр еще раз увеличивает построенное объективом изображение объекта, но не раскрывает новых деталей его строения. Собственное увеличение окуляра (F0K) равно расстоянию наилучшего видения для нормального глаза (250 мм), деленному на фокусное расстояние (/) линз:
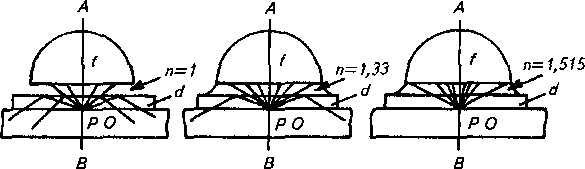
/—фронтальная линза; d — предметное стекло; п = 1 — показатель преломления воздуха; п= 1,33 —показатель преломления воды; л = 1,515 —показатель преломления иммерсионного (кедрового) масла
Оптическая мощность микроскопа включает в себя возможное увеличение, разрешающую силу и способность точного изображения, зависящую от устранения аберраций.
Общее увеличение микроскопа равно произведению увеличения объектива и увеличения окуляра .
Под разрешающей способностью микроскопа (а) понимают наименьшее расстояние между двумя точками объекта, которые воспринимаются глазом раздельно и не сливаются в одну: чем меньше размер частицы, видимой в микроскоп, тем больше его разрешающая способность.
Чем меньше длина волны света и чем больше числовая апертура, тем меньшие детали объекта можно рассмотреть в микроскопе.

Рис. 4. Ход лучей в иммерсионной системе:
I — иммерсионное масло (п- 1,515); 2 — фронтальная линза иммерсионного объектива; 3— предметное стекло (я = 1,52); 4— воздух
Наименьшие частицы, которые удается рассмотреть в современных световых микроскопах, должны иметь величину больше '/з длины волны света. Следовательно, при пользовании видимой частью дневного света, включающей волны от 400 до 700 нм, в микроскопе могут быть обнаружены частицы величиной не менее 200 нм. Чтобы довести эту величину до размеров, видимых глазом, разрешающая способность которого составляет 0,2 мм, необходимо увеличить объект в 1000 раз. Это увеличение принято считать полезным.
Определение размеров микроорганизмов. Размеры бактерий варьируют в широких пределах — от 0,2 мкм до 125 мкм; у большинства патогенных бактерий — от десятых долей микрометра до нескольких микрометров.
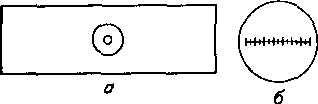
При характеристике размеров бактерий обычно указывают длину и ширину клетки в микрометрах {10~3 мм). В качестве инструментов измерения используют окуляр- и объект-микрометры.
Окуляр-микрометр — стеклянная пластинка, на которой линия в 5 мм разделена на 10 или 20 делений {размещают в окуляре).
Объект-микрометр — предметное стекло с линией длиной 0,5 или 1,0 мм, разделенной на сотые доли (рис. 5 и 6).
Объект-микрометр помещают на предметный столик и, глядя в окуляр с окуляр-микрометром, совмещают начальную черту в объект- и окуляр-микрометрах. Затем определяют цену деления окуляр-микрометра при данных окуляре и объективе.
Пример. Шкала объект-микрометра составляет 1 мм, и одно ее деление равно 10~2 мм, т. е. 10 мкм. При совмещении шкалы объект-микрометра три его деления (т. е. 30 мкм) соответствуют 14 делениям окуляр-микрометра, отсюда одно деление окуляр-микрометра составляет 30: 14 =2,14 мкм. После того как определена цена одного деления окуляр-микрометра, вместо объект-микрометра помещают препарат с исследуемым объектом. Например, палочковидный микроб по длине занимает 3, а по ширине—0,5 деления окуляр-микрометра: если одно деление окуляр-микрометра составляет 2 мкм, то длина бактериальной клетки будет 3-2 = 6 мкм, а ширина — 0,5 -2=1 мкм.
При микроскопировании существенное значение имеет освещение исследуемого объекта. Освещение чаще устанавливают по методу Келера:
Осветитель (желательно использовать стандартные ос ветители ОИ-7 и ОИ-19, у ко торых микролампу с неболь шой плотно скрученной спира лью можно передвигать вдоль оси осветителя) располагают на расстоянии 30...40 см от мик роскопа.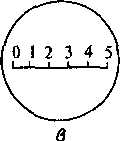
На предметный столик
кладут препарат; объектив х8
переводят в рабочее положение.
Рис.
5. Микрометры:
а
— общий
ввд; б— объект-микрометр;
в-окуляр-микрометрггрр
Конденсор поднимают до упора; ирисовую диафрагму полностью открывают.
Зеркало устанавливают плоской поверхностью и почти полстью закрывают диафрагму осветителя.
На зеркало помещают лист белой бумаги и, передвигая патрон осветителя, добиваются четкого изображения на бумаге его нити накала лампы.
Глядя в окуляр, при помощи зеркала получают в центре поля зрения изображение краев диафрагмы осветителя — светлое пятно с нерезко очерченными краями.
Используя объектив х8, фокусируют объект в области свет лого пятна.
Опуская конденсор, в плоскости препарата фокусируют изображение краев диафрагмы осветителя и движением зеркала переводят светлое пятно в центр поля зрения.
Диафрагму осветителя открывают до тех пор, пока светлое пятно не закроет все поле зрения.
10. В дальнейшем положение зеркала, конденсора и диафрагмы осветителя больше не меняют.
0
5 10 15 20 25
0
12 3 4 5 6
-
Окуляр-микрометр
•
Объект-микрометр
Рис. 6. Определение цены деления окуляр-микрометра.
При работе с учебным микроскопом освещение нередко устанавливают упрощенным способом. Приступая к работе, следует проверить состояние конденсора: он должен быть приподнят, диафрагма открыта. Приподняв тубус микроскопа, устанавливают объектив с наименьшим увеличением (х8, хЮ) и, глядя в окуляр, при помощи зеркала добиваются полного освещения поля зрения. На исследуемый препарат наносят каплю кедрового масла (или его заменителя), помещают препарат на предметный столик и поворотом револьвера устанавливают иммерсионный объектив. (Чтобы избежать соприкосновения объектива со столиком, тубус следует держать приподнятым.) Под контролем глаза (смотреть сбоку) фронтальную линзу объектива легким поворотом макрометрического винта погружают в каплю иммерсионного масла и, наблюдая в окуляр, осторожно поднимают тубус до видимости препарата. Затем легкими поворотами микрометрического винта (вперед-назад) регулируют четкость изображения.
