
- •7.2. Гормональная система растений
- •7.2.1. Общие принципы гормональной регуляции
- •7.2.1.1. Регуляторные молекулы растений
- •7.2.1.2. Рецепция и усиление сигнала
- •7.2.1.3. Фосфатидилинозитольная система вторичных мессенджеров
- •7.2.1.4. Взаимодействие сигналов
- •7.2.2. Ауксины — гормоны апекса побега
- •7.2.2.1. История открытия ауксинов
- •7.2.2.2. Биосинтез и деградация ауксинов
- •7.2.2.3. Транспорт ауксинов
- •7.2.2.4. Физиологические эффекты ауксинов
- •7.2.2.5. Ауксины и неоднородность внешней среды
- •7.2.2.6. Ауксин и плоды
- •7.2.2.7. Ауксин как гербицид
- •7.2.2.8. Гравитропизм
- •7.2.3. Цитокинины — гормоны корневого апекса
- •7.2.3.1. История открытия
- •7.2.3.2. Биосинтез и инактивация цитокининов
- •7.2.3.3. Эффекты цитокининов от апекса корня до апекса побега
- •7.2.4. Взаимодействие ауксинов и цитокининов
- •7.2.4.1. Физиологическое действие ауксинов и цитокининов в культуре in vitro
- •7.2.4.2. Баланс между ауксинами и цитокининами в интактном растении
- •7.2.4.3. Цитокинины и паразиты растений
- •7.2.5. Гиббереллины — гормоны листа
- •7.2.5.1. История открытия
- •7.2.5.2. Биосинтез гиббереллинов
- •7.2.5.3. Основные физиологические эффекты гиббереллинов
- •7.2.5.4. Гиббереллины и прорастание зерна
- •7.2.5.5. Гиббереллин и проявление пола у растений
- •7.2.5.6. Гиббереллин и цветение растений
- •7.2.6. Абсцизовая кислота — сигнал водного стресса
- •7.2.6.1. Открытие абсцизовой кислоты
- •7.2.6.2. Биосинтез абсцизовой кислоты
- •7.2.6.3. Передача абк-сигнала
- •7.2.6.5. Регуляция покоя семян абк
- •7.2.6.6. Синдром дефицита абк
- •7.2.6.7. Абк и форма листьев
- •7.2.7. Этилен — сигнал механического стресса
- •7.2.7.1. Открытие физиологической роли этилена
- •7.2.7.2. Биосинтез этилена
- •7.2.7.3. Рецепция и передача сигнала
- •7.2.7.4. Этилен как гормон механического стресса
- •7.2.7.5. Этилен и прикосновение
- •7.2.7.6. Этилен и заживление ран
- •7.2.7.7. Регуляция листопада в умеренных широтах
- •7.2.7.8. Формирование и созревание плодов
- •7.2.7.9. Биотический стресс
- •7.2.7.10. Этилен и цветение ананасов
- •7.2.8. Другие гормональные вещества растений
- •7.2.8.1. Брассиностероиды
- •7.2.8.2. Жасминовая кислота
- •7.2.8.3. Салициловая кислота
- •7.2.8.4. Олигосахарины
- •7.2.8.5. Короткие пептиды
7.2.3. Цитокинины — гормоны корневого апекса
7.2.3.1. История открытия
Первые стерильные культуры клеток животных были получены в начале XX в., но до 1950-х гг. получить культуры растительных клеток не удавалось. Над этой проблемой работал американец Ф. Скуг. Полученную из стеблей табака (Nicotiana tabacum) сердцевинную паренхиму помещали на искусственные среды, содержащие минеральные вещества, сахар, витамины, аминокислоты, а также ИУК. Клетки паренхимы приступали к делениям, но рост быстро останавливался. В лаборатории Ф. Скуга перепробовали различные добавки: экстракт дрожжей, томатный сок, сок листьев табака, и все безрезультатно. Небольшого успеха удалось добиться только при добавлении в среду кокосового молока. В 1950-х гг. ученые обнаружили, что наследственная информация передается от родителей к потомкам с помощью ДНК (механизм этого явления был не известен). Ф.Скуг предположил, что растительным клеткам не хватает ДНК. В среды начали добавлять ДНК из молок сельди (самый дешевый источник ДНК), но клетки не делились.
Открытие цитокининов состоялось благодаря ошибке, допущенной в ходе эксперимента. По методике флаконы со средой помещали в автоклав, где раствор нагревается выше 100 °С. Случайно режим автоклавирования был нарушен, и среда вместе с ДНК перегрелась. Именно на этой среде сердцевинная паренхима табака начала интенсивно расти. Выяснилось, что в перегретом препарате ДНК есть вещество, которое на фоне ауксина вызывает деление клеток, — фурфуриладенин (рис. 7.11). По физиологическому эффекту это вещество назвали кинетином (от греч. kinesis — деление). Вскоре из эндосперма кукурузы выделили аналогичное природное вещество — зеатин (Zea — кукуруза). Так была открыта новая группа фитогормонов — цитокинины.
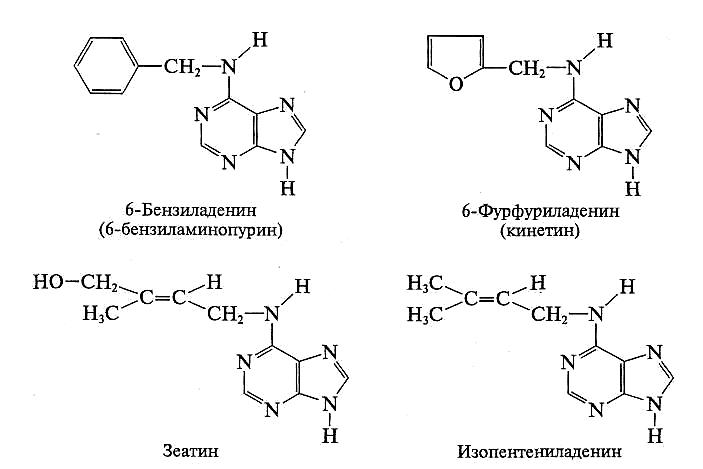
Рис. 7.11. Примеры естественных цитокининов и их синтетических аналогов
Первые неудачи Ф. Скуга объяснялись разрушением природных цитокининов при нагревании. В растительных экстрактах содержались природные цитокинины, но они разрушались при автоклавировании.
7.2.3.2. Биосинтез и инактивация цитокининов
В клетке цитокинины образуются из аденина: к нему присоединяется боковая изопентильная группа и это приводит к образованию цитокининового скелета. Далее происходит дефосфорилирование и отщепляется рибоза. Самый простой из цитокининов — изопентениладенин, который проявляет большую физиологическую активность, чем изопентениладенинрибозид, или изопентенил-АМФ. Другие цитокинины образуются при модификации изопентильного фрагмента (гидроксилирование, окисление, восстановление).
Цитокинины в клетке присутствуют в активной и неактивной форме. Неактивные формы цитокининов — N9-гликозиды и гликозиды по гидроксилам изопентенильного фрагмента (рис. 7.12). Присоединяя или отсоединяя сахара, клетка регулирует концентрацию активных цитокининов. Возможно необратимое разрушение цитокининов, поэтому по мере удаления от точки синтеза их концентрация падает.
Выделены гены растений, белковые продукты которых связываются с ци-токинином и имеют характерную для рецепторов структуру. Так, у белка CRE 1 (от cytokinine receptor) есть фрагмент, выступающий на наружную поверхность плазмалеммы и связывающийся с молекулой цитокинина. Ближе к С-концу в белке расположены гистидинкиназный домен и два домена, участвующие в переносе фосфатной группы (REC — Receiver domains). Предполагают, что рецептор цитокинина взаимодействует с МАР-киназной системой трансдукции сигнала.
Цитокинины способствуют синтезу ДНК в клетке, контролируют S-фазу клеточного цикла у растений. Аденин с заместителями, похожими на радикал цитокининов, входит в состав тРНК. Если брать синтетические аналоги цитокининов (бензиламинопурин — БАЛ), то радикал-бензил появляется в тех же тРНК в характерном положении. По-видимому, цитокинин не встраивается в тРНК, происходит лишь «переброска» радикала с молекулы цитокинина на аденин тРНК.
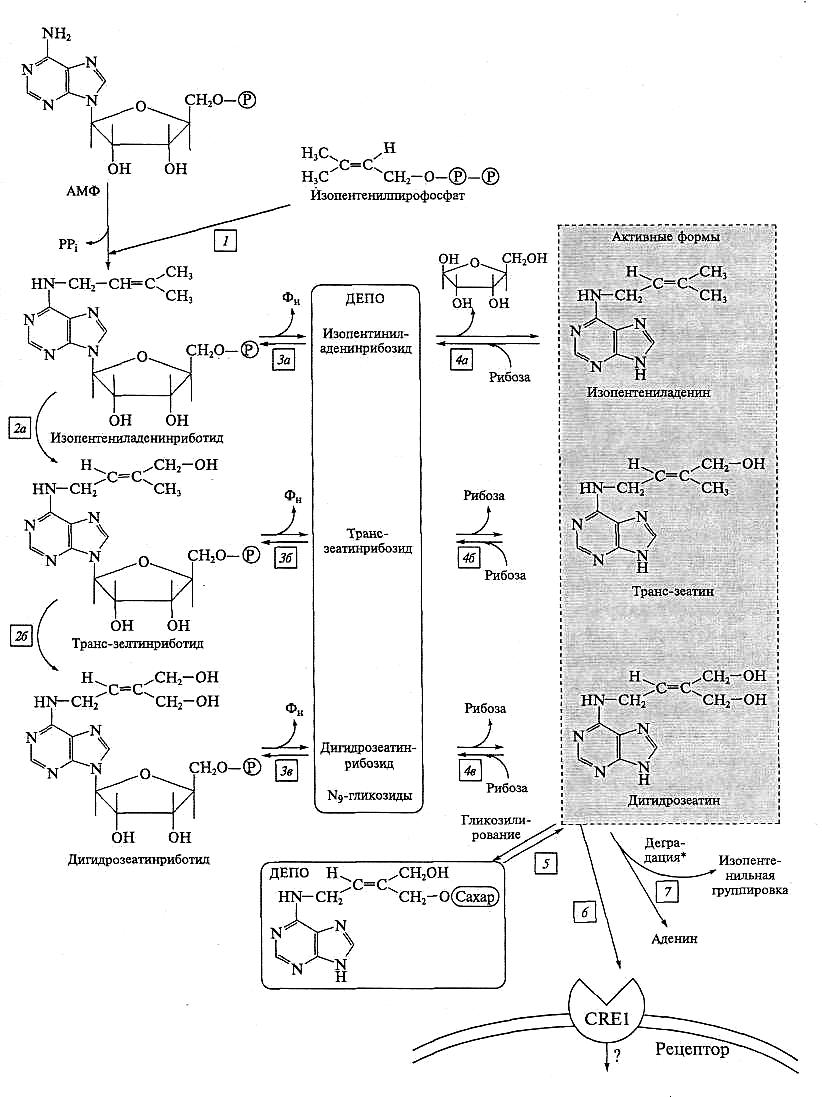
Рис. 7.12. Биосинтез, инактивация, деградация и рецепция цитокининов:
1 — ключевой этап биосинтеза цитокининов: присоединение изопентенильной группировки к адениновому ядру; 2а, 26 — гидроксилирование изопентенильной группировки создает многообразие природных цитокининов; За, 36, Зв — дефосфорилирование, приводящее к неактивным (запасным) N9-гликозидным формам; 4а, 46, 4в — удаление/присоединение рибозы контролирует баланс активных и неактивных форм цитокининов; 5 — депонирование при гликозилировании изопентенильной группировки; 6 — рецепция цитокининов; 7 — необратимая деградация цитокининов путем отсоединения изопентенильной группировки
