
- •7.2. Гормональная система растений
- •7.2.1. Общие принципы гормональной регуляции
- •7.2.1.1. Регуляторные молекулы растений
- •7.2.1.2. Рецепция и усиление сигнала
- •7.2.1.3. Фосфатидилинозитольная система вторичных мессенджеров
- •7.2.1.4. Взаимодействие сигналов
- •7.2.2. Ауксины — гормоны апекса побега
- •7.2.2.1. История открытия ауксинов
- •7.2.2.2. Биосинтез и деградация ауксинов
- •7.2.2.3. Транспорт ауксинов
- •7.2.2.4. Физиологические эффекты ауксинов
- •7.2.2.5. Ауксины и неоднородность внешней среды
- •7.2.2.6. Ауксин и плоды
- •7.2.2.7. Ауксин как гербицид
- •7.2.2.8. Гравитропизм
- •7.2.3. Цитокинины — гормоны корневого апекса
- •7.2.3.1. История открытия
- •7.2.3.2. Биосинтез и инактивация цитокининов
- •7.2.3.3. Эффекты цитокининов от апекса корня до апекса побега
- •7.2.4. Взаимодействие ауксинов и цитокининов
- •7.2.4.1. Физиологическое действие ауксинов и цитокининов в культуре in vitro
- •7.2.4.2. Баланс между ауксинами и цитокининами в интактном растении
- •7.2.4.3. Цитокинины и паразиты растений
- •7.2.5. Гиббереллины — гормоны листа
- •7.2.5.1. История открытия
- •7.2.5.2. Биосинтез гиббереллинов
- •7.2.5.3. Основные физиологические эффекты гиббереллинов
- •7.2.5.4. Гиббереллины и прорастание зерна
- •7.2.5.5. Гиббереллин и проявление пола у растений
- •7.2.5.6. Гиббереллин и цветение растений
- •7.2.6. Абсцизовая кислота — сигнал водного стресса
- •7.2.6.1. Открытие абсцизовой кислоты
- •7.2.6.2. Биосинтез абсцизовой кислоты
- •7.2.6.3. Передача абк-сигнала
- •7.2.6.5. Регуляция покоя семян абк
- •7.2.6.6. Синдром дефицита абк
- •7.2.6.7. Абк и форма листьев
- •7.2.7. Этилен — сигнал механического стресса
- •7.2.7.1. Открытие физиологической роли этилена
- •7.2.7.2. Биосинтез этилена
- •7.2.7.3. Рецепция и передача сигнала
- •7.2.7.4. Этилен как гормон механического стресса
- •7.2.7.5. Этилен и прикосновение
- •7.2.7.6. Этилен и заживление ран
- •7.2.7.7. Регуляция листопада в умеренных широтах
- •7.2.7.8. Формирование и созревание плодов
- •7.2.7.9. Биотический стресс
- •7.2.7.10. Этилен и цветение ананасов
- •7.2.8. Другие гормональные вещества растений
- •7.2.8.1. Брассиностероиды
- •7.2.8.2. Жасминовая кислота
- •7.2.8.3. Салициловая кислота
- •7.2.8.4. Олигосахарины
- •7.2.8.5. Короткие пептиды
7.2.1.4. Взаимодействие сигналов
Несмотря на большое многообразие первичных сигналов, при ответе клетка часто активизирует одни и те же механизмы, которые можно назвать неспецифическим ответом. Так, при действии ауксинов, гиббереллинов, абсцизовой кислоты, красного света и даже при оказании механического давления на клетку уже через 1 мин можно зарегистрировать гидролиз фосфатидилинозитолди-фосфата со всей цепочкой последующих событий. Активизируются и другие системы вторичных мессенджеров. Один и тот же компонент может входить в несколько каскадов усиления сигнала. Так, многие системы вторичных мессенджеров включает Са2+. Часто происходит изменение редокс-статуса клетки и увеличивается концентрация активных форм кислорода.
Протеинкиназы и факторы транскрипции изменяют активность в ответ на несколько воздействий. Оказывается, что участники одного каскада вторичных мессенджеров вовлечены и в другие реакции ответа. Тогда говорят о «переговорах» путей передачи сигнала (от англ. signaling path cross-talk). При повреждении узловых точек в перекрестной регуляции нарушается физиологический ответ на несколько стимулов одновременно. Так, мутант nph 4 (non-phototropic hypocotyl) не чувствителен ни к свету, ни к силе тяжести. Очевидно, белковый продукт гена NPH 4 участвует в «переговорах» между каскадами мессенджеров фото- и гравитропизма (см. подразд. 7.2.2.4). Если бы на каждом этапе передачи сигнала происходило только усиление, ответ слишком быстро охватил бы все молекулы в клетке. Этого не происходит благодаря «переговорам»: если один сигнал «противоречит» другим, в результате «переговоров» число его мессенджеров уменьшается. Востребованный сигнал в результате «переговоров» усиливается. Таким образом, одна из функций «переговоров» между сигнальными путями — модуляция сигнала.
Специфический ответ клетки предполагает, что 1) разные клетки в одном организме отвечают на стимул не одинаково; 2) одна и та же клетка отвечает на разные стимулы по-разному. Это достигается за счет того, что в ядре экспрессируется разный набор мРНК, в клетке вырабатываются новые белки, что позволяет развить адекватную реакцию на стимул. Восприятие сигнала зависит от состояния, в котором находилась клетка перед его получением, — от набора рецепторов, экспрессированных в данный момент, наличия вторичных мессенджеров, результатов «переговоров» между сигналами и т.д.
В организме растения существует позиционная информация, т. е. клетки «умеют оценивать» свое положение. Это позволяет им интегрироваться в единый организм и давать адекватный ответ на внешние и внутренние стимулы. Программированная гибель клеток — это ответ растения как единого целого, идущий вопреки «интересам» отдельных клеток. Запрограммированная гибель характерна для элементов ксилемы, пробковой ткани, при реакции сверхчувствительности (ответ на внедрение патогена).
7.2.2. Ауксины — гормоны апекса побега
7.2.2.1. История открытия ауксинов
В 1880 г. Ч. и Ф.Дарвины решали проблему воспринимающего свет органа. Растения изгибаются к боковому источнику света, причем изгиб происходит в субапикальной зоне (ниже апекса побега). Исследователи защищали от света субапикальную область — зону изгиба — светонепроницаемой тканью (рис. 7.4) и наблюдали при этом, что растения все-таки изгибались. Когда незакрытую верхушку (стеблевой апекс) проростка накрыли черным колпачком, изгиб в сторону света не происходил, хотя зона изгиба была хорошо освещена. По-видимому, направление света воспринималось апексом стебля, откуда сигнал передавался в нижележащую зону изгиба. Ч. и Ф.Дарвины предположили, что апекс стебля вырабатывает вещество, транспортирующееся вниз и вызывающее неравномерный рост, и это гипотетическое вещество они назвали ауксином (от греч. аихо — расту).
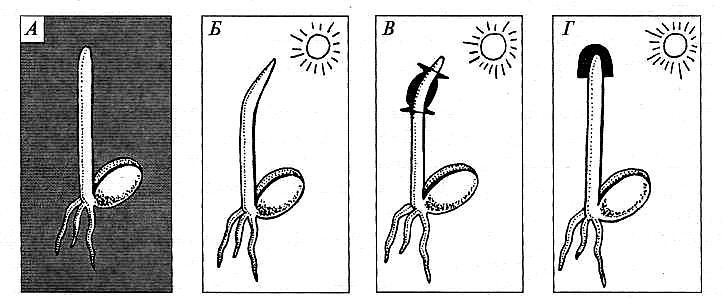
Рис. 7.4. Опыт Ч. и Ф. Дарвинов:
А — отрицательный контроль (темнота): нет изгиба; Б — положительный контроль (свет справа): есть изгиб; В — опыт (свет справа, закрыта зона изгиба): есть изгиб; Г — опыт (свет справа,
закрыт апекс): нет изгиба
Гипотеза Ч. и Ф. Дарвинов — не единственное объяснение. Сигнал мог передаваться в виде электрических импульсов и приводить к тому же эффекту. Ауксиновая гипотеза нуждалась в экспериментальной проверке. Через 50 лет наш соотечественник Н. Г. Холодный и немец Ф. В. Вент независимо друг от друга провели эксперименты для изучения природы этого сигнала. Вещество, передающее сигнал из апекса в зону изгиба, должно растворяться в воде. Значит, при помещении побеговых апексов в воду в раствор перейдут и гипотетические ауксины. Затем нужно создать несимметричное распределение «ауксина»: верхушку с собственными ауксинами удалить, а на срез несимметрично нанести водный экстракт апексов. По техническим причинам опыт видоизменили: апексы располагали на агаровом геле, а растение декапитировали и сбоку накладывали на срез кубик агара с экстрактом. В таких условиях растения изгибались в сторону, противоположную наложенному агаровому блоку. Контролем служил агаровый блок, не пропитанный экстрактом побеговых апексов, — изгиба не было (рис. 7.5).
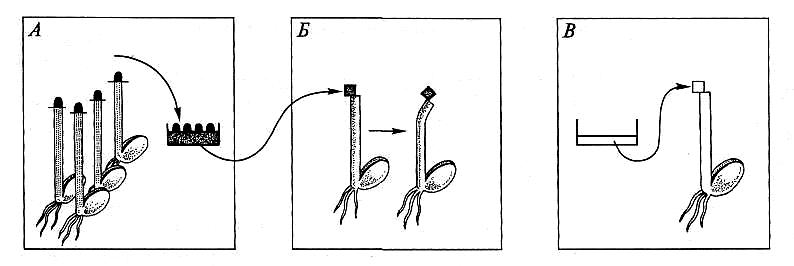
Рис. 7.5. Опыт Ф. В. Вента:
А — начало опыта: ауксин из апексов колеоптилей диффундирует в агар (затемненные участки);
Б — продолжение опыта: наложенный сбоку кубик агара с ауксином вызывает изгиб; В —
контроль: агар без ауксина не вызывает изгиба
Н. Г. Холодный и Ф. В. Вент доказали, что ростовое вещество существует и вызывает растяжение клеток. Можно предположить, что при одностороннем освещении ауксин перетекает на затененную сторону и вызывает изгиб к свету. Не имея препарата выделенного ауксина, исследователи изучили его основные свойства. Если зону изгиба вырезать и блок с экстрактом ауксина накладывать на базальную сторону, изгиба не будет. Отсюда следовало, что ауксин движется по растению полярно — от апекса побега к его основанию, а затем — к апексу корня. Была измерена скорость транспорта ауксинов: на участок заданной длины помещали сверху агар с ауксином, а снизу — агаровый блок без ауксина. Верхний агаровый блок служил донором ауксинов, а нижний — коллектором. Нижний блок через равные промежутки времени заменяли новым. Полученную серию нижних блоков анализировали на проростках на наличие ауксинов. Таким способом удалось определить, что скорость транспорта ауксинов составляет от нескольких миллиметров до нескольких сантиметров в час.
Немецкий химик Ф. Кёгль в 1939 г. выделил из мочи вегетарианцев индолилуксусную кислоту (ИУК). Для определения ее малых количеств Кёгль испробовал ИУК в разных живых системах. Выяснилось, что ИУК усиливает рост проростков с отрезанной верхушкой подобно ауксину. При асимметричном наложении агарового блока с ИУК наблюдается характерный изгиб в субапикальной зоне.
Вскоре ИУК была выделена из верхушек побегов, тем самым было показано, что ИУК является одним из естественных акусинов. Известен ряд веществ, обладающих ауксиновой активностью (фенилуксусная кислота, индолилпировиноградная кислота), но их активность ниже, чем ИУК, и они менее распространены.
Кроме того, удалось синтезировать вещества, вызывающие такой же физиологический эффект, как и природные ауксины. Поскольку такие вещества не встречаются в растениях, их называют синтетическими аналогами ауксинов. К ним относятся 2,4-дихлорфеноксиуксусная кислота (2,4-Д), α – нафтилуксусная кислота (НУК) и др. Синтетические аналоги эффективно связываются с рецепторами ауксина, но слабо взаимодействуют с системами транспорта и окислительной деградации.
