
- •Державна фармакопея України:
- •Дфу поділяється на такі розділи:
- •VI група періодичної системи д.І. Менделєєва.
- •Карбон: (макроелемент)
- •2) Другий ступінь:
- •2% Водний розчин застосовують для промивання слизових оболонок очей, верхніх дихальних шляхів при попаданні на них кислоти.
- •5. Лп, до складу яких входить елемент ііі групи – Алюміній.
- •Mg: макроелемент.
- •Гліцерин (85 %)
- •Ідентифікація:
- •Лікарські речовини- похідні ароматичних кислот та фенолокислот
- •Кількісне визначення
- •3. Амідну групу визначають за виділенням амоніаку в результаті лужного гідролізу при кип'ятінні з зо %-ним розчином натрію гідроксиду:
- •Ідентифікація:
- •Сульфаніламідні препарати.
- •Методи кількісного аналізу.
- •Тема: Лікарські речовини – похідні ароматичних амінокислот, аміноспиртів.
- •Анестезин (Anaesthesinum) Benzocaine*
- •Ідентифікація:
- •Кількісне визначення:
- •Ідентифікація: Адреналіну тартрат.
- •3. До водного розчину субстанції додають розчин діетокситетра-гідрофурану у кислоті оцтовій льодяній і нагрівають. До охолодженого розчину додають розчин диметиламінобензальдегіду у суміші кислоти
- •Ідентифікація:
- •Ідентифікація:
- •Тема: Алкалоїди, лр – похідні алкалоїдів. Особливості їх фармацевтичного аналізу.
- •Класифікація препаратів алкалоїдів:
- •Загальноалкалоїдні осаджувальні реактиви:
- •Загальна характеристика:
- •Лр, похідні хіноліну: хінін та його солі.
- •Похідні бензилізохіноліну: папаверину гідрохлорид.
- •Ідентифікація:
- •Кількісне визначення.
- •Ідентифікація:
- •Тема: Гетероциклічні сполуки.
- •Класифікація гетероциклів:
- •Ідентифікація:
- •Кількісне визначення.
- •Кількісне визначення
- •Ідентифікація:
- •Кількісне визначення:
- •Класифікація гліцидів:
- •Кальцію глюконат:
- •Тема: Вітаміни.
- •Класифікація і номенклатура вітамінів.
- •Кількісне визначення:
- •Ідентифікація:
- •3. Нефармакопейні реакції: а) при додаванні до рибофлавіну кислоти сульфатної концентрованої з'являється червоне забарвлення, яке переходить в жовте від додавання води.
- •Кількісне визначення:
- •Тема: антибіотики.
- •Класифікація антибіотиків
- •Ідентифікація:
- •Кількісне визначення.
- •Левоміцетин (і-аеуотусеїіпит) Хлорамфенікол (снІогатрНепісоіит)*
- •Ідентифікація:
- •Кількісне визначення.
Гліцерин (85 %)
![]()
Пропан-1,2,3 -тріол
Добування. Омиленням жирів:

Властивості. Сиропоподібна, масляниста на дотик, безбарвна або майже безбарвна, прозора рідина. Дуже гігроскопічна. Змішується з водою і 96 %-ним спиртом, мало розчинний в ацетоні, практично не розчинний в ефірі, жирних і ефірних оліях.
Ідентифікація: Підтверджують за допомогою фізико-хімічних методів (показник заломлення, ІЧ-спектроскопія) та за результатами хімічних реакцій:
Субстанцію змішують з кислотою нітратною і нашаровують розчин калію дихромату; на межі двох шарів рідини утворюється блакитне кільце.
Утворення акролеїну (характерний неприємний запах), який визначають за почорнінням фільтрувального паперу, змоченого розчином калію тетрайодомеркурату лужним:


2. Зворотня алкаліметрія після ацетилування:

Кількісне визначення. Алкаліметрія після окиснення субстанції натрію перйодатом, індикатор - фенолфталеїн, s = 1 (ДФУ):
Надлишок оцтового ангідриду гідролізують, оцтову кислоту нейтралізують натрію гідроксидом за фенолфталеїном, після чого кип'ятять з певною кількістю титрованого розчину натрію гідроксиду:
![]()
Надлишок натрію гідроксиду, який не прореагував, відтитровують кислотою хлористоводневою до знебарвлення фенолфталеїну, s = 1/3.
3. Дихроматометрія, зворотне титрування, індикатор - фенілантранілова кислота, s = 3/7:
![]()
Надлишок калію дихромату відтитровують сіллю Мора:
![]()
Зберігання. У добре закупореній тарі.
Застосування. Основа для мазей і розчинів. Безводний гліцерин може викликати опіки.
Альдегіди – це клас сполук, які містять альдегідну групу.
O
R – C
H
Фізичні властивості альдегідів залежать від хімічної будови. Низькомолекулярні А – газоподібні (формальдегід). А з С 2 - С 15 – безбарвні рідини, з С 16 у молекулі – тверді речовини.
Фармакологічна дія альдегідів і спиртів схожа між собою. Наявність альдегідної групи надає речовинам наркотичних властивостей. Крім того, альдегіди як і спирти володіють антисептичною дією. На відміну від спиртової групи – альдегідна група підсилює токсичність речовин. Підвищує активність і токсичність наявність кратних зв’язків в молекулі.
Наркотичні властивості у ацетальдегіду більш виражені ніж у формальдегіду. Введення галогену в молекулу ще більш підсилює наркотичну дію, одночасно зростає і токсичність.
Утворення гідратної форми (хлоралгідрат) в значній ступені підвищує токсичність.
Мають високу реакційну здатність. Для них характерні реакції окислення, відновлення, приєднання , полімеризації. Реакції з речовинами, що містять альдегідну групу, протікають, як правило в м’ягких умовах.
Із хімічних властивостей альдегідів, що мають значення в фармацевтичному аналізі можна виділити:
1. Альдегіди здатні легко окислятися, являючись добрими відновниками:
- реакція «срібного дзеркала»:

- реакція з реактивом Фелінга, який складається з розчину сульфату
купруму та розчину сеньєтової солі:

- реакція з реактивом Несслера:
![]()
Реакції приєднання – альдегіди вступають в реакцію приєднання з Гідрогеном, гідросульфітом натрію, аміаку, фуксинсірчистою кислотою:
![]()
![]()


3. Реакції полімеризації та конденсації:
Реакція полімеризації альдегідів характеризується тим, що вони у водному розчині дають гідратну форму. В такій гідратній формі молекули альдегідів вступають між собою в реакцію, відщеплюючи воду і утворюють полімери з різною довжиною ланцюга:



Реакція конденсації характеризується тим, що декілька молекул з’єднуєтьсяться в одну молекулу, при цьому зв’язок між молекулами здійснюється через Карбон:

4. Реакції заміщення, що являють собою своєрідний тип конденсації. Найбільшу цікавість представляють реакції з гідроксил аміном, фенілгідразином, семікарбазидом:
![]()
В медичній практиці застосовують р-н формальдегіду (формалін), гексаметилентетрамін, хлоралгідрат.
Вперше формальдегід був добутий в 1868 р внаслідок пропускання повітря, насиченого парами метилового спирту над розжареною платиновою спіралю.
Синтезують ці сполуки окисленням первинних спиртів.
Окислення метанолу за методом Медвєдєва:
![]()
Формальдегід-газ з різким неприємним запахом, розчинний у воді. З водою та спиртом змішується в будь-яких співвідношеннях. Розчин формальдегіду-прозора, безбарвна рідина з різким своєрідним запахом.
Formaldehydi solutio
Formalinum
Для підтвердження тотожності можна застосувати реакції характерні для альдегідів.
Тотожність:
Реакція „срібного дзеркала”:
![]()
Реакція з саліциловою кислотою – у присутності кону. Н2 SО4 з’являється червоне забарвлення:

Ауриновий барвник
Кількісне визначення:
Йодометрія в лужному середовищі; зворотне титрування, індикатор – крохмаль, €=1/2 Мм;

![]()
Після завершення реакції окислення до реакційної суміші додають сульфатну кислоту.
![]()
Надлишок його відтворюють натрію тіосульфатом.
Зворотна алкаліметрія: після окислення гідрогеном пероксидом у лужному середовищі, інд – фод. Надлишок лугу відтитровують кислотою до знебарвлення, €= Мм;

Ацидиметрія: пряме титрування за замісником після взаємодії з натрію сульфітом, €= Мм;

Метод застосовується для кількісного визначення формальдегіду в препараті „Формідрон”.
Рефрактометрично: для розбавлення водних розчинів.
Зберігання: у добре закупорених склянках, у захищеному від світла місці, при температурі 90С (щоб запобігти полімеризації до параформу).
Застосування:
Антисептик, дезинфікуючий, дезодоруючий засіб, консервант для біологічного матеріалу. Фунгіцидні властивості застосовують для захисту насіння.
Є проти плазматичною отрутою.
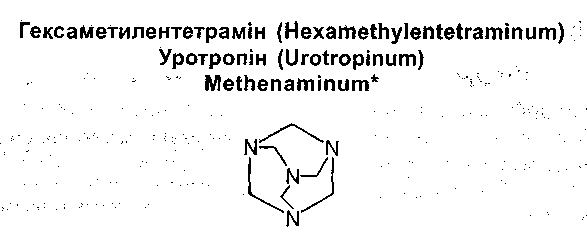
Гексаментилентетрамін (уротропін) синтезований А.М. Бутлеровим в 1860р., але медичне застосування знайшов тільки в 1895р. Це продукт консервації формальдегіду і аміаку. По хімічній будові гексаметилентетрамін може бути віднесений до гетероциклічних сполук 1, 3, 5 – триазину.
Джерелом отримання гексаметилентетраміну служить р-н формальдегіду. Його змішують з надлишком 25%-ного р-ну аміаку і упарюють у вакуумі при 40-500С:

Безбарвні кристали або білий кристалічний порошок без запаху, пекучого і солодкого, а потім гіркуватого смаку. При нагріванні випаровується, не плавиться. водні розчини мають лужну реакцію. Утворює солі з кислотами. Легкорозчинний у воді та спирті.
Тотожність: по запаху формальдегіду після кислотного гідролізу:
![]()
![]()
При наступному додаванні натрію гідроксиду виділяється амоніак:
Специфічні домішки:
Параформ і солі амонію визначають нагріванням з реактивом Несслера – не повинні з’являтися жовте забарвлення або каламуть.

Кількісне визначення:
Кислотно-основне зворотне титрування, Ind. - м.ч.
€ = 1/4Мм.

Паралельно проводять контрольний дослід.
Ацидіметрія, пряме титрування за змішуваних Ind (м.о. і метил синій),
![]()
€= Мм;

Йодохлорметрія, зворотне титрування, інд – крохмаль, €= 1/4Мм;
аргентометрія за методом Фольгарда:
€=2/3 Мм;

Зберігання: у добре закупореній тарі.
Застосування: антисептик, застосовується перорально і в/в при інфекціях сечовидільних шляхів антидот при отруєнні важкими металами.
Тема: Загальна характеристика карбонових кислот та амінокислот. ЛР – похідні карбонових кислот, амінокислот.
Загальна характеристика карбонових кислот.
Солі лимонної кислоти : натрію цитрат і натрію гідроцитрат. Добування, особливості фарманалізу, застосування в медицині.
Загальна характеристика амінокислот.
Глютамінова кислота: добування, особливості фарманалізу, застосування в медицині.
Метіонін: добування, особливості фарманалізу, застосування в медицині.
Карбонові кислоти аліфатичного ряду являють собою похідні вуглеводнів, у яких один атом Гідрогену заміщений на карбоксильну групу. Цю групу сполук можна розглядати як кінцевий продукт окислення спиртів, не пов’язаний з порушенням вуглеводневого ланцюга:
![]()
По фізичним властивостям – це рідини або тверді речовини. Низькомолекулярні карбонові кислоти добре розчинні у воді.
Хімічні властивості карбонових кислот зумовлені наявністю карбоксильної групи. В розчинах органічні кислоти дисоціюють на іони:
R – COOH → R – COO- + H+ .
Вони являються, слабкими кислотами, Константи дисоціації більшості органічних кислот знаходяться в межах 1,4 ∙ 10-5 – 1,0 ∙10-4, тобто значно нижче, ніж у неорганічних кислот. Однак константи залежать від електрофільності радикала, зв’язаного з карбоксилом.
Наприклад, ступінь дисоціації молочної кислоти вище, ніж у пропіонової, а трихлороцтова кислота в 700 раз сильніше оцтової.
З лугами органічні кислоти утворюють солі; розчинні у воді. Солі у водних розчинах дисоціюють на іони, які можна виявити різними реактивами. З солями важких металів багато органічних кислот утворюють забарвлені осади.
Одна із характерних хімічних властивостей карбонових кислот – здатність вступати із спиртами в реакції етерифікації, в результаті яких утворюються складні ефіри. По властивостям (смак, запах) вони відрізняються від відповідних кислот. З-на схема етерифікації:
O H2SO4 O + H2O
R – C + HO – CH2 – R1 → R – C
OH O - CH2 – R1
Зворотній процес називається реакцією гідролізу (омилення).
Ці хімічні властивості використовують в фарманалізі для ідентифікації і кількісного визначення препаратів карбонових кислот.
Фармакологічна дія, властива( характерна ) вуглеводням, лише в незначній ступені зберігається у відповідних органічних кислотах. Лише у великих дозах вони можуть проявляти незначну наркотичну дію. Токсичність у карбонових кислотах в порівнянні з альдегідами різко зменшується. Ведення карбоксильної групи в молекули – різко знижує токсичність. Наявність в молекулі розгалуженого аліфатичного радикала, кратного зв’язку, ведення галогену підвищує фармакологічну активність кислот. Однак більшість кислот аліфатичного ряду фармакологічно мало активні і або грають роль поживних речовин, або є носіями фармакологічно активних катіонів (катіонів заліза). Ряд низькомолекулярних аліфатичних кислот (оцтова та ін.) володіє подразнюючою і „ припікаючою” діями. Накопичуючись в крові органічні кислоти можуть викликати гемоліз. Це зумовлено дисоціацією кислот і накопиченням Гідроген – іону.
Натрію цитрат
Natrii citras
Для отримання натрію цитрату нейтралізують (до слабколужної реакції) розчин лимонної кислоти.
H2 С – СООН H2 С - СООNa
| |
НО – С – СООН + 3 Na2 СО3 → 2НО – С - СООNa +3H2 О
| |
H2 С – СООН H2 С - СООNa + 3СО2
Лимонна кислота натрію цитрат.
Для очищення від домішок натрію цитрат перекристалізовують із спирту.
Безбарвні кристали або білий кристалічний порошок солоний на смак, без запаху, вивітрюється на повітрі. H2 С - СООNa НО – С - СООNa х 2 H2 О
H2 С - СООNa
Хімічний контроль:
Тотожність:
Реакції на Na+ - з цинк ураніл ацетатом та з калій дигідрогенстибіатом
КH2 SbO4 або калій гексагідроксостибіатом
Na+ + H2 SbO4 - = NaH2 SbO4 ↓
Білий кристалічний порошок.
Реакція на цитрат – іон – після додавання розчину кальцію хлориду суміш залишається прозорою, при кип’ятінні утворюється білий осад.
H2 С - СООNa t0 H2 С - СОО-
2 HО – С – СООNa + 3СаCl 2 → [ НО –С - СОО- ] Са3 ↓ + 6 NaCl
H2 С – СООNa H2 С – СОО- 2
специфічною домішкою є солі щавлевої кислоти які відкривають дією кальцію хлоридом – розчин має залишатися прозорим.
СОО – СОО
| + Са 2+ → | › Са ↓
СОО - СОО
Кількісне визначення:
використовуючи іонообміну хроматографію в поєднанні із методом нейтралізації
Іонообмінна хроматографія ґрунтується на оборотності хемосорбції іонів досліджуваного розчину йоногенними групами сорбенту. Процес обміну іонів у системі сорбент – розчинник відбувається в стехіометричних співвідношеннях. Сорбенти, здатні до іонообмінної адсорбції, називаються йонітами. Залежно від характеру йоногенних груп їх поділяють на катіоніти та аніоніти. Іонообміна хроматографія використовує іонообмінні процеси, що відбуваються між адсорбентом та іонами електроліту в розчині, що аналізується. Стаціонарною фазою служить: катіонообміні або аніонообмінні смоли. Іони, що містяться в них здатні обмінюватися на однойменно заряджені протони. Наважку натрію цитрату розчиняють і пропускають через колонку з катіонітом КУ – 2в Н-формі. Відбувається обмін:

Далі колонку промивають і фільтрат з промивними водами, що містить еквівалентну кількість лимонної кислоти, титрують 0,05н розчином NaОН.
H2 С – СООН H2 С – СООNа
| |
НО – С – СООН + 3 NaОН → НО – С – СООNа
| |
H2 С – СООН H2 С – СООNa
Е = 1/3 М.м;
Ind = метиловий оранжевий.
Х = V ∙ N ∙ V/ a;
Аргентометрія за методом Фольгарда,
H2 С – СООNa H2 С – СООAg
| |
НО – С – СООNa + AgNО3 → НО – С – СООAg + + 3 NaNО3.
| |
H2 С – СООNa H2 С – СООAg
Е = 1/3 М х м;
Ag NО3 + NН 4 SC N → Ag SC N ↓ + NН 4 NO 3 .
FeNH 4 (SO4 ) 2 + 3 NН 4 SC N → Fe(SC N) 3 + 2(NН 4 )2SO4 .
Зберігання: у добре закупореній тарі.
Застосування: консервант донорської крові (запобігає зсіданню і створює лужний резерв крові)
Натрію H2 С – СООNa
Гідроцитрат НО – С – СООН х 1,5 H2 О.
H2 С – СООNa
Аналізують і застосовують аналогічно натрію цитрату.
ЛР – похідні амінокислот аліфатичного ряду.
Амінокислоти – похідні карбонових кислот, що містять в молекулі одну або декілька аміногруп. α – амінокислоти є структурними елементами білків і широко розповсюджені в природі. Із білкових гідролізатів отримано близько 20 α – амінокислот загальної формули:
СООН
|
СН - NН 2
|
R
Природні амінокислоти можна отримати гідролізом білків в середовищі HCl або H2SO4 при нагріванні. Джерелом білків є м’ясо, шкіра, желатин, шерсть, волос, перо, казеїн із творога та інше. Всі природні амінокислоти містять в молекулі асиметричний атом карбону, що зумовлює існування оптичних ізомерів.
Важливе значення мають синтетичні методи отримання амінокислот і особливо їх аналогів.
Вихідними продуктами синтезу можуть служити α – галоген заміщенні карбонові кислоти, аміномалоновий ефір, оксопохідні ароматичних і гетероциклічних сполук, оксими, гідразони. Використовують також способи перетворення однієї амінокислоти в другу або отримання із амінокислот різних синтетичних похідних.
Амінокислоти аліфатичного ряду є білі кристалічні речовини, як правило, розчинні в воді і нерозчинні в органічних розчинниках. В зв’язку наявності в молекулі кислотної (карбоксильної) і основної (аміно) груп вони існують в водних розчинах в виді биполярних іонів NH3RCOO. Наявність в молекулі карбоксильної та аміногрупи зумовлює хімічні властивості амінокислот. Вони вступають в реакції етерифікації (по карбоксильній групі), алкілування, ацилювання (по аміногрупі), можуть відновлюватися, декарбоксилюватися, утворювати пептиди.
Для ідентифікації амінокислот використовують їх здатність до утворення внутрішньо комплексних сполук з різними катіонами (срібла, міді, ртуті, Pb, Zn, Cо та інші). Найбільш характерна для амінокислот реакція з Сu2+ , в результаті реакції утворюється комплексна сполука темно-синього кольору. Це характерно для α – амінокислот.

β – амінокислоти із Сu (ІІ) – утворюють забарвлені але нестійкі комплекси.
γ - амінокислоти із Сu (ІІ) в реакцію не вступають
Для виявлення амінокислот застосовують високочутливу реакцію – нінгідринова проба, яка дає змогу відрізняти амінокислоти від пептидів, білків. Вона протікає при одночасній участі аміно і карбоксильної групи.
Усі амінокислоти утворюють синьо-фіолетове забарвлення при нагріванні з нінгідрином:

Групу амінокислот, що містять в молекулу один або два атоми сірки (цистин, цистеїн, метіонін) додатково досліджують на наявність тіогрупи або тіометильної групи. В якості реактива використовують нітропрусид натрію, Fe(Cl) 3 , NaNO2
Кількісне визначення амінокислот:
Метод К’єльдаля – визначення N в органічних сполуках. Речовину мінералізують кип’ятінням у спеціальному приладі, в присутності K2SO4, CuSO4 , і конц. Н2SO4 .
НООС - СН2 - СН2 – СН – СООН[O] t0 CO2↑ + H2O + NH4HSO4
| →
NH2 H2SO4
Потім додають розчин NаОH 30%
t0
NH 4HSO 4 + 2NaOH → NH 3 ↑ + 2H 2 O + Na2SO4
Амоніак, що виділяється, відганяють у колбу – приймач, що містить розчин борної кислоти.
Утворюються амонію мета і тетраборати, які відтитровують розчином НСІ за змішаним індикатором ( м.червоного і м.синього у співвідношенні 2:1).
NH 3 + H3BO3 → NH4BO2 + H2O
2NH3 + 4H3 BO3 → (NH4) 2B4O7+ 5H2O
NH4BO2 + HCl + H2O →NH 4Cl + H 3BO 3
(NH4) 2B4O7 + 5H2O + 2HCl →2NH 4Cl + 4H 3BO 3
Е.м. залежить від кількості атомів Нітрогену в речовині.
2. Алкаліметрія за методом Серенсена:
титрування вільних α - амінокислот лугом ускладнене, оскільки вони існують у вигляді внутрішніх солей, тому до розчину амінокислоти додають нейтралізований за ф – ф формалін. При цьому утворюється N – метиленова похідна, а звільнена карбоксильна група може бути відтитрована NaOH:
O
R – CH – COO + H - C → R – CH - COOH + H 2O
+NH 3 H N - CH 2
R – CH – COOH + NaOH → R – CH – COONa + H 2 O.
N =CH 2 N = CH 2
Е.м. залежить від кількості карбоксильних груп у молекулі речовини.
3. Кислотно – основне титрування в неводному і водному середовищі та мішаних розчинниках (спирт – вода, ацетон – вода).
4. Редокс – методи для сульфуровмісних амінокислот (йодометрія, йодохлорметрія).
Застосування амінокислот в медицині базується на їх здатності приймати участь в азотистому обміні, в синтезі необхідних для нормальної функції організма білків, пептидів, ферментів, гормонів; в утворенні кінцевих продуктів азотистого обміну: аміаку, сечовини та в інших життєво важливих процесах.
Кислота глутамінова (Acidum glutamicum) (ДФУ)
![]()
(S)-2-амінопентан-1,5-дикарбонова кислота
Глутамінова кислота входить до складу ряду білкових речовин: міозину, казеїну, ос-лактоглобуліну та ін., у великій кількості міститься в білках мозку, злаках.
Добування. Кислоту глутамінову одержують гідролізом білкових речовин або синтетично. Вихідними речовинами для синтезу є акрилонітрил та ацетиламіномалоновий ефір:

Властивості. Кристалічний порошок білого кольору або безбарвні кристали. Легко розчинний в киплячій воді, мало розчинний у холодній воді, практично не розчинний в кислоті оцтовій, ацетоні, 96 % спирті і ефірі.
