
- •Державна фармакопея України:
- •Дфу поділяється на такі розділи:
- •VI група періодичної системи д.І. Менделєєва.
- •Карбон: (макроелемент)
- •2) Другий ступінь:
- •2% Водний розчин застосовують для промивання слизових оболонок очей, верхніх дихальних шляхів при попаданні на них кислоти.
- •5. Лп, до складу яких входить елемент ііі групи – Алюміній.
- •Mg: макроелемент.
- •Гліцерин (85 %)
- •Ідентифікація:
- •Лікарські речовини- похідні ароматичних кислот та фенолокислот
- •Кількісне визначення
- •3. Амідну групу визначають за виділенням амоніаку в результаті лужного гідролізу при кип'ятінні з зо %-ним розчином натрію гідроксиду:
- •Ідентифікація:
- •Сульфаніламідні препарати.
- •Методи кількісного аналізу.
- •Тема: Лікарські речовини – похідні ароматичних амінокислот, аміноспиртів.
- •Анестезин (Anaesthesinum) Benzocaine*
- •Ідентифікація:
- •Кількісне визначення:
- •Ідентифікація: Адреналіну тартрат.
- •3. До водного розчину субстанції додають розчин діетокситетра-гідрофурану у кислоті оцтовій льодяній і нагрівають. До охолодженого розчину додають розчин диметиламінобензальдегіду у суміші кислоти
- •Ідентифікація:
- •Ідентифікація:
- •Тема: Алкалоїди, лр – похідні алкалоїдів. Особливості їх фармацевтичного аналізу.
- •Класифікація препаратів алкалоїдів:
- •Загальноалкалоїдні осаджувальні реактиви:
- •Загальна характеристика:
- •Лр, похідні хіноліну: хінін та його солі.
- •Похідні бензилізохіноліну: папаверину гідрохлорид.
- •Ідентифікація:
- •Кількісне визначення.
- •Ідентифікація:
- •Тема: Гетероциклічні сполуки.
- •Класифікація гетероциклів:
- •Ідентифікація:
- •Кількісне визначення.
- •Кількісне визначення
- •Ідентифікація:
- •Кількісне визначення:
- •Класифікація гліцидів:
- •Кальцію глюконат:
- •Тема: Вітаміни.
- •Класифікація і номенклатура вітамінів.
- •Кількісне визначення:
- •Ідентифікація:
- •3. Нефармакопейні реакції: а) при додаванні до рибофлавіну кислоти сульфатної концентрованої з'являється червоне забарвлення, яке переходить в жовте від додавання води.
- •Кількісне визначення:
- •Тема: антибіотики.
- •Класифікація антибіотиків
- •Ідентифікація:
- •Кількісне визначення.
- •Левоміцетин (і-аеуотусеїіпит) Хлорамфенікол (снІогатрНепісоіит)*
- •Ідентифікація:
- •Кількісне визначення.
2) Другий ступінь:
![]()

Дослідження на тотожність і кількісне визначення карбонатів і гідрокарбонатів базується на хімічній реакції розкладання мінеральної кислоти:
Цей процес лежить в основі антацидної (нейтралізуючої кислоти) дії натрію гідрокарбонату. Важливо вміти в умовах аптек швидко відрізнити NaHCO3 від Na2CO3 , враховуючи подібність у фізичних і хімічних їх властивостях. Найбільш просто це встановлюється при додаванні індикатора фенолфталеїну до розчину солі. При цьому 0,1н р-ни карбонатів набудуть червоного кольору, а аналогічний розчин натрію гідрокарбонату залишається безбарвним або стає слабко – рожевим.
![]()
Натрію гідрокарбонат був відкритий в 1801р. В.Розе отримують його при насиченні очищеного кристалічного карбонату натрію діоксидом карбону:
Натрію карбонат (Natrii hydrocarbonatis) NaHCO3
Властивості: Білий кристалічний порошок без запаху, солонкувато – лужний на смак, стійкий у сухому повітрі, повільно розкладається у вологому. Розчинний у воді, практично нерозчинний у 95% спирті. Водні розчини мають лужну реакцію.
![]()
Здобування: метод Сольве (амоніачним):
Тотожність:
На іони Na+
а) забарвлення у жовтий колір
![]()
б) специфічна фармакопейна реакція з цинк – ураніл ацетатом:
2. На іони HCO3 -
а) при додаванні розчину кислоти до натрію гідрокарбонату виділяються бульбашки газу.
![]()
![]()
Б) HCO3 - при взаємодії з насиченим розчином утворює білий осад, на відміну від карбонату, тільки при кип’ятінні.
Кількісне визначення: Ацидиметрія, пряме титрування, індикатор – метиловий оранжевий, Е = Мм.
NaHCO3 +HCl →NaCl + CO2 + H2 O.
Використання: в якості антацидного засобу при підвищеній кислотності шлункового соку. Однак при його нейтралізації надлишкової кислотності проходить виділення вуглекислоти (СО2 ), яка викликає збуджуючу дію на рецептори слизової шлунка і викликає вторинне посилення секреції.
Враховуючи це NaHCO3 часто призначають з обволікаючими препаратами, які зменшують його побічну дію.
Також застосовують внутрішньо у вигляді порошку, мікстури, як відхаркуюче. У вигляді 0,5 – 2% розчину застосовують для полоскань інгаляцій.
2% Водний розчин застосовують для промивання слизових оболонок очей, верхніх дихальних шляхів при попаданні на них кислоти.
Випускають препарат в порошку, таблетках і розчинах.
Зберігати : в сухому , прохолодному місці, в добре закупореній тарі.
Тема: ІІІ група періодичної системи
Загальна характеристика групи.
Біологічна роль елементів ІІІ групи головної підгрупи.
Сполуки бору. Борна кислота. Використання реакцій
комплексоноутворення під час аналізу борної кислоти.
Натрію тетраборат: добування , реакції ідентифікації та методи
кількісного визначення натрію тетраборату.
5. Лп, до складу яких входить елемент ііі групи – Алюміній.
До ІІІ групи головної підгрупи періодичної системи Д.І.Менделєєва належить п’ять елементів: бор, алюміній, галій, індій, талій. Елементи групи характеризуються наявністю 3 електронів у зовнішній оболонці атома. З ростом атомної ваги наростають металічні властивості елементів. У бору переважно неметалічні властивості, гідроксиди алюмінію, галію та індію амфотерні, а оксиди тривалентного талію мають виключно основний характер. З ростом атомної ваги посилюється також насиченість сполук елементів ІІІ групи і тому препарат талію належить до отрут. Всі ці елементи тривалентні, проте талій утворює тривкі одновалентні сполуки. Із елементів ІІІ групи:
Бор у природі існує в сполуках: бура(Na2B4O7 х 10 H2O), (H3 BO3 ), (2МgO х
В2О3 х 3 H2O) та інші. Розчинні сполуки бору присутні в ґрунті та питній воді, звідки вони потрапляють в організм, рослин, тварин і людини. Він є спадковим елементом зелених рослин, вміст якого від 55 до 750мкг на 100г маси. Багаті на бор зернобобові (180 – 750мкг на 100г) та овочеві культури (115 – 200мкг на 100г).
Біологічна роль не з’ясована. Вплив на теплокровних негативний. Бор оксид (В2О3 ) належить до сильнодіючих політропних токсичних речовин, які негативно впливають на роботу печінки, статеву активність, органи дихання, отруюють ембріони. У разі проникнення через шкіру ортоборна кислота H2BO3 та натрій тетраборат Na2B4O7 х 10 H2O можуть спричинити смерть.
В організм людини Бор потрапляє з питною водою та продуктами харчування. У разі випадкового потрапляння ортоборної кислоти й розчинних боратів в організмі відбувається швидке й повне всмоктування їх у шлунку та кишечнику. У крові бор рівномірно розподіляється між еритроцитами і плазмою , а згодом – між тканинами. Близько 10% введеної дози бору розміщується в мозку, печінці й жировій тканині. У мозку Бор після отруєння залишається кілька днів. Основним депо Бору стають кістки, де накопичується майже 86% від дози, що потрапляє в організм. Введення сполук Бору відбувається через ШКТ, ортоборної через нирки.
Нормальний вміст В 3+ в крові – 0,8 мг/л, в сечі 0,715мг/л.
Al – алюміній.
У зеленій корі по поширенню займає третє місце після оксигену (8,8%). Міститься в ґрунті, в питній воді (від 2,5 – 121 мкг/л).
Біологічна рольAl в малих концентраціях загально відома: бере участь в утворенні фосфатних протеїнових комплексів, у побудові епітеліальної та сполучної тканини. Al входить до складу оболонки нервових клітин головного мозку, де виконує опорну функцію. Відомо, що за 70 років життя вміст Al в легеневому епітелії зростає в 10 разів тільки за рахунок металу атмосфери.
Віє необхідним мікроелементом, який впливає на активність ряду ферментів, зокрема надлишок його в організмі викликає зниження активності лактатдегідрогенази. Остання бере активну участь у процесі анаеробного гліколізу в скелетних і серцевих м’язах. Надлишок спричинює зниження активності ферментів каталази церулоплазміну, вугільної ангідрази.
В організмі людини масою 70 кг міститься 50-140 мг ( 0,05 – 0,14 г): трубчасті кістки, серце, м’язи, легені, волосся. AІ виводиться через нирки. Al входить до складу таких продуктів: пшениця, жито, ячмінь, просо, горох, пшоно, капуста, картопля, огірки, яблука, цибуля, мед. Добова потреба Al 35 – 45 мг. Загальний вміст Al в добовому змішаному раціоні становить 80 мг.
Вперше вільний бор був отриманий у 1808 р. Французьким хіміком Гей Люссаком. Це доволі поширений елемент, відомо близько 90 борвмісних мінералів. Сполуки бору давно застосовуються у багатьох галузях народного господарства. Вони використовуються для виготовлення оптичного та хімічно стійкого скла. У медицині сполуки бору знаходять застосування у вигляді борної кислот та бури, що мають дезинфікуючі властивості.
Основний промисловий спосіб добування борної кислоти:
2МgO В2О3 H2 O + 2H2 SO4 →2Mg SO4 + 2H 3 BO 3
Розділити суміш можна перегонкою борної кислоти при температурі 400 – 5000С.
ЛП кислоти борної можна отримати розкладанням бури або борокальциту гарячим розчином соляної кислоти:
Na2 B4 O7 10 H2 O+ 2HCl →4H3 BO3 + 2 NaCl + 5 H2 O
CaB 4O 7 4 H2 O + 2HCl + H2 O → 4H3 BO3 + CaCO3
Фільтрат охолоджують і виділені кристали кислоти борної перекристалізовують з води.
– кислота борна:
Acidum boricum

Представляє собою жирні на дотик, безбарвні. Прозорі лусочки або дрібний білий кристалічний порошок без запаху. У холодній воді розчиняється погано, у гарячій – добре. Розчинна у спирті, і повільно – в гліцерині. При тривалому нагріванні до 1000С борна кислота втрачає частину води і переходить в метаборну кислоту:
При більш сильному нагріванні борна кислота перетворюється в тетраборну кислоту H2B4O7, і на кінець, проходячи стадію скловидної плавленої маси утворюється оксид бору (ІІІ):
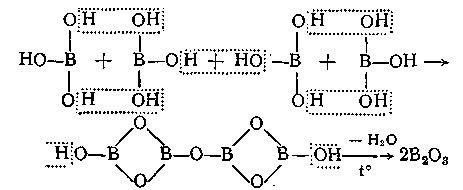
Водні розчини борної кислоти мають слабко кислу реакцію.
Тотожність: можна встановити по реакції утворення борноетилового ефіру, який горить полум’ям із зеленим окрайком.
ОС 2 Н 5
H3 BO3 + 3С 2 Н 5 ОН →3 H2 O +В - ОС 2 Н 5
ОС 2 Н 5
Найбільш частіше препарати бору ідентифікують за допомогою куркумового папірця, який після змочування розчином препарату і HCl забарвлюється в рожевий або бурувато – червоний колір, що переходить після обробки розчином аміаку в зеленувато – чорний.

Кількісне визначення: використовують кислотні властивості розчинів борної.
Борна кислота являється дуже слабкою кислотою ( К1 =6-10-10 ).
Цікаво відмітити, що при дії лугів на борну кислоту утворюються солі не ортоборної кислоти H3BO3, а тетраборної Н2B4O7 і в кінечному рахунку солі метаборної кислоти НBO2, тому при прямому титруванні кислоти борної лугом утворюється метаборат натрію, який у водних розчинах сильно гідролізує:
H3 BO3 + NaOH → + 2H2O + NaBO2
NaBO2 + 2H2O → + NaOH + H3 BO3
В результаті лужна реакція настає раніше, чим буде відтитрована кислота борна. Таким шляхом досягнути необхідної точності визначення неможливо. (Середовище стає лужним раніше, ніж настає т.е.)
Тому для кількісного визначення використовують здатність кислоти борної утворювати одноосновну комплексну кислоту з гліцерином, тобто гліцерин підсилює кислотні властивості кислоти. А так, як дигліцеринборна кислота являється сильним електролітом, її можна з високою точністю відтитрувати лугом, використовуючи в якості індикатора – фенолфталеїн:

Отримана сіль може підлягати гідролізу, внаслідок чого середовище стає лужним і тому точка еквівалентності настає раніше чим повинно бути. Враховуючи це в титруючу суміш в кінець титрування додають ще гліцерин. Якщо при цьому рожеве забарвлення не зникає, це говорить про те, що забарвлення викликане надлишком лугу, а не гідролізу. Якщо забарвлення зникає слід ще додати гліцерину і продовжити титрування.
При кількісному визначенні борної кислоти слід брати воду та луг вільні від вуглекислого газу, так як СО2 може вплинути на зміну забарвлення фенолфтолеїну.
Титрування борної кислоти лугом можна проводити в присутності інших багатоатомних спиртів і цукрів, наприклад: манніта, сорбіта, інвертного цукру. Встановлено, що титрування борної кислоти в присутності манніту (рекомендує ДФУ) відбувається краще чим в присутності гліцерину, так, як маннітоборний комплекс являється більш сильною кислотою ніж боро –гліцериновий комплекс і легше можна замітити кінець титрування.
Е = М х м;
х = V x k x T x 100|a
Зберігання: у добре закупореній тарі.
Застосування: антисептик, зовнішньо – у вигляді водних розчинів (2 – 4%) для полоскання рота, горла, промивання очей, а також у вигляді мазі (5 – 10%) та в присипках при захворюванні шкіри і як дезодоруючий засіб.
Натрію тетраборат (бура): Na2B4O7 x 10 H2О
Borax
Являє собою безбарвні прозорі кристали, які легко вивітрюються, або білий кристалічний порошок. Розчинений у воді, дуже легкорозчинний у киплячій, нерозчинний у спирті, легкорозчинний у гліцерині.
Водні розчини солонкувато – лужні за смаком і мають лужну реакцію. Реакція гліцеринових розчинів кисла.
У природі тетраборат натрію зустрічається у вільному стані у вигляді мінерала тинкала.
Здобування: На борокальцит діють гарячим розчином соди:
CaB4O7 + Na2СO3 → Na2BO7 + CaCО 3 ↓
Кальцію карбонат відфільтровують і з холодного розчину викристалізовують натрію тетраборат.
Або: 4H3 BO3 + NaСO3 → Na2B4O7 +CO2 ↑+ 6 H2O
Тотожність: реакції на Na+
Бура дає всі реакції характерні для борної кислоти. На відміну від неї забарвлює полум’я у жовтий колір.
Бура не повинна містити домішок, хлоридів, сульфатів, заліза не повинні перевищувати фармакопейні норми.
Кількісне визначення: бури проводиться методом нейтралізації, титрують 0,1Н розчином соляної кислоти по метиловому оранжевому Е = 1/2Мм;
Na 2 B 4 O 7 + 2HCl + 5 H2O → 4H3 BO3 + 2NaCl; (ацидиметрія)
Алкаліметрія гліцеринових розчинів або маннітових розчинів (див. борну к-ту Е = 1/2Мм)
Зберігають: у добре закупорених банках, у прохолодному місці, щоб виключити вивітрювання води.
Застосування: як антисептик у вигляді 1 – 2% розчинів. Іноді перорально при лікуванні епілепсії.
В медицині застосовують препарати алюмінію, які проявляють в’яжучу, обволікаючу, адсорбуючу дії.
Це алюмінію гідроксид:АІ(ОН)3
Глина біла:AI2O3∙2SiO2∙2H2O.
Елементи ІІ групи періодичної системи Д.І.Менделєєва
План.
Загальна характеристика ІІ групи елементів.
Поширення у природі елементів ІІ групи та їх біологічна роль.
ЛР, що містять Mg2+ : магнію оксид, магнію сульфат (джерела їх
отримання; особливості аналізу цих n-тів; застосування в медицині).
ЛР, що містять Са2+ : кальцію хлорид (джерела ї отримання; особливості
аналізу ; застосування в медицині).
ЛР, що містять Ва2+ : барію сульфат (джерела отримання; особливості
аналізу ; застосування в медицині).
ЛР, що містять цинк: цинку оксид, цинку сульфат (джерела їх
отримання; особливості аналізу цих n-тів; застосування в медицині).
В медичній практиці знаходять застосування сполуки, до складу яких входять елементи як головної групи (Mg2+ ; Са2+ ; Ва2+ ); так і побічної підгрупи (Zn 2+ ; Hg 2+ ) ІІ групи періодичної системи Д.І.Менделєєва.
В ІІ групу головну підгрупу належать типові s- елементи Be і Mg; їх електронні аналоги - Cа, Sr, Ba – об’єднують під загальною назвою лужноземельні елементи. Ця назва пов’язана із прийнятим ще за часів алхіміків звичаєм називати усі малорозчинні у воді сполуки „землями”, а елементи – лужноземельними. У атомів елементів ІІ групи головної підгрупи на зовнішньому енергетичному рівні міститься два спарених s – електрони. У не збудженому стані атоми виявляють нульову валентність. Для утворення двох ковалентних зв’язків необхідно перевести атом у збуджений стан. Тому молекули є лінійними, оскільки атомні орбіталі елементів знаходяться у стані sр – гібридизації. При цьому елементи виявляють ступінь окислення +2. у вільному стані елемент ІІ групи головної підгрупи – сріблясто білі, легкі метали; значно твердіші за лужні. На повітрі Са, Sr, Ba швидко вкриваються плівкою з оксидів і карбонатів, а при тривалому зберіганні руйнуються. Зберігають лужні метали під шаром гасу. Ці метали – сильні відновники, досить легко реагують з більшістю неметалів, при нагріванні усі лужноземельні метали згоряють на повітрі з утворенням оксидів: 2Є + О2 =2ЄО
Метали цієї групи з азотом взаємодіють при нагріванні, утворюють нітриди:
3Є + N2 = Є3 N2
з водою Ве практично не взаємодіє, магній повільно розчиняється у киплячій воді, а інші метали інтенсивно розкладають воду:
Є + Н 2 О = Є(ОН) 2 +Н 2 ↑
До ІІ групи побічної підгрупи належать Zn, Cd, Hg. Усі елементи підгрупи цинку є електронними аналогами та останніми d – елементами відповідних періодів. На зовнішньому рівні містять по 2s – електрони, як і елементи головної підгрупи. Однак елементи ІІ групи побічної підгрупи мало схожі на лужноземельні метали. Це зумовлено наявністю у них на передостанньому рівні десяти d – електронів, які відсутні у елементів головної підгрупи. Вони мають меншу відновну властивість у порівнянні з лужноземельними Мe. Виявляють у сполуках ступінь окислення +2, а Меркурій може утворювати сполуки із ступенем окислення -1. Zn i Cd – сріблясто – білі метали, ртуть – єдиний рідкий за звичайних умов метал. На відміну від лужноземельних елементів, за величинами густини Zn, Cd i Hg є важкими металами. На повітрі метали ІІ групи побічної підгрупи втрачають блиск внаслідок утворення на їх поверхні оксидної плівки.
