
- •Державна фармакопея України:
- •Дфу поділяється на такі розділи:
- •VI група періодичної системи д.І. Менделєєва.
- •Карбон: (макроелемент)
- •2) Другий ступінь:
- •2% Водний розчин застосовують для промивання слизових оболонок очей, верхніх дихальних шляхів при попаданні на них кислоти.
- •5. Лп, до складу яких входить елемент ііі групи – Алюміній.
- •Mg: макроелемент.
- •Гліцерин (85 %)
- •Ідентифікація:
- •Лікарські речовини- похідні ароматичних кислот та фенолокислот
- •Кількісне визначення
- •3. Амідну групу визначають за виділенням амоніаку в результаті лужного гідролізу при кип'ятінні з зо %-ним розчином натрію гідроксиду:
- •Ідентифікація:
- •Сульфаніламідні препарати.
- •Методи кількісного аналізу.
- •Тема: Лікарські речовини – похідні ароматичних амінокислот, аміноспиртів.
- •Анестезин (Anaesthesinum) Benzocaine*
- •Ідентифікація:
- •Кількісне визначення:
- •Ідентифікація: Адреналіну тартрат.
- •3. До водного розчину субстанції додають розчин діетокситетра-гідрофурану у кислоті оцтовій льодяній і нагрівають. До охолодженого розчину додають розчин диметиламінобензальдегіду у суміші кислоти
- •Ідентифікація:
- •Ідентифікація:
- •Тема: Алкалоїди, лр – похідні алкалоїдів. Особливості їх фармацевтичного аналізу.
- •Класифікація препаратів алкалоїдів:
- •Загальноалкалоїдні осаджувальні реактиви:
- •Загальна характеристика:
- •Лр, похідні хіноліну: хінін та його солі.
- •Похідні бензилізохіноліну: папаверину гідрохлорид.
- •Ідентифікація:
- •Кількісне визначення.
- •Ідентифікація:
- •Тема: Гетероциклічні сполуки.
- •Класифікація гетероциклів:
- •Ідентифікація:
- •Кількісне визначення.
- •Кількісне визначення
- •Ідентифікація:
- •Кількісне визначення:
- •Класифікація гліцидів:
- •Кальцію глюконат:
- •Тема: Вітаміни.
- •Класифікація і номенклатура вітамінів.
- •Кількісне визначення:
- •Ідентифікація:
- •3. Нефармакопейні реакції: а) при додаванні до рибофлавіну кислоти сульфатної концентрованої з'являється червоне забарвлення, яке переходить в жовте від додавання води.
- •Кількісне визначення:
- •Тема: антибіотики.
- •Класифікація антибіотиків
- •Ідентифікація:
- •Кількісне визначення.
- •Левоміцетин (і-аеуотусеїіпит) Хлорамфенікол (снІогатрНепісоіит)*
- •Ідентифікація:
- •Кількісне визначення.
3. Амідну групу визначають за виділенням амоніаку в результаті лужного гідролізу при кип'ятінні з зо %-ним розчином натрію гідроксиду:
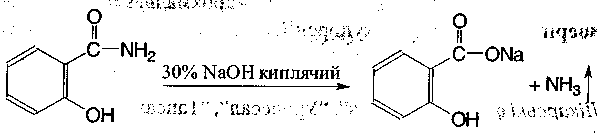
Кількісне визначення. Модифікований метод К'єльдаля.
Лікарську речовину гідролізують лугом. Амоніак, який виділився, відганяють у приймач з кислотою борною і суміш амонію мета- і тетра-боратів відтитровують розчином кислоти хлористоводневої:
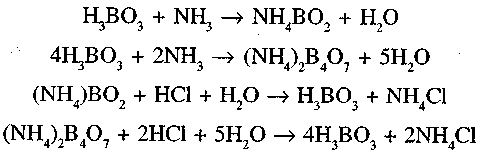
Паралельно проводять контрольний дослід.
Зберігання. У добре закупореній тарі, у захищеному від світла місці.
Застосування. Болезаспокійливий, жарознижуючий засіб. Для зменшення побічних явищ лікарський засіб приймають після їжі, запиваючи великою кількістю води.
Входить до складу свічок "Цефекон".
Оксафенамід (Oxaphenamidum) Osalmid*
Добування. Здійснюють за такою схемою:

Властивості. Білий, іноді з лілово-сірим відтінком порошок без запаху. Практично не розчинний у воді, легко розчинний у 95 %-ному спирті і розчинах лугів, важко розчинний в ефірі.
Ідентифікація:
1. Проводять кислотний гідроліз:
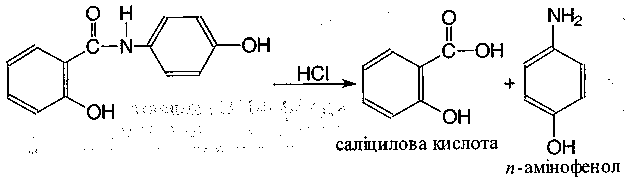
Далі для визначення и-амінофенолу створюють лужне середовище і додають резорцин - з'являється червоно-фіолетове забарвлення:
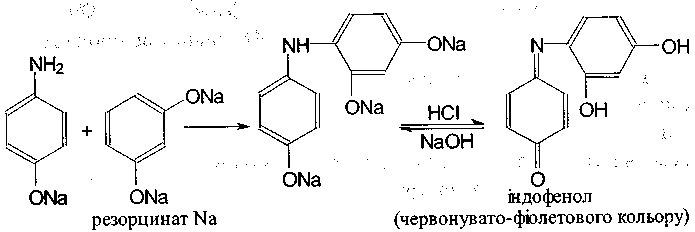
У процесі реакції утворюється натрію індофенолят синього кольору, який окиснюється киснем повітря до індофенолу червоного кольору.
2. Спиртовий розчин оксафенаміду забарвлюється в червоно-фіолетовий колір від додавання розчину феруму (III) хлориду.
Кількісне визначення. Визначення азоту в органічних сполуках (метод К'єльдаля) (див. мепротан).
Зберігання. У добре закупореній тарі, у захищеному від світла місці.
Застосування. Жовчогіний засіб. Посилює утворення і виділення жовчі, має спазмолітичну дію і знімає або зменшує спазм жовчовивідних шляхів.
Сульфаніламідні препарати.
Сульфаніламіди
знайшли застосування в медицині як
специфічні ЛЗ, що застосовуються при
захворюваннях, викликаних різними
видами коків (стрепто -, менінго -, гонококи
та інші). Сульфанілова кислота не
лікарська речовина, але її амід є вже
фармацевтичним препаратом і служить
джерелом для отримання великої кількості
ЛП, об’єднаних по своїй хімічній будові
і характеру лікувальної дії в одну
велику групу сульфаніламідних препаратів
загальна формула яких:
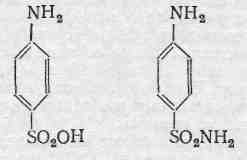
Поява сульфаніламідних препаратів відноситься до 30 – х років ХХ століття. Історія їх відкриття пов’язана з текстильною промисловістю. В пошуках кращих барвників для тканин Гельмо в 1908 році синтезував «Білий стрептоцид», що отримав широке застосування в барвній промисловості як основа для утворення різних азобарвників, і лише через 27 років були виявлені його лікувальні властивості Угорським вченим Домагком, який дослідив на мишах дію пронтозила (барвник отриманий із аміду – сульфанілової кислоти. Всі миші, які отримали попередньо по 10 летальних доз культури гемолітичного стрептококу, після введення пронтозилу залишились живими, а контрольні загинули). Роботи Домагка поклали початок дослідженням дії похідних аміда сульфанілової кислоти.
Всі препарати із групи сульфаніламідних похідних діють на певні види бактерій, але у кожного окремого препарату є свої характерні особливості зумовлені його фізико – хімічними властивостями. Наприклад, підвищення розчинності препарату впливає на швидкість всмоктування і відповідно підсилює його дію. Сульфаніламідні препарати – амфотерні препарати тому, що можуть утворювати солі як із кислотами так і з лугами, про те кислотні властивості виражені більш сильніше – це зумовлено наявністю молекули у групі – SO2-NH-, яка містить рухомий атом водню.
![]()
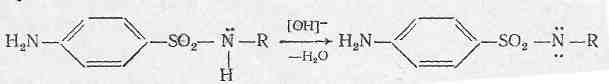
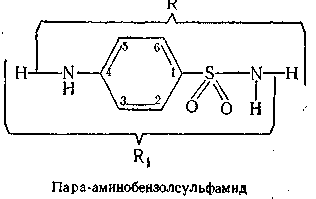
На даній схемі наочно показана хімічна структура сульфаніламідних препаратів
В наведеній загальній схематичній формулі сульфаніламідів літерами R і R1 позначені радикали які використовують для скороченого написання формул окремих представників сульфаніламідів.
Сульфаніламіди з залишками, які замінюють один атом водню в сульфамідній групі.

Сульфаніламіди з залишками, які замінюють один атом водню в аміногрупі (у С1) і один атом водню в сульфамідній групі(у С4).
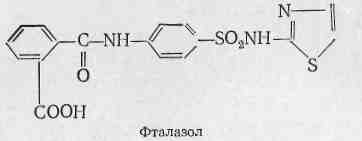
Теорія, що пояснює дію сульфаніламідних препаратів була відкрита англійським вченим Вудсом в 1940 році і названа теорія конкурентної боротьби. Було вияснено, що патогенні мікроорганізми не можуть розвиватися за відсутності пара – аміно бензойної кислоти, що є обов’язковою складовою частини ферментативного комплексу, при наявності якого розвиваються, ростуть та розмножуються мікроорганізми. Досліди показали, що сульфаніламідні похідні введені в субстрат з розвиваючимися мікроорганізмами, витісняють пара – аміно бензойну кислоту із названого комплексу і стають на її місце, при цьому розвиток бактерій зупиняється і вони гинуть. Тобто сульфаніламідні препарати є логічними біологічними антагоністами пара - амінобензойної кислоти.
Співставлення формул і властивостей сульфанілової кислоти (І) і пара – амінобензойної кислоти (ІІ) показує, що в них дуже близькі розміри молекул (в ангстремах; один ангстрем = 0,1 мілімікрона.), розподілення зарядів, константа дисоціації і т.д.
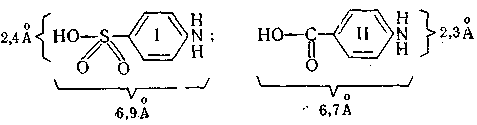
Встановлено, що для погашення діяльності пара – амінобензойної кислоти необхідно вводити сульфаніламідні препарати в надлишку. Цікаво відмітити, що додавання пара – амінобензойної кислоти в середовище в якому ростуть мікроорганізми зупиняють дію сульфаніламідів. Як показало дослідження, одна молекула пара – амінобензойної кислоти затримую дію 3330 молекул сульфаніламідів, цим і пояснюються їх великі терапевтичні дози.
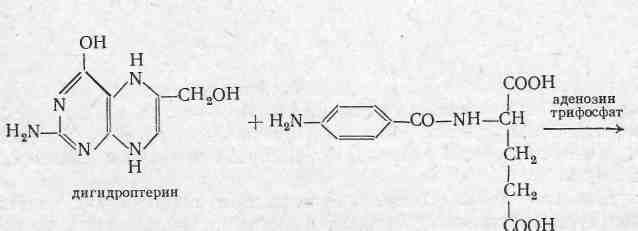
Хімізм порушення біосинтезу дигідрофолівоєвої кислоти (необхідна для нормальної життєдіяльності та росту бактерій; синтезується в мікробній клітині із ПАБ, глютамінової кислоти і дигідроптерину) сульфаніламідами наочно видна із слідуючої схеми (Г.Н.Першин).
Нормальна біосинтетична реакція:
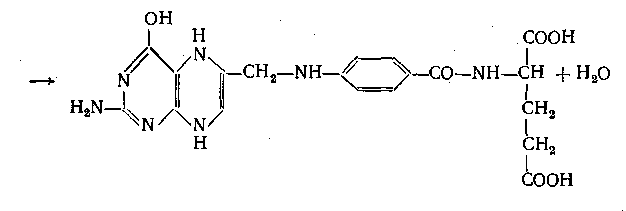
Конкурентна реакція, що призводить до зв’язування дігідроптерина:
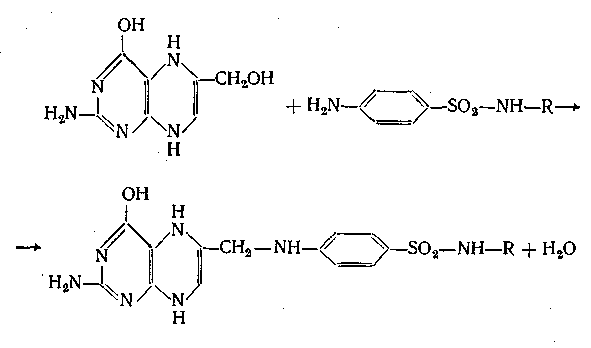
Фізичні властивості. Всі сульфаніламідні препарати являють собою кристалічні порошки білого чи злегка жовтуватого кольору, без запаху. Їх кислотні форми погано розчинні у воді, але добре розчинні в деяких органічних розчинах – спирті, ацетоні. Кожен препарат володіє характерною температурою плавлення. Натрієві солі сульфаніламідів добре розчинні у воді і нерозчинні в органічних сполуках.
Випробовування на тотожність
Для дослідження тотожності сульфаніламідів використовують як загальні реакції так як і реакції, зумовлені наявністю тих чи інших функціональних груп, тобто часні.
Реакція утворення азобарвника:
це загальна реакція не тільки на сульфаніламіди, але й на всі сполуки, що містять молекули із не заміщеною первиною ароматичною аміногрупою. Хімізм реакції базується на утворенні хлориду діазонію внаслідок дії розчином нітриту натрію і розведеною хлористоводневою кислотою. Подальше сполучення хлориду діазонію з фенолами приводить до утворення азобарвника.
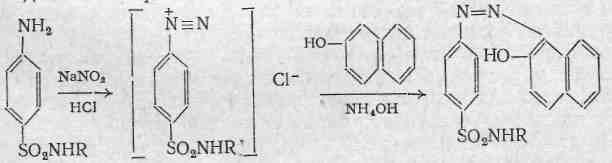
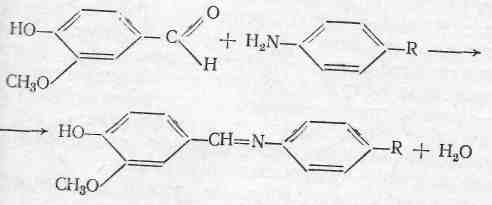
Лігнінова проба
ця реакцію є своєрідною різновидністю реакції утворенню шиффових основ. Вона використовується в експрес – аналізі. Дану реакцію проводять на деревині, або на клаптику невідбіленого паперу (при гідролізі лігніна виділяються ароматичні альдегіди). Шиффові основи утворюються внаслідок взаємодії ароматичних альдегідів і з первинними ароматичними амінами.
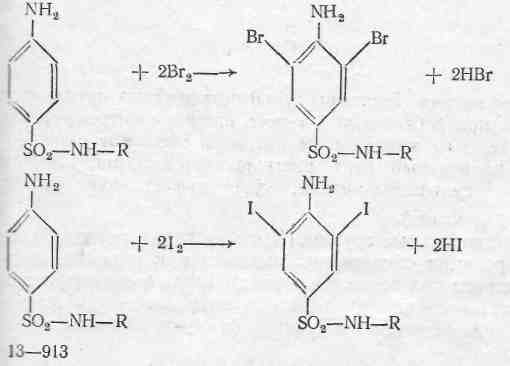
Реакції галогенування.
Ці реакції також основані на наявності первинної ароматичної аміногрупи в молекулі сульфаніламідів.
Всі сульфаніламідні препарати мають у своєму складу сульфур сульфамідної групи - то для відкриття сульфуру необхідно окислити органічну частину молекули концентрованою нітратною кислотою, при цьому сульфур переходить в сульфатну кислоту, яку легко можна виявити за допомогою хлориду барію.
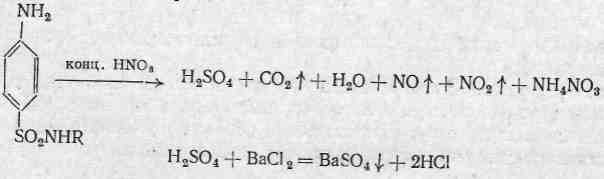
Реакція з солями важких металів (СuSO4, CoCl2)

Внаслідок рухливості гідрогену в імідній групі сульфаніламідні препарати здатні вступати в реакцію з розчинами солей важких металів. Внаслідок реакції утворюються сполуки, що мають певний колір, розчинні або нерозчинні у воді. При цьому колір осаду, або розчину для кожного сульфаніламідного препарату різний, що дає можливість ідентифікувати кожен препарат індивідуально.
Піроліз – термічне розкладання, можна також застосувати для ідентифікації сульфаніламідних препаратів. При термічному розкладанні сульфаніламідних препаратів утворюються різні кристалічні возгони і плави, забарвлені в характерний для кожного препарату колір.
Якщо в молекулі препату є Сульфур в гетероциклічному кільці (норсульфазол, сульфазол, етазол та ін.) при піролізі утворюється газоподібний продукт – H2S, який можна визначити по запаху або по почорнінню фільтрувального паперу, змоченого розчином ацетату Плюмбуму.
При піролізі сульфаніламідних препаратів, що не містять Сульфур в кільці (сульфазин, сульфадимезин, сульфацил, сульфантрол), виділяється SO2.
7. Реакція з нітропрусидом натрію. Розчини сульфаніламідних препаратів в присутності лугів та із додаванням 1% розчину нітропрусиду натрію і подальшому підкисленні мінеральною кислотою утворюють забарвлені в червоний або червоно-коричневий колір розчини (стрептоцид, сульфацил, сульгін, уросульфан) або осади (етазол, норсульфазол, сульфадимезин).
