
Экзаменационные ответы
.pdfНепременным условием грамотного и безопасного облучения является подведение точной дозы ионизирующего излучения к опухолевому очагу в сочетании с минимальным повреждением и сохранением жизнеспособности окружающих структур. Выделяют понятие толерантной дозы, при которой частота поздних осложнений не превышает 5 % в течение 5 лет наблюдения. Различные органы и ткани характеризуются разной величиной предельной толерантной дозы (например, 60 Гр - для соединительной ткани). Чем меньше суммарная поглощенная доза излучения превышает толерантную, тем реже наблюдаются лучевые повреждения. Для уменьшения риска развития осложнений суммарная доза подводится небольшими фракциями в течение определенного периода времени.
Стандартные величины фракций (или разовых доз) составляют от 1,8 до 2 Гр 5 раз в неделю до достижения суммарной очаговой дозы (от 25 до 70-100 Гр). Помимо обычного режима применяют мультифракционирование (дневное дробление дозы на несколько фракций, подводимых с интервалом 4-8-12 ч).
В основе гибели клеток в результате облучения лежит повреждение ДНК с последующим прерыванием репликации (репродуктивная или митотическая гибель). Второй путь реализации действия ионизирующего излучения - непрямое действие на клетки через ионизацию, главным образом в результате радиолиза воды. Свободные радикалы оказывают повреждающее воздействие на клетку, вызывая нарушение метаболизма и развитие некробиотических процессов.
Радиобиологический эффект напрямую зависит от концентрации кислорода в тканях («кислородный эффект»). Неполноценное кровоснабжение опухолевой ткани, приводящее к ее гипоксии, является одной из причин резистентности к ионизирующему излучению. При облучении опухоли в большей мере погибают хорошо оксигенированные клетки, расположенные вблизи от капилляров. По мере удаления погибших клеток приток кислорода увеличивается, т.е. происходит реоксигенация опухоли. Наиболее эффективная реоксигенация достигается при длительном (в течение 6-7 нед) облучении в режиме 30-35 фракций по 2 Гр.
Злокачественные опухоли характеризуются различной радиочувствительностью. Так, высокой степенью радиочувствительности обладают лимфомы, эмбриональные опухоли (семиномы), мелкоклеточный и низкодифференцированный рак. Относительно высокая радиочувствительность свойственна плоскоклеточному раку гортани, глотки, мочевого пузыря, кожи, шейки матки, железистому раку пищеварительного тракта, средняя - железистому раку тела матки, молочной железы и бронхов. И наконец, низкая степень радиочувствительности отличает железистый рак слюнной железы, почки, печени, желудка, поджелудочной железы, саркомы костей и мягких тканей и меланому кожи.
Для повышения эффективности лучевой терапии применяют различные способы модификации радиочувствительности тканей с помощью радиомодифицирующих агентов. Последние представляют собой физические и химические факторы, способные изменять (ослаблять или усиливать) радиочувствительность клеток и тканей. Радиомодификация, т.е. управление лучевыми реакциями, применяется также с целью противолучевой защиты нормальных тканей.
К основным способам радиомодификации относятся оксигенотерапия, оксигенобаротерапия (облучение в условиях гипербарической оксигенации), гипоксирадиотерапия (перевод больного на время проведения сеанса лучевой терапии на дыхание гипоксической газовой смесью), гипертермия опухоли, применение цитостатиков (5-ФУ, цисплатин). Цитостатики (так называемые радиосенсибилизаторы) реализуют синхронизирующий эффект, задерживая деление опухолевых клеток в определенных фазах цикла. В результате большее число клеток опухоли находится в наиболее радиочувствительных фазах митоза и премитоза, что значительно повышает эффективность лучевой терапии.
КОМБИНАЦИЯ ЛУЧЕВОЙ ТЕРАПИИ И ХИРУРГИЧЕСКОГО ЛЕЧЕНИЯ Как компонент комбинированного метода лучевая терапия позволяет расширить показания к радикальному лечению
местно-распространенных опухолей, повысить резектабельность, уменьшить частоту развития местных рецидивов. Выделяют пред-, интра- и послеоперационное облучение.
Предоперационная лучевая терапия применяется с целью разрушения наиболее радиочувствительных клеток или понижения их жизнеспособности, уменьшения опасности интраоперационного метастазирования и увеличения операбельности. Оптимальная очаговая доза должна быть достаточной для того, чтобы вызвать гибель большей части опухолевых клеток, и в то же время она не должна нарушать процессы заживления послеоперационной раны.
В настоящее время используются 2 основные методики предоперационного облучения:
1)ежедневное облучение первичной опухоли и регионарных зон по 2 Гр до суммарной очаговой дозы 40-45 Гр в течение 4-5 нед лечения. Операцию выполняют через 2-3 нед;
2)ежедневное облучение в режиме крупного фракционирования по 4-5 Гр в течение 1 нед до суммарной дозы 20-25 Гр. Оперативное вмешательство производят не позднее 72 ч после ее окончания.
Интраоперационная лучевая терапия представляет собой дистанционное или внутритканевое облучение опухоли или ее ложа с целью снижения частоты местных рецидивов. Проводится с использованием быстрых электронов до суммарной дозы 15-30 Гр.
Послеоперационная лучевая терапия применяется для уменьшения риска возникновения локального рецидива, особенно после выполнения нерадикального оперативного вмешательства. Потенциальная эффективность послеоперационного облучения ниже, поскольку оно проводится в условиях нарушенного кровоснабжения и местного воспаления. Осуществляется в режиме классического фракционирования не ранее чем через 2-3 нед после хирургического этапа лечения. На область удаленной опухоли подводят высокие (до 50-60 Гр) дозы, на зоны регионарного метастазирования - до 45-50 Гр.
КОМБИНАЦИЯ ЛУЧЕВОЙ И ЛЕКАРСТВЕННОЙ ТЕРАПИИ Дозы и методика облучения зависят от чувствительности опухоли к ионизирующему излучению, цитостатикам и
гормональным препаратам. Так, при комплексном лечении больных раком молочной железы, бронхов, органов головы и шеи облучение первичной опухоли и зон регионарного метастазирования проводится в высоких (канцерицидных) дозах (55-60 Гр).
При лечении злокачественных опухолей, высокочувствительных к лекарственной терапии (например, герминогенные опухоли яичка, лимфопролиферативные заболевания), облучение играет роль вспомогательного метода. Дозы ионизирующего излучения, как правило, уменьшают на 1/3 (до 30-45 Гр).
Сочетанное применение лекарственной и лучевой терапии зачастую сопровождается увеличением частоты и тяжести побочных реакций. С целью снижения риска осложнений облучение проводят в классическом режиме фракционирования (по 1,8-2 Гр 5 раз в неделю), избегая крупных (4-5 Гр) фракций.
Типы лучевой терапии
1.Радикальная лучевая терапия имеет целью излечение больного и направлена на полное разрушение опухоли и ее регионарных метастазов. Она включает облучение первичного опухолевого очага (в максимальных дозах, достигающих 60-80 Гр) и зон регионарного метастазирования (до 40-50 Гр). С радикальными целями используют наружное или сочетанное облучение, т.е. дополненное внутриполостным или внутритканевым.
Радикальная лучевая терапия часто является основным методом лечения злокачественных опухолей сетчатки и сосудистой оболочки глаза, краниофарингиомы, медуллобластомы, эпендимомы, рака кожи, полости рта, языка, глотки, гортани, пищевода, шейки матки, влагалища, предстательной железы, а также ранних стадий лимфомы Ходжкина и семином. При лечении больных со злокачественными новообразованиями органов головы и шеи, раком молочной железы, легких, пищевода, мочевого пузыря, прямой кишки, костей радикальную лучевую терапию назначают в сочетании с хирургическим лечением или химиотерапией.
2.Паллиативная лучевая терапия подавляет рост опухоли и уменьшает ее объем, что позволяет облегчить состояние больных, улучшить качество их жизни, а в ряде случаев и увеличить ее продолжительность. Используемый для паллиативной лучевой терапии диапазон доз, как правило, не превышает 40-50 Гр. Частичное разрушение опухолевой массы сопровождается уменьшением интенсивности болевого синдрома и риска патологических переломов при метастатическом поражении костей, устранением неврологической симптоматики при метастазах в головном мозгу, восстановлением проходимости пищевода или бронхов при их обструкции, сохранением зрения при первичных или метастатических опухолях глаза и глазницы и т.п.
3.Симптоматическая лучевая терапия, в отличие от паллиативной, проводится не с целью уменьшения объема опухоли, а только для устранения тяжелых симптомов распространенного злокачественного процесса, таких, как интенсивные боли при метастазах в костях, компрессионно-ишемическая радикуло- и миелопатия, центральная неврологическая симптоматика при метастатическом поражении головного мозга. Как правило, симптоматическую лучевую терапию назначают короткими курсами в дозах, не превышающих 20-30 Гр, что позволяет быстро купировать тягостную симптоматику заболевания.
15. Основные клинические симптомы и патогенез их развития при злокачественных опухолях.
Клиническая симптоматика злокачественных новообразований характеризуется большим разнообразием и зависит от многих факторов: локализации опухоли, ее гистологической формы, характера роста, распространенности процесса, возраста пациента, наличия сопутствующих заболеваний.
Например, при поражении органов желудочно-кишечного тракта (ЖКТ) могут наблюдаться кахексия, анемия; при поражении печени страдает обмен веществ. Особенности локализации опухоли в самом органе также определяют клиническую картину. Опухоль, расположенная в пилорическом отделе желудка, имеет симптомы стеноза; опухоль же, локализующаяся в кардии и поражающая пищевод, приводит к дисфагии - препятствию для прохождения пищи. В ряде случаев при IV стадии заболевания основная симптоматика может быть связана не с первичной опухолью, а с
ее метастазами. Так, первые симптомы заболевания при метастазах небольшого рака легкого в мозг могут возникать со стороны головного мозга. Нередко рак предстательной железы диагностируется после выявления метастазов в костях и сопровождается сильным болевым синдромом.
Местные изменения возникают в результате прямого действия опухолевых клеток на неопухолевую ткань, непосредственно граничащую с новообразованием. можно выделить следующие группы симптомов новообразования: опухолевидного образования, обтурации, компрессии и деструкции. Наличие опухолевидного образования можно диагностировать визуально и путем пальпации.
Наличие опухолевидного образования можно диагностировать визуально и путем пальпации.
Вызывая сдавление и нарушая проходимость полых органов, даже доброкачественные опухоли некоторых локализаций могут представлять смертельную опасность. Рост опухоли в просвет полого органа может обусловить закрытие просвета и нарушение пассажа его содержимого, определяя синдром сдавления и обтурации. Так, опухоль пищевода ведет к дисфагии или полной непроходимости пищевода, что обрекает организм на голодание. Опухоль любой части пищеварительного тракта нарушает пассаж пищи и ведет к нарушению питания. Новообразование привратника желудка вызывает рвоту и резкое истощение организма, кишечника - непроходимость, мочеточника - анурию, гортани - стеноз, удушье, бронха - ателектаз легочной ткани, при опухоли желчевыводящих протоков развиваются холестаз и желтуха. Опухоль мозга может сдавливать жизненно важные центры.
По мере увеличения размеров опухоли могут наблюдаться ее разрушение или распад. При прорастании опухоли в сосуды на фоне ее распада и изъязвления может наступить аррозия сосудов, приводящая к кровотечениям, иногда даже смертельным. Некрозы опухолей могут вызвать перфорацию стенок органа (пищевода, мочевого пузыря), полностью либо частично разрушать органы, что при поражении жизненно важных систем организма может повлечь за собой смерть. При разрушении кости метастазами или первичными опухолями (иногда незлокачественными) могут развиться патологические переломы.
Злокачественные опухоли, кроме местной симптоматики, связанной с поражением того или иного органа, проявляются
общими симптомами.
Системное действие опухоли на организм проявляется в виде неспецифических симптомов: общей иммунодепрессии, лихорадки, анемии, астении, кахексии и специфических паранеопластических синдромов. В организме опухоленосителя отмечается тенденция к развитию алкалоза.
Метаболизм жиров в опухоли всегда ускорен, что связано с высокой интенсивностью деления клеток, необходимым условием для которой является синтез липидных компонентов цитоплазматической мембраны. Накопление холестерина в опухолевых клетках также связано с потребностью в строительстве мембран. В клетках новообразований всегда усилен синтез белков при относительном снижении выработки гистонов. Опухоль потребляет незаменимые аминокислоты из крови, что сопровождается дефицитом белка и белковым голоданием организма опухоленосителя при больших размерах новообразования. Для опухолевого роста характерен феномен «субстратных ловушек». Непрерывно разрастаясь, опухоль может потреблять продукты, необходимые для жизнедеятельности организма: глюкозу - для энергообразования, аминокислоты - для построения компонентов цитоплазмы, липиды и холестерин - для синтеза клеточных мембран Учитывая особенности обмена опухолевых клеток, следует подчеркнуть, что каких-либо специфических токсических
соединений они не выделяют. Однако, несмотря на приспособленность опухолевых клеток к гипоксии, при больших размерах новообразования наступает массовый некроз клеток - опухолевый распад, проявляющийся синдромом неспецифической эндогенной интоксикации, вызванной наличием большой массы некротической ткани.
Паранеопластические синдромы - это совокупность метаболических нарушений, сопровождающих развитие опухоли. В основе паранеопластических синдромов лежат нарушения, обусловленные непрямым воздействием новообразования: дисбалансом обменных процессов, иммунным конфликтом «опухоль - организм», эктопическим образованием гормоноподобных полипептидов, в норме не продуцирующихся. Эти симптомы связаны с появлением опухоли и исчезают после ее удаления. Перед клиницистом стоит задача выявления таких признаков, чтобы в совокупности с инструментальными и морфологическими методами распознать новообразование на самых ранних стадиях.
К специфическим проявлениям паранеоплазии относят эндокринные нарушения, вызванные действием продуктов метаболизма опухоли, секрецией гормонов и медиаторов. Гормонообразование объясняется тем, что конструкция генов клеток организма принципиально дает возможность полипотентному синтезу, при котором гормонообразование в эндокринных клетках блокируется, а в опухолевых клетках, наоборот, высвобождается. Примерами этого является образование паратгормона в опухолях легких с формированием гиперкальциемии, инсулина - при опухолях почек, яичников и надпочечников; образование тромбокиназоподобных веществ при опухолях поджелудочной и слюнных желез (опасность тромбозов), АКТГ - при опухолях легких и средостения с развитием синдрома Кушинга, тиреотропного гормона - при опухолях легких, гастрина - при опухолях поджелудочной железы. В контексте паранеопластического синдрома могут также рассматриваться гемостазиологические и неврологические нарушения, дерматопатии, поражение скелетных мышц в виде миопатий и мышечных дистрофий, нарушение деятельности ЖКТ, кардиодепрессия, снижение толерантности к глюкозе и др.
Основные нейроэндокринные синдромы связаны с секрецией серотонина, гастрина, АКТГ, при опухолях коры надпочечников, опухолях нейроэндокринной системы - апудомах. Чаще всего наблюдается карциноидный синдром, развивающийся на фоне ЕС-клеточных нейроэндокринных опухолей - карциноидов, секретирующих серотонин.

Карциноидный синдром сопровождается сосудистыми расстройствами, лихорадкой, бронхоспазмом, диареей, абактериальным эндокардитом, олигурией.
Гемостазиологический паранеопластический синдром у больных со злокачественными опухолями проявляется тромбозом, мигрирующим тромбофлебитом, эмболией ветвей легочной артерии, абактериальным тромбоэндокардитом, парадоксальными кровотечениями, тромботической микроангиопатией. Выброс опухолевыми клетками различных факторов свертывания крови приводит к повышенному фибриногенообразованию, нарушению реологических свойств крови, что определяет большое количество тромбозов и тромбоэмболических осложнений, сопутствующих опухолевому росту. Определенное значение в развитии тромбоза имеет эмболизация сосудов опухолевыми клетками. Раковый эмбол служит ядром тромба, который при соответствующих условиях, если процесс организации запаздывает, может способствовать метастазированию. Повреждение мембран тромбоцитов продуктами перекисного окисления, образующимися при опухолевом распаде, также может способствовать повышенному тромбообразованию.
16. Закономерности и пути метастазирования злокачественных опухолей.
Метастазирование - это многоступенчатый процесс массового отделения клеток опухоли, приобретения отторгнутыми клетками способности существовать вне поддержки первичного очага, уклоняться от «надзора» иммунной системы, проникать и закрепляться в новом месте, индуцируя опухолевый ангиогенез Инвазивные свойства опухоли и способность к метастазированию зависят от продукции опухолевыми клетками
своеобразных протеолитических ферментов, разрушающих внеклеточный матрикс стромы органов, - нейтральных металлопротеаз (или протеингликаназ), действие которых сходно с эффектом гиалуронидазы, а также их активаторов и ингибиторов.
Инвазивный рост происходит в первую очередь вдоль слабых мест, по щелям вдоль лимфатических и кровеносных сосудов, нервных стволов.
Сторожевой лимфатический узел не обязательно является ближайшим к опухоли лимфатическим узлом. Проведенные исследования показывают, что нередко сторожевыми являются лимфатические узлы, расположенные на значительном расстоянии от опухоли. Именно этот узел в первую очередь поражается метастазами при раке и является как бы первым фильтром для опухолевых клеток. Этот лимфатический узел является также фильтром и для контрастных препаратов - он в первую очередь окрашивается при введении контрастного препарата непосредственно в лимфатические пути или в ткани. В результате данный лимфатический узел хорошо визуализируется на рентгенограммах.
I. В зависимости от пути метастазирования (пути распространения опухолевых клеток):
1. гематогенные метастазы – распространение опухолевых клеток по кровеносным сосудам.
2.лимфогенные метастазы – распространение опухолевых клеток по лимфатическим сосудам.
3.ликворогенные метастазы – распространение опухолевых клеток по ликворным путям в пределах ЦНС.
4. имплантационные метастазы – распространение опухолевых клеток по поверхности серозных (чаще) и слизистых (реже) оболочек.
II. В зависимости от удаления от первичного очага:
1.регионарные метастазы – метастазы, образующиеся вблизи опухоли (прежде всего, метастазы в регионарные лимфатические узлы, обозначаемые символом N в TNM-классификации опухолей).
2.отдалённые метастазы – метастазы в отдалённые лимфоузлы или в другие органы (символ М в TNM-классификации опухолей).
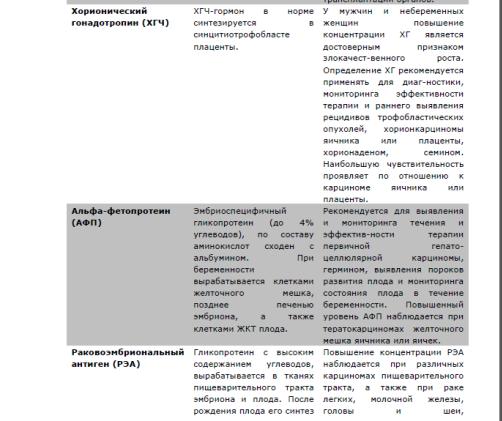
17. Опухолевые маркеры и их роль в онкологии.
Лекция
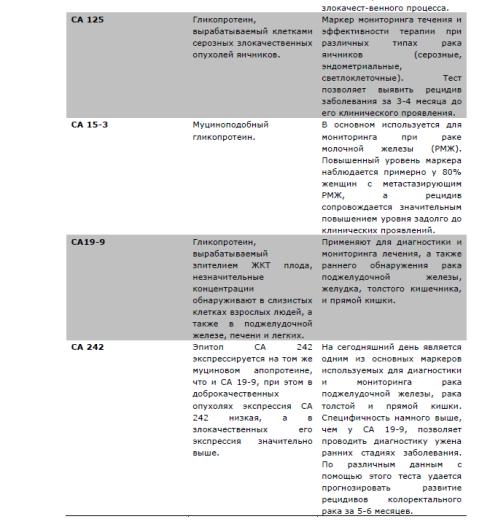
Простата специфичный антиген (ПСА)
И др
18. Паренеопластические синдромы. Классификация и их значение.
Паранеопластические неврологические синдромы – ретинопатия Лимбический энцефалит Паранеопластическая дегенерация коры мозжечка миелопатия сенсорная нейронопатия Миастения Дерматомиозитполимиозит
Паранеопластические эндокринные синдромы – гиперкальциемия Гипонатриемия синдром Кушинга Акромегалия Гинекомастия Гипогликемия
И др
19. Методы и принципы лечения злокачественных опухолей. Успехи в онкологии.
Современные достижения клинической онкологии позволяют излечить не менее 1/3 больных, страдающих злокачественными новообразованиями. Большинство пациентов (60-70 %) подвергаются хирургическому лечению или операции в сочетании с лучевой или химиотерапией. Около 30 % больных получают только облучение и до 10 % - только цитостатическое лечение. Шансы на благоприятный исход у потенциально излечимых больных значительно возрастают при использовании всех возможностей для установления правильного диагноза и проведения адекватного лечения. Самым важным условием излечения преобладающего большинства злокачественных опухолей является ранняя стадия процесса.
Оптимальными являются лечение и наблюдение онкологических пациентов в специализированных клиниках, оснащенных современным медицинским оборудованием, с высококвалифицированным медицинским персоналом.
В клинической онкологии используют следующие варианты лечения:
•комбинированное лечение - применение у одного больного двух однонаправленных методов лечения (например, локальное воздействие на опухоль путем выполнения радикальной операции с последующим курсом лучевой терапии);
•комплексное лечение - применение локального и системного методов воздействия на опухоль (например, хирургического и лекарственного лечения).
Отдельно выделяют сочетанный вариант лечения, подразумевающий одновременное применение принципиально однородных методов с различным механизмом действия (например, сочетание дистанционного и внутритканевого облучения).
Лечение онкологических больных может быть радикальным, паллиативным и симптоматическим. Радикальным называется такой вид лечения, после проведения которого в организме больного не
выявляются клинические, рентгенологические, эндоскопические и морфологические признаки опухолевого процесса. После выполнения паллиативного лечения в организме больного сохраняются проявления опухолевого заболевания. При проведении симптоматического лечения все мероприятия направлены только на устранение тягостных или угрожающих жизни симптомов и осложнений заболевания.
ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ Как правило, хирург является первым специалистом, к которому обращается больной, страдающий злокачественным
новообразованием. Кроме того, в процессе лечения онкологического пациента возникает необходимость в хирургическом вмешательстве для морфологической верификации диагноза, определения степени распространения опухолевого процесса, для реализации паллиативных задач и т.п. Профессионализм хирурга-онколога заключается также в знании как стандартных, так и нестандартных вариантов лечения злокачественных опухолей, способности объяснить их больному, в адекватном и полном выполнении начальных этапов в диагностике и лечении. Проведение морфологического исследования позволяет выбрать адекватный объем хирургического вмешательства, а также предоставляет юридические основания для выполнения в случае необходимости калечащей операции.
Хирургические вмешательства подразделяются на диагностические и лечебные.
Диагностические операции (тонкоигольная и трепанобиопсия, ножевая биопсия, видеоассистированные операции) выполняются для верификации диагноза и определения степени распространения опухолевого процесса. Выделяют биопсии лимфатических узлов, опухоли (молочной железы, конечностей, ЖКТ, дыхательных путей).
Лечебные операции подразделяются на радикальные, условнорадикальные или циторедуктивные и паллиативные.
Радикальные операции предусматривают радикализм по отношению к первичной опухоли и ее регионарным метастазам. После выполнения радикальной операции в организме не остается опухолевых очагов, определяемых клиническими, рентгенологическими, эндоскопическими или морфологическими методами. Понятие операбельности включает так называемые общие критерии, определяющие состояние больного, его возраст, сопутствующие заболевания, функциональные резервы жизненно важных органов, принципиально позволяющие выполнить операцию, а также критерии, характеризующие опухоль и опухолевый процесс в целом. В отличие от операбельности под резектабельностью понимается техническая возможность удаления опухоли с учетом степени ее распространения, т.е. глубины поражения органа, наличия регионарных и отдаленных метастазов.
Выделяют:
1)стандартные радикальные операции, при которых удаляют основную опухоль и близлежащие зоны ее метастазирования в лимфатическую систему;
2)расширенные операции, при которых увеличивается объем удаления зон регионарного метастазирования за счет смежных анатомических областей;
3)комбинированные или мультиорганные операции; в результате таких вмешательств удаляют часть органа или полностью другой орган, в которые произошла инвазия первичной опухоли.
Радикальное удаление первичной опухоли должно удовлетворять принципам абластики, антибластики, зональности, футлярности.
Абластика является основным принципом радикального хирургического лечения злокачественных новообразований, заключающимся в резекции пораженного органа в пределах здоровых тканей. К основным приемам абластики относятся в первую очередь исключение грубых манипуляций с пораженными органами и тканями, острая препаровка скальпелем или электроножом, предварительное лигирование венозных сосудов, смена инструментов и перчаток после удаления опухоли перед реконструктивным этапом, тщательный гемостаз, хорошее дренирование раны в послеоперационном периоде и т.п. При адекватном выполнении этих мероприятий значительно уменьшается риск попадания опухолевых клеток в рану, их имплантация в здоровые ткани и распространение по кровеносному руслу. Однако рассеивание некоторого количества злокачественных клеток в ране может происходить, несмотря на
соблюдение правил абластики, поэтому обеспечение радикализма оперативного вмешательства должно включать комплекс антибластических мер.
Антибластика представляет собой ряд мероприятий, направленных на уничтожение и удаление оставшихся в операционном поле опухолевых клеток. К ним относятся: обильное орошение и промывание раны раствором фурацилина, 3 % раствором перекиси водорода, пред-, интра- и послеоперационное облучение операционного поля. Принцип зональности базируется на знании особенностей местного распространения опухоли и ее метастазирования в регионарные лимфатические узлы.
Операции при злокачественных опухолях различных локализаций предусматривают удаление пораженного органа и клетчатки с лимфатическими узлами в зонах регионарного метастазирования.
Принцип футлярности предполагает удаление опухоли в едином блоке со всеми анатомическими структурами фасциального футляра, в котором она находится. Соблюдение этого принципа особенно важно при удалении сарком мягких тканей, распространяющихся преимущественно вдоль фасций, которые выполняют функцию естественных барьеров для опухоли.
Паллиативные операции не удовлетворяют всем требованиям радикального удаления опухоли, после их выполнения в организме больного остаются неликвидированные очаги опухоли. Основной целью паллиативных операций являются предотвращение тяжелых осложнений опухолевого процесса (перфорации полого органа, стеноза его просвета, кровотечения из опухоли или магистральных сосудов) и улучшение качества жизни больного. В ряде случаев данный метод хирургического лечения сопровождается увеличением продолжительности жизни. Паллиативные операции могут быть циторедуктивными и симптоматическими.
Циторедуктивные операции обеспечивают относительно полную или частичную циторедукцию, что позволяет в дальнейшем проводить адъювантное лучевое или лекарственное лечение.
Симптоматические операции представляют собой хирургические вмешательства, при которых не предпринимаются попытки воздействовать на опухолевый процесс. Эти операции выполняют с целью устранения того или иного ведущего патологического симптома, зачастую представляющего непосредственную угрозу жизни больного (непроходимость ЖКТ, кровотечение из опухоли и др.).
Радикальное хирургическое лечение злокачественных новообразований на ранних стадиях позволяет в большинстве случаев добиться прекрасных результатов. Кроме того, небольшой объем опухоли дает возможность применять менее агрессивный, чем стандартный хирургический подход, без ущерба для выживаемости. В связи с этим на фоне повышения интереса к вопросам сохранения и поддержания удовлетворительного качества жизни онкологических больных постепенно увеличивается доля органосохраняющих операций в хирургии опухолей молочной железы, мягких тканей и опорно-двигательного аппарата, опухолей почки и др. Для выполнения подобных операций необходимы индивидуально подобранные расходные материалы (протезы), специальное оборудование (операционный микроскоп, микрохирургические инструменты) и владение микрохирургической техникой. Выживаемость пациентов после хирургического лечения данного объема не уступает таковой в группе больных, перенесших калечащее лечение, при несоизмеримо лучшем качестве жизни.
Полный регресс регистрируется при исчезновении всех клинических проявлений опухолевого процесса; частичный регресс - уменьшение опухолевых очагов более чем на 50 % от их первоначальной площади; стабилизация - регресс очагов менее чем на 50 % или увеличение менее чем на 25 %; прогрессирование - увеличение размеров опухолевых очагов более чем на 25 % или появление новых очагов.
Токсические реакции противоопухолевой терапии К токсическим реакциям относятся любые изменения в самочувствии или состоянии больного, а также клинически
значимые отклонения лабораторных показателей. Выделяют 4 степени тяжести побочных эффектов химиотерапии:
•1 (слабая) степень - легкое осложнение, причиняющее минимальные неудобства и не препятствующее повседневной деятельности больного;
•2 (умеренная) степень - осложнение, вызывающее умеренный дискомфорт и нарушающее повседневную деятельность пациента;
•3 (выраженная) степень - тяжелый побочный эффект, препятствующий обычной повседневной деятельности больного;
•4 (представляющая угрозу для жизни больного) степень - осложнение, подвергающее пациента непосредственному риску смерти.
Лучевая – выше, и лекарственная – ниже.
Фотодинамическая терапия (ФДТ) представляет собой цитотоксический вид лечения, в основе которого лежит применение низкоинтенсивного лазерного излучения. В основе противоопухолевого действия ФДТ лежит механизм фотооксигенации, заключающийся в образовании промежуточных радикалов и двухатомного кислорода, которые
оказывают повреждающее воздействие на опухолевые клетки. Принцип метода ФДТ можно представить следующим образом: молекулы фотосенсибилизатора избирательно фиксируются на мембранах активно пролиферирующих клеток (опухолевых, эндотелиальных), а также в клеточных органеллах (в частности, в митохондриях). После облучения фотосенсибилизированной ткани опухоли лазерным излучением происходит переход нетоксичного триплетного кислорода в активное, возбужденное состояние. В последующие годы синтезировано несколько классов фотосенсибилизаторов; к ним, помимо порфиринов, относятся хлорины, бактериохолины, фталоцианины. ФДТ может проводиться как по радикальной (у больных с ранними формами рака бронха, пищевода и желудка, в том числе с целью подготовки к операции), так и по паллиативной (при распространенных стенозирующих опухолях для устранения явлений дыхательной недостаточности, дисфагии, кишечной непроходимости) программам. Применяется интраоперационная ФДТ при видеоторакоскопическом плевродезе, при лечении рака пищевода и желудка. Возможно комбинирование ФДТ с лучевой и (или) химиотерапии.
20. Радикальное, паллиативное и симптоматическое лечение онкологических больных.
Радикальным называется такой вид лечения, после проведения которого в организме больного не выявляются клинические, рентгенологические, эндоскопические и морфологические признаки опухолевого процесса. После выполнения паллиативного лечения в организме больного сохраняются проявления опухолевого заболевания. При проведении симптоматического лечения все мероприятия направлены только на устранение тягостных или угрожающих жизни симптомов и осложнений заболевания.
Паллиативные операции не удовлетворяют всем требованиям радикального удаления опухоли, после их выполнения в организме больного остаются неликвидированные очаги опухоли. Основной целью паллиативных операций являются предотвращение тяжелых осложнений опухолевого процесса (перфорации полого органа, стеноза его просвета, кровотечения из опухоли или магистральных сосудов) и улучшение качества жизни больного. В ряде случаев данный метод хирургического лечения сопровождается увеличением продолжительности жизни. Паллиативные операции могут быть циторедуктивными и симптоматическими.
Циторедуктивные операции обеспечивают относительно полную или частичную циторедукцию, что позволяет в дальнейшем проводить адъювантное лучевое или лекарственное лечение.
Симптоматические операции представляют собой хирургические вмешательства, при которых не предпринимаются попытки воздействовать на опухолевый процесс. Эти операции выполняют с целью устранения того или иного ведущего патологического симптома, зачастую представляющего непосредственную угрозу жизни больного (непроходимость ЖКТ, кровотечение из опухоли и др.).
См выше
21. Современные принципы и возможности лекарственной терапии онкологических больных.
Лекарственное противоопухолевое лечение включает химиотерапию (использование цитостатиков), гормонотерапию и биотерапию.
Классификация противоопухолевых цитостатиков в зависимости от механизма действия:
1)алкилирующие агенты;
2)антиметаболиты;
3)противоопухолевые антибиотики;
4)антимитогенные препараты;
5)ингибиторы ДНК-топоизомераз I и II.
Алкилирующие агенты реализуют противоопухолевый эффект в отношении пролиферирующих опухолевых клеток независимо от периода клеточного цикла (т.е. не являются фазоспецифичными). Препараты этой группы повреждают макромолекулы (ДНК, РНК) путем реакции алкилирования, т.е. замещения атома водорода на алкильную группу. В результате образуются поперечные сшивки и разрывы ДНК, нарушающие процесс репликации, появляются дефектные нуклеотиды, возникают мутации и гибель клеток. При неизменной дозе цитостатика доля поврежденных клеток является постоянной. (циклофосфамид, цисплатин). Алкилирующие агенты обладают широким спектром противоопухолевой активности, что позволяет использовать их в лечении практически всех чувствительных к лекарственной терапии злокачественных опухолей Антиметаболиты выступают структурными аналогами веществ, участвующих в синтезе нуклеиновых кислот.
Включение антиметаболитов в макромолекулу опухолевой ДНК приводит к нарушению синтеза нуклеотидов и как следствие к гибели клетки. Наибольшую цитостатическую активность они проявляют в отношении интенсивно пролиферирующих опухолевых клеток, находящихся в S-фазе клеточного цикла. Зависимость доза-эффект у антиметаболитов нелинейная; после достижения определенного уровня дальнейшее повышение дозы не сопровождается увеличением доли гибнущих клеток. Однако эта доля возрастает с увеличением времени воздействия, поскольку новые клетки успевают вступить в период S.( метотрексат, меркаптопурин, 5-фторурацил)
Антиметаболиты широко применяются в лекарственной терапии больных раком пищевода, желудка и толстой кишки, головы и шеи, молочной железы, остеогенными саркомами.
Противоопухолевые антибиотики являются продуктами жизнедеятельности грибов и микроорганизмов. Препараты этой группы действуют независимо от периода клеточного цикла и наиболее успешно применяются при медленно растущих опухолях с низкой ростовой фракцией. Механизмы действия противоопухолевых антибиотиков различны и включают подавление синтеза нуклеиновых кислот в результате образования свободных радикалов кислорода, ковалентного связывания ДНК, торможения активности топоизомеразы I и II. (доксорубицин) Наибольший спектр противоопухолевой активности демонстрирует доксорубицин, высокоэффективный в отношении рака молочной железы, сарком костей и мягких тканей, саркомы Юинга, лимфом.
Антимитогенные препараты: винкаалкалоиды винкристин, винбластин, виндезин, винорельбин)
и таксаны доцетаксел, паклитаксел), точкой приложения которых являются микротрубочки митотического аппарата. При этом механизм действия винкаалкалоидов заключается в денатурации тубулина, входящего в состав микротрубочек митотического веретена, что приводит к деполимеризации тубулина и остановке митоза. Механизм действия таксанов противоположен: они ускоряют сборку микротрубочек, но нарушают их деполимеризацию, приводя к образованию избытка дефектных микротрубочек. В результате клетки задерживаются в фазе митоза, их цитоскелет повреждается, и наступает гибель. Препараты этой группы широко применяются для лечения больных раком молочной железы, яичников, бронхов, с герминогенными опухолями яичка.
Ингибиторы ДНК-топоизомераз I и II. Топоизомеразы представляют собой ферменты, устраняющие гиперспирализацию ДНК путем последовательного «разрезания» и «сшивания» ее цепей. При этом топоизомераза I взаимодействует с одной цепью ДНК, а топоизомераза II - сразу с обеими. Нормальное функционирование этих ферментов необходимо для осуществления процессов транскрипции, репликации и митоза.
Эндокринотерапия, или гормонотерапия, - это метод лечения злокачественных опухолей посредством удаления источника гормонов, подавления их синтеза или блокирования действия гормонов на органы-мишени. Выделяют следующие виды гормонального воздействия:
•хирургическое, направленное на удаление источника гормонов путем оперативного вмешательства (овариэктомия, орхиэктомия, адреналэктомия, гипофизэктомия);
•лучевое, т.е. удаление источника гормонов путем лучевого воздействия (например, лучевая овариэктомия у больных раком молочной железы);
•лекарственное, связанное с использованием гормональных препаратов и антигормонов.
В клинической практике применяют стероидные гормоны - эстрогены, антиэстрогены, прогестины, андрогены, антиандрогены, ингибиторы ароматазы, кортикостероиды, агонисты LH-RH, а также тиреоидные гормоны и аналоги соматостатина.
Основы биотерапии злокачественных опухолей
Модификаторы биологических реакций - это лекарственные препараты, обладающие способностью изменять биологическую реакцию организма на опухоль. Примерами являются повышение иммунной защиты, усиление противоопухолевого иммунитета, стимуляция дифференцировки опухолевых клеток, уменьшение повреждающего действия цитостатиков на нормальные клетки, торможение процессов метастазирования и ангиогенеза. Остановимся на основных группах модификаторов биологических реакций.
Иммуномодуляторы - в первую очередь цитокины (интерфероны, интерлейкины), ряд синтетических препаратов (левамизол, полиоксидоний и др.), препараты тимуса (тимоген, тактивин и др.), иммуноглобулины, экстракты растений, препараты микробного происхождения (рибомунил, имудон). Действие иммуномодуляторов заключается в коррекции того или иного звена иммунной системы. Перед назначением препаратов этой группы необходимо оценить состояние иммунитета конкретного больного, определить дефектные звенья (это, в частности, пониженная цитотоксическая активность натуральных киллеров или фагоцитирующая способность нейтрофилов).
Достижением последних лет является применение в иммунотерапии злокачественных новообразований препаратов на основе моноклональных антител. Мишенями для них являются некоторые из поверхностных антигенов опухолевых клеток. ( ритуксимаб )
Показания к назначению противоопухолевой лекарственной терапии
1.Для излечения от таких злокачественных опухолей, как:
—лимфомы, нефробластома, саркома Юинга, ретинобластома, рабдомиосаркома у детей, лимфогранулематоз и некоторые лимфомы высокой степени злокачественности у взрослых (вероятность излечения достигает 50 % и более);
—герминогенные опухоли яичка - семиномы, несеминомы (вероятность излечения - 75 % и более);
—хориокарцинома у женщин (вероятность излечения -90 % и более);
—острые лейкозы у взрослых, рак яичников (вероятность излечения - 15-20 %).
2.Существенное продление жизни (при небольшой вероятности излечения) - у больных раком молочной железы, мелкоклеточным раком легкого, некоторыми лимфомами низкой степени злокачественности, остеогенной саркомой.
3.Уменьшение выраженности симптомов при диссеминированных формах злокачественных опухолей.
4.Лечение бессимптомных опухолей:
