
- •2. Строение ферментов
- •3. Множественные формы ферментов.
- •6. Механизм действия ферментов
- •1. Роль металлов в присоединении субстрата в активном центре фермента
- •2. Роль металлов в стабилизации третичной и четвертичной структуры фермента
- •3. Роль металлов в ферментативном катализе
- •4. Роль металлов в регуляции активности ферментов
- •8. Основы кинетики ферментативных реакций
- •Регуляция активности ферментов
- •1. Доступность субстрата или кофермента
- •2. Компартментализация
- •3. Генетическая регуляция
- •4. Ограниченный (частичный) протеолиз проферментов
- •5. Аллостерическая регуляция
- •6. Белок-белковое взаимодействие
- •7. Ковалентная (химическая) модификация
- •12. Применение ферментов в медицине
- •Основная роль цтк заключается в
- •5. Анаболизм
- •Катаболизм
- •Моносахариды
- •2. Олигосахариды
- •3. Полисахариды или полиозы
- •Эпидемиология галактоземии
- •Чем вызывается галактоземия?
- •Симптомы галактоземии
- •Дефицит галактозо-1-фосфатуридилтрансферазы
- •Дефицит галактокиназы
- •Дефицит уридилдифосфат-галактозо-4-эпимеразы
- •Классификация галактоземии
- •Диагностика галактоземии
- •Гликоген печени. Концентрация глюкозы в крови
- •Регуляция концентрации глюкозы в крови
- •8. Гипергликемия
- •9. Нарушения регуляции углеводного обмена
- •10. Гликолиз
- •Распад гликогена (гликогенолиз)
- •1. Этапы аэробного гликолиза
- •2. Реакции аэробного гликолиза
- •3. Окисление цитоплазматического nadh в митохондриалъной дыхательной цепи. Челночные системы
- •4. Баланс атф при аэробном гликолизе и распаде глюкозы до со2 и н2о
- •14. Переключение между аэробным и анаэробным окислением происходит автоматически
- •Эффект Пастера
- •15. Глюконеогенез
- •17. Пентозофосфатный путь окисления углеводов
12. Применение ферментов в медицине
Современная, так называемая рациональная, химиотерапия (направленное применение лекарственных препаратов в медицине) должна основываться на точном знании механизма действия лекарственных средств на биосинтез ферментов, на активность уже синтезированных ферментов или на регуляцию их активности в организме. Иногда для лечения некоторых болезней используют избирательно действующие ингибиторы. Так, ингибитор ряда протеиназ (трипсина, химотрипсина и калликреина) трасилол широко применяется для лечения острого панкреатита – болезни, при которой уровень трипсина и химотрипсина в крови резко возрастает. Знание избирательного ингибиторного действия некоторых природных и синтетических соединений (так называемых антиметаболитов) на ферменты может служить методологической основой для разработки эффективных методов синтеза химиотерапевтических препаратов. Этот путь открывает широкие возможности для направленного воздействия на синтез ферментовв организме и регуляции интенсивности метаболизма при патологии.
Достижения энзимологии находят все большее применение в медицине, в частности в профилактике, диагностике и лечении болезней. Успешно развивается новое направление энзимологии – медицинская энзимология, которая имеет свои цели и задачи, специфические методологические подходы и методы исследования. Медицинская энзимология развивается по трем главным направлениям, хотя возможности применения научных достижений энзимологии в медицине теоретически безграничны, в частности в области энзимопатологии, энзимодиагностики и энзимотерапии.
Энзимопатология успешно решает и проблемы патогенеза соматических болезней. Созданы крупные научные центры и научно-исследовательские институты, в которых ведутся работы по выяснению молекулярных основ атеросклероза, злокачественного роста, ревматоидных артритов и др. Нетрудно представить огромную роль ферментных систем или даже отдельных ферментов, нарушение регуляцииактивности и синтеза которых приводит к формированию или развитию патологического процесса.
Второе направление медицинской энзимологии – энзимодиагностика – развивается по двум путям. Один путь – использование ферментов в качестве избирательных реагентов для открытия и количественного определения нормальных или аномальных химических веществ в сыворотке крови, моче, желудочном соке и др. (например, выявление при помощи ферментов глюкозы, белка или других веществ в моче, в норме не обнаруживаемых). Другой путь – открытие и количественное определение самих ферментов в биологическихжидкостях при патологии.
Энзимотерапия - использование ферментов и модуляторов (активаторов и ингибиторов) действия ферментов в качестве лекарственных средств, имеет пока небольшую историю. До сих пор работы в этом направлении почти не выходят за рамки эксперимента. Исключение составляют некоторые протеиназы: пепсин, трипсин, химотрипсин и их смеси (абомин,химопсин), которые применяют для лечения ряда болезней пищеварительного тракта. Помимо протеиназ, ряд других ферментов, в частности РНКаза, ДНКаза, гиалуронидаза, коллагеназы, эластазы, отдельно или в смеси с протеина-зами используются при ожогах, для обработки ран, воспалительных очагов, устранения отеков, гематом, келоидных рубцов, кавернозных процессов при туберкулезе легких и др. Ферменты применяются также для лечения сердечно-сосудистых заболеваний, растворения сгустков крови. В нашей стране разработан первый в мире препарат иммобилизованной стрептокина-зы, рекомендованный для лечения инфаркта миокарда. Калликреины – ферменты кининовой системы используются для снижения кровяного давления.
Важной и многообещающей областью энзимотерапии является применение ингибиторов ферментов. Так, естественные ингибиторы протеиназ (α1-трипсин, α1-химотрипсин, α-макроглобулин) нашли применение в терапии острых панкреатитов, артритов, аллергических заболеваний, при которых отмечается активация протеолиза и фибринолиза, сопровождающаяся образованием вазоактивных кининов.
Факторы, влияющие на активность ферментов: температура, рН среды, действие ингибиторов
Температура. Ферменты теряют активность при нагревании; при температуре от 50 до 60° С большинство ферментов быстро инактивируются. Инактивация ферментов необратима, так как после охлаждения активность не восстанавливается. Этим можно объяснить, почему непродолжительное воздействие высокой температуры убивает большинство организмов: часть их ферментов инактивируется и обмен веществ продолжаться не может.
Известно несколько исключений из этого правила. Некоторые виды примитивных растений — сине-зеленых водорослей — живут в горячих источниках, например в источниках Йеллоустонского национального парка, где температура воды достигает почти 100° С. Эти водоросли обусловливают яркую окраску травертиновых террас вокруг горячих источников. При температурах ниже той, при которой наступает инактивация ферментов (около 40° С), скорость большинства ферментативных реакций, как и скорость других химических реакций, примерно удваивается с повышением температуры на каждые 10° С.
Замораживание обычно не приводит к инактивации ферментов; при низких температурах ферментативные реакции идут очень медленно или не идут вовсе, но при повышении температуры до нормальной каталитическая активность возобновляется.
Кислотность. Ферменты чувствительны к изменениям pH, т. е. к изменению кислотности или щелочности среды. Пепсин — фермент, переваривающий белки, выделяемый слизистой оболочкой желудка, — замечателен тем, что он активен только в очень кислой среде и лучше всего действует при pH 2. Трипсин, расщепляющий белки и выделяемый поджелудочной железой, служит примером фермента, проявляющего оптимальную активность в щелочной среде, при pH около 8,5. Большинство внутриклеточных ферментов имеют оптимумы pH близ нейтральной точки, а в кислой или щелочной среде их активность значительно ниже; под действием сильных кислот и оснований они необратимо инактивируются.
Концентрация фермента, субстрата и кофакторов. Если pH и температура ферментной системы постоянны и субстрат имеется в избытке, скорость реакции прямо пропорциональна количеству фермента. Эту зависимость используют для определения содержания того или иного фермента в тканевом экстракте. При постоянстве pH, температуры и концентрации фермента в системе начальная скорость реакции возрастает вплоть до известного предела пропорционально количеству субстрата. Если ферментная система нуждается в каком-либо коферменте или специфическом ионе-активаторе, то концентрация этого вещества или иона может при определенных обстоятельствах определять общую скорость реакции.
Яды, отравляющие ферменты. Некоторые ферменты специфически чувствительны к определенным ядам: цианиду, иодуксусной кислоте, фториду, люизиту и т. д., и даже очень низкие концентрации этих ядов инактивируют ферменты. Цитохромоксидаза — один из ферментов системы переноса электронов — особенно чувствительна к цианиду; при отравлении цианидом смерть наступает вследствие инактивации ферментов, относящихся к группе цитохромов. Одну из ферментативных реакций, участвующих в расщеплении глюкозы, тормозит фторид, а другую — иодуксусная кислота; биохимики использовали такого рода ингибиторы для изучения свойств и последовательности действия множества различных ферментных систем.
Оказавшись в ненадлежащем месте, ферменты сами могут действовать как яды. Например, внутривенной инъекции 1 мг кристаллического трипсина достаточно для того, чтобы убить крысу. Действие различных ядов змей, пчел и скорпионов обусловлено тем, что эти яды содержат ферменты, разрушающие клетки крови или другие ткани.
1. обмен веществ - постоянно протекающий, самосовершающийся, саморегулирующий процесс обновления живых организмов.
Промежуточный обмен веществ иначе называют метаболизмом. Метаболизм - это совокупность всех химических реакций в клетке. Вещества, образующиеся в ходе химических реакций, принято называть метаболитами. Число химических реакций в клетках организма человека огромно, но следует подчеркнуть, что все реакции протекают согласованно. Цепи химических реакций образуют метаболические пути или циклы, каждый из которых выполняет определенную функцию.
В метаболизме принято выделять два противоположных процесса - катаболизм и анаболизм.
Катаболизм (в переводе с греческого - вниз) - это процессы распада сложных органических соединений до простых, сопровождающиеся выделением энергии. Анаболизм (в переводе с греческого - вверх) - процессы синтеза сложных молекул из более простых, сопровождающиеся потреблением энергии. энергия затрачивается и синтезируются белки, жиры, нуклеиновые кислоты и сахара.
Катаболизм сопровождается освобождением энергии, которая может аккумулироваться в виде АТФ. При анаболических процессах происходит потребление энергии, которая освобождается при распаде АТФ до АДФ и фосфорной кислоты или АМФ и пирофосфорной кислоты. Следовательно, АТФ является сопрягающим энергетическим звеном катаболизма и анаболизма. Кроме АТФ связующим звеном могут служить специфические метаболические пути или циклы. Связующий путь (цикл), объединяющий пути распада и синтеза веществ, называется амфиболическим. Примером амфиболического цикла может служить цикл Кребса. Амфиболические пути связаны, как правило, с окислением веществ до углекислого газа и воды.
Этапы обмена веществ
Для возмещения энергозатрат организма, сохранения массы тела и удовлетворения потребностей роста необходимо поступление из внешней среды белков, жиров и углеводов, витаминов, минеральных солей, воды. Их количество, свойства и соотношение должны соответствовать состоянию организма и условиям его существования.
Обмен веществ начинается с поступления питательных веществ в желудочно-кишечный тракт и воздуха в легкие.
Первым этапом обмена веществ являются ферментативные процессы расщепления белков, жиров и углеводов до растворимых в воде аминокислот, моно- и дисахаридов, глицерина, жирных кислот и других соединений. Данный этап также связан с всасыванием этих веществ в кровь и лимфу.
Вторым этапом обмена является химические реакции синтеза ферментов, гормонов, составных частей цитоплазмы и выделение энергии.
Третьим этапом является удаление конечных продуктов распада и выведение их почками, легкими, потовыми железами и кишечником.
Превращение белков, жиров, углеводов, минеральных веществ и воды происходит в тесном взаимодействии друг с другом. При этом в метаболизме каждого из них имеются свои особенности, а физиологическое значение их различно.
Цикл Кребса
Биологический смысл цикла заключается в расщеплении пировиноградной кислоты до двуокиси углерода и извлечение из нее энергии. Все ферменты цикла Кребса локализованы в митохондриях, в их внутреннем межмембранном пространстве, которое заполнено матриксом – полужидким белковым веществом.
реакции цикла Кребса выполняют следующие функции:
1) Энергетическую.
2) Интегративную (объединяют распад углеводов, белков и липидов).
3) Пластическую (кислоты цикла Кребса являются важными метаболитами, участвующими во многих биохимических реакциях).
В цикле Кребса образуется:
3 молекулы НАДН (реакции 3, 4, 8) следовательно, в цепи передачи электронов синтезируется 3х3=9 молекул АТФ;
1 молекула ФАДН2(реакция 6) - 2 молекулы АТФ в дыхательной цепи;
1 молекула АТФ из ГТФ (реакция 5) в результате реакции перефосфорилирования;
ИТОГО: 9 АТФ + 2 АТФ + 1 АТФ = 12 АТФ.
Образовавшийся в результате окислительного декарбоксилирования пирувата в митохондриях ацетил-КоА вступает в цикл Кребса. Данный цикл происходит в матриксе митохондрий и состоит из восьми последовательных реакций. Начинается цикл с присоединения ацетил-КоА к оксалоацетату и образования лимонной кислоты (цитрата). Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований (отнятие водорода) и двух декарбоксилирований (отщепление СО2) теряет два углеродных атома и снова в цикле Кребса превращается в оксалоацетат (четырехуглеродное соединение), т.е. в результате полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула окса-лоацетата регенерируется. Рассмотрим все восемь последовательных реакций (этапов) цикла Кребса.

Рис. 10.9. Цикл трикарбоновых кислот (цикл Кребса).
Первая реакция катализируется ферментом цитратсинтазой, при этом ацетильная группа ацетил-КоА конденсируется с оксалоацетатом, в результате чего образуется лимонная кислота:

По-видимому, в данной реакции в качестве промежуточного продукта образуется связанный с ферментом цитрил-КоА. Затем последний самопроизвольно и необратимо гидролизуется с образованием цитрата и HS-KoA.
В результате второй реакции образовавшаяся лимонная кислота подвергается дегидратированию с образованием цис-аконитовой кислоты, которая, присоединяя молекулу воды, переходит в изолимонную кислоту (изоцитрат). Катализирует эти обратимые реакции гидратации–дегидратации фермент аконитатгидратаза (аконитаза). В результате происходит взаимоперемещение Н и ОН в молекуле цитрата:

Третья реакция, по-видимому, лимитирует скорость цикла Кребса. Изолимонная кислота дегидрируется в присутствии НАД-зависимой изоцитратдегидрогеназы.

В ходе изоцитратдегидрогеназной реакции изолимонная кислота одновременно декарбоксилируется. НАД-зависимая изоцитратдегидрогеназа является аллостерическим ферментом, которому в качестве специфического активатора необходим АДФ. Кроме того, фермент для проявления своей активности нуждается в ионах Mg2+или Мn2+.
Во время четвертой реакции происходит окислительное декарбокси-лирование α-кетоглутаровой кислоты с образованием высокоэнергетического соединения сукцинил-КоА. Механизм этой реакции сходен с таковым реакцииокислительного декарбоксилирования пирувата до ацетил-КоА, α-кетоглутаратдегидрогеназный комплекс напоминает по своей структуре пируватдегидрогеназный комплекс. Как в одном, так и в другом случае в реакциипринимают участие 5 коферментов: ТПФ, амид липоевой кислоты, HS-KoA, ФАД и НАД+.

Пятая реакция катализируется ферментом сукцинил-КоА-синтета-зой. В ходе этой реакции сукцинил-КоА при участии ГТФ и неорганического фосфата превращается в янтарную кислоту (сукцинат). Одновременно происходит образование высокоэргической фосфатной связи ГТФ за счет высокоэргической тиоэфирной связи сукцинил-КоА:
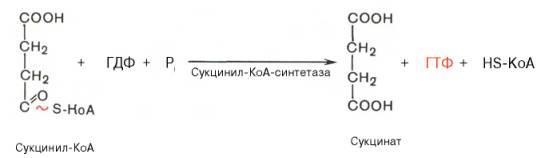
В результате шестой реакции сукцинат дегидрируется в фумаровую кислоту. Окисление сукцината катализируется сукцинатдегидрогеназой, в молекуле которой с белком прочно (ковалентно) связан кофермент ФАД. В свою очередь сукцинатдегидрогеназа прочно связана с внутренней ми-тохондриальной мембраной:
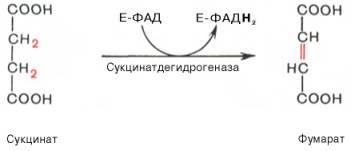
Седьмая реакция осуществляется под влиянием фермента фума-ратгидратазы (фумаразы). Образовавшаяся при этом фумаровая кислота гидратируется, продуктом реакции является яблочная кислота (малат). Следует отметить, что фумаратгидратаза обладает стереоспецифичностью (см. главу 4) – в ходе реакции образуется L-яблочная кислота:

Наконец, в ходе восьмой реакции цикла трикарбоновых кислот под влиянием митохондриальной НАД-зависимой малатдегидрогеназы происходит окисление L-малата в оксалоацетат:

Как видно, за один оборот цикла, состоящего из восьми ферментативных реакций, происходит полное окисление(«сгорание») одной молекулы ацетил-КоА. Для непрерывной работы цикла необходимо постоянное поступление в систему ацетил-КоА, а коферменты (НАД+ и ФАД), перешедшие в восстановленное состояние, должны снова и снова окисляться. Это окисление осуществляется в системе переносчиков электронов в дыхательной цепи (в цепи дыхательных ферментов), локализованной в мембране митохондрий. Образовавшийся ФАДН2 прочно связан с СДГ, поэтому он передает атомы водорода через KoQ. Освобождающаяся в результате окисления ацетил-КоА энергия в значительной мере сосредоточивается в макроэргических фосфатных связях АТФ. Из 4 пар атомов водорода 3 пары переносят НАДН на систему транспорта электронов; при этом в расчете на каждую пару в системе биологического окисления образуется 3 молекулы АТФ (в процессе сопряженного окислительного фосфорилирования), а всего, следовательно, 9 молекул АТФ.
Одна пара атомов от сукцинатдегидрогеназы-ФАДН2 попадает в систему транспорта электронов через KoQ, в результате образуется только 2 молекулы АТФ. В ходе цикла Кребса синтезируется также одна молекула ГТФ (субстратное фосфорилирование), что равносильно одной молекуле АТФ. Итак, при окислении одной молекулы ацетил-КоА в цикле Кребса и системе окислительного фосфорилированияможет образоваться 12 молекул АТФ.
Если подсчитать полный энергетический эффект гликолитического расщепления глюкозы и последующего окислениядвух образовавшихся молекул пирувата до СО2 и Н2О, то он окажется значительно большим.
Как отмечалось, одна молекула НАДН (3 молекулы АТФ) образуется при окислительном декарбоксилировании пирувата в ацетил-КоА. При расщеплении одной молекулы глюкозы образуется 2 молекулы пирувата, а при окислении их до 2 молекул ацетил-КоА и последующих 2 оборотов цикла трикарбоновых кислот синтезируется 30молекул АТФ (следовательно, окисление молекулы пирувата до СО2 и Н2О дает 15 молекул АТФ). К этому количеству надо добавить 2 молекулы АТФ, образующиеся при аэробном гликолизе, и 6 молекул АТФ, синтезирующихся за счет окисления 2 молекул внемитохондриального НАДН, которые образуются при окислении 2 молекул глицеральдегид-3-фосфата в дегидрогеназной реакции гликолиза. Следовательно, при расщеплении в тканях одной молекулы глюкозы по уравнению С6Н12О6 + 6О2 —> 6СО2 + 6Н2О синтезируется 38 молекул АТФ. Несомненно, что в энергетическом отношении полное расщепление глюкозы является более эффективным процессом, чем анаэробный гликолиз.
Необходимо
отметить, что образовавшиеся в процессе
превращения глицеральдегид-3-фосфата
2 молекулы НАДН
в дальнейшем при окислении могут
давать не 6 молекул АТФ,
а только 4. Дело в том, что
сами молекулывнемитохондриального
НАДН не способны проникать через
мембрану
внутрь митохондрий.
Однако отдаваемые ими электроны могут
включаться в митохондриальную цепь
биологического окисления с
помощью так называемого глицеролфосфатного
челночного механизма (рис. 10.10).
Цитоплазматический НАДН сначала
реагирует с цитоплазматическим
ди-гидроксиацетонфосфатом, образуя
глицерол-3-фосфат.

Рис. 10.10. Глицеролфосфатный челночный механизм. Объяснение в тексте.
Реакция катализируется НАД-зависимой цитоплазматической глицерол-3-фосфат-дегидроге-назой:
Дигидроксиацетонфосфат + НАДН + Н+ <=> Глицерол-3-фосфат + НАД+.
Образовавшийся глицерол-3-фосфат легко проникает через митохонд-риальную мембрану. Внутри митохондриидругая (митохондриальная) глицерол-3-фосфат-дегидрогеназа (флавиновый фермент) снова окисляет глицерол-3-фосфат до диоксиацетонфосфата:
Глицерол-3-фосфат + ФАД <=> Диоксиацетонфосфат + ФАДН2.
Восстановленный флавопротеин (фермент-ФАДН2) вводит на уровне KoQ приобретенные им электроны в цепь биологического окисления и сопряженного с ним окислительного фосфорилирования, а диоксиацетонфосфат выходит из митохондрий в цитоплазму и может вновь взаимодействовать с цитоплазматическим НАДН + Н+. Таким образом, пара электронов (из одной молекулы цитоплазматического НАДН + Н+), вводимая в дыхательную цепь с помощью глицеролфосфатного челночного механизма, дает не 3, а 2 АТФ.

Рис. 10.11. Малат-аспартатная челночная система для переноса восстанавливающих эквивалентов от цитозольного НАДН в митохондриальный матрикс. Объяснение в тексте.
В дальнейшем было показано, что с помощью данного челночного механизма лишь в скелетных мышцах и мозге осуществляется перенос восстановленных эквивалентов от цитозольного НАДН + Н+ в митохондрии.
В клетках печени, почек и сердца действует более сложная малат-ас-партатная челночная система. Действие такого челночного механизма становится возможным благодаря присутствию малатдегидрогеназы и ас-партатаминотрансферазы как в цитозоле, так и в митохондриях.
Установлено, что от цитозольного НАДН + Н+ восстановленные эквиваленты сначала при участии ферментамалатдегидрогеназы (рис. 10.11) переносятся на цитозольный оксалоацетат. В результате образуется малат, который с помощью системы, транспортирующей дикарбоновые кислоты, проходит через внутреннюю мембранумитохондрии в матрикс. Здесь малат окисляется в оксалоацетат, а матриксный НАД+ восстанавливается в НАДН + Н+, который может теперь передавать свои электроны в цепь дыхательных ферментов, локализованную на внутренней мембране митохондрии. В свою очередь образовавшийся оксалоацетат в присутствии глутамата и фермента АсАТ вступает в реакцию трансаминирования. Образующиеся аспарат и α-кетоглутарат с помощью специальных транспортных систем способны проходить через мембрану митохондрий.
Транспортирование в цитозоле регенерирует оксалоацетат, что вызывает к действию следующий цикл. В целом процесс включает легкообратимые реакции, происходит без потребления энергии, «движущей силой» его является постоянное восстановление НАД+ в цитозоле глицеральдегид-3-фосфатом, образующимся при катаболизме глюкозы.
Итак, если функционирует малат-аспартатный механизм, то в результате полного окисления одной молекулы глюкозы может образоваться не 36, а 38 молекул АТФ.
