
- •2. Строение ферментов
- •3. Множественные формы ферментов.
- •6. Механизм действия ферментов
- •1. Роль металлов в присоединении субстрата в активном центре фермента
- •2. Роль металлов в стабилизации третичной и четвертичной структуры фермента
- •3. Роль металлов в ферментативном катализе
- •4. Роль металлов в регуляции активности ферментов
- •8. Основы кинетики ферментативных реакций
- •Регуляция активности ферментов
- •1. Доступность субстрата или кофермента
- •2. Компартментализация
- •3. Генетическая регуляция
- •4. Ограниченный (частичный) протеолиз проферментов
- •5. Аллостерическая регуляция
- •6. Белок-белковое взаимодействие
- •7. Ковалентная (химическая) модификация
- •12. Применение ферментов в медицине
- •Основная роль цтк заключается в
- •5. Анаболизм
- •Катаболизм
- •Моносахариды
- •2. Олигосахариды
- •3. Полисахариды или полиозы
- •Эпидемиология галактоземии
- •Чем вызывается галактоземия?
- •Симптомы галактоземии
- •Дефицит галактозо-1-фосфатуридилтрансферазы
- •Дефицит галактокиназы
- •Дефицит уридилдифосфат-галактозо-4-эпимеразы
- •Классификация галактоземии
- •Диагностика галактоземии
- •Гликоген печени. Концентрация глюкозы в крови
- •Регуляция концентрации глюкозы в крови
- •8. Гипергликемия
- •9. Нарушения регуляции углеводного обмена
- •10. Гликолиз
- •Распад гликогена (гликогенолиз)
- •1. Этапы аэробного гликолиза
- •2. Реакции аэробного гликолиза
- •3. Окисление цитоплазматического nadh в митохондриалъной дыхательной цепи. Челночные системы
- •4. Баланс атф при аэробном гликолизе и распаде глюкозы до со2 и н2о
- •14. Переключение между аэробным и анаэробным окислением происходит автоматически
- •Эффект Пастера
- •15. Глюконеогенез
- •17. Пентозофосфатный путь окисления углеводов
Ферменты 1. ПОНЯТИЕ О ФЕРМЕНТАХ
Ферменты (энзимы) биологические катализаторы белковой природы, которые синтезируются в клетках живых орагнизмов и используются живыми организмами для многих взаимосвязанных химических реакций, включая синтез, распад и взаимопревращение огромного множества разнообразных химических соединений. Жизнь и многообразие ее проявлений – сложная совокупность химических реакций, катализируемых специфическими ферментами.
Осн. функции ферментов- ускорять превращение веществ, поступающих в организм и образующихся при метаболизме (для обновления клеточных структур, для обеспечения его энергией и др.), а также регулировать биохимические процессы (например реализацию генетической информации), в т. ч. в ответ на изменяющиеся условия.
От неорганических катализаторов ферменты отличаются рядом характерных особенностей.
1. Прежде всего ферменты чрезвычайно эффективны, то есть скорость ферментативных реакций выше, чем реакций, катализируемых неорганическими катализаторами в условиях умеренной температуры (температура тела), нормального давления и в области близких к нейтральным значениям рН среды.
2. Ферменты по своей химической природе белки, катализаторы - неорганика. Ферменты подвержены регуляции (есть активаторы и ингибиторы ферментов) , неорганические катализаторы работают нерегулируемо.
3. Ферментативные реакции протекают только в физиологических условиях, т. к. работают внутри клеток, тканей и организма (это определенные значения температуры, давления и рН).
4. Ферменты – высокомолекулярные белковые тела, они довольно специфичны. Ферменты способны катализировать всего лишь один-единственный тип реакции. Они являются катализаторами биохимических реакций. Неорганические катализаторы ускоряют разные реакции.
5. Ферменты могут действовать в конкретном узком температурном интервале, определенном давлении и кислотности среды.
6. Ферментативные реакции обладают высокой скоростью.
Свойства ферментов.
1. Ферменты отличаются высокой специфичностью (избирательностью) действия в отношении как химической природы субстрата, так и типа реакции, т.е. каждый фермент катализирует в основном только определенную химическую реакцию.
2. Для каждого фермента характерны специфическая последовательность расположения аминокислотных остатков и пространственная конформация.
3. Существенной особенностью ферментовявляется также то, что их активность в клетках строго контролируется как на генетическом уровне, так и посредством определенных низкомолекулярных соединений, в частности субстратов и продуктов реакций, катализируемых этими же ферментами, ингибиторов и др. Таким образом, молекула фермента характеризуется уникальностью структуры, которая и определяет уникальность ее функции.
4. Ферменты повышают свойства химических реакций, но не входят в состав их продуктов.
5. Ферменты не смещают положение равновесия, а лишь ускоряют его.
6. Ферменты ускоряют как прямую, так и обратную реакцию.
7. Ферментативная активность зависит от температуры (повыш. в 2-4 р на каждые 10 С) рН - среды.
8.Активность ферментов может меняться под влиянием хим. соединений: активаторов (ускоряют) или ингибиторов (замедляют).
9. Ферменты обеспечивают протекание только тех реакций, которые возможны согласно закону термодинамики.
2. Строение ферментов
Ферменты бывают простые и сложные. Простые (однокомпонентные) представлены только белковой частью и при гидролизе распадаются исключительно на аминокислоты. Такими ферментами (простые белки) являются гидролитические ферменты, в частности пепсин, трипсин, папаин, уреаза, лизоцим, рибонуклеаза, фосфатаза и др.
Большинство природных ферментов относится к классу сложных белков (двухкомпонентные), они содержатв своем составе белковую часть (апофермент) и какую-либо небелковую часть (кофермент), присутствие которого является абсолютно необходимым для каталитической активности. Кофакторы могут иметь различную химическую природу и различаться по прочности связи с полипептидной цепью.
Полипептидную (белковую) часть фермента принято называть апоферментом.
Предполагают, что простетическая группа может быть связана с белком ковалентными и не ковалентными связями. Так, в молекуле ацетилкоэнзим-А-карбоксилазы кофактор биотин ковалентно связан с апоферментом посредством амидной связи. С другой стороны, химические связи между кофакторами и пептидными цепями могут быть относительно слабыми (например, водородные связи, электростатические взаимодействия и др.).
Роль кофермента (Ко) в качестве переносчика, например, атомов водорода может быть представлена в виде схемы, где SH – субстрат, КоЕ – холофермент, А – акцептор протона:
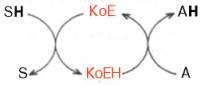
Субстрат подвергается окислению, отдавая электроны и протоны, а КоЕ – восстановлению, принимаяэлектроны и протоны. В следующей полуреакции восстановленный КоЕН может отдавать электроны и протоны на какой-либо другой промежуточный переносчик электронов и протонов или на конечный акцептор.
Следует отметить одну отличительную особенность двухкомпонентных ферментов: ни кофактор отдельно (включая большинство коферментов), ни сам по себе апофермент каталитической активностью не наделены, и только их объединение в одно целое, протекающее не хаотично, а в соответствии с программой их структурной организации, обеспечивает быстрое протекание химической реакции.
Разнообразие ферментов. Огромное разнообразие химических реакций, протекающих в клетках всех организмов. Ускорение каждой химической реакции особым ферментом. Тысячи химических реакций в клетке, их ускорение несколькими тысячами различных ферментов. Так, каждую реакцию обмена веществ катализирует своя группа ферментов: многочисленные реакции пластического обмена — одна группа ферментов, а реакции энергетического обмена — другая группа ферментов.
Специфичность ферментов.
Ферменты обладают высокой специфичностью действия. Это свойство часто существенно отличает их от неорганических катализаторов. Так, мелкоизмельченные платина и палладий могут катализировать восстановление (с участием молекулярного водорода) десятков тысяч химических соединений различной структуры. Высокая специфичность ферментов обусловлена, как было отмечено, конформационной и электростатической комплементарностью между молекулами субстрата и фермента и уникальной структурной организацией активного центра, обеспечивающими «узнавание», высокое сродство и избирательность протекания одной какой-либо реакции из тысячи других химических реакций, осуществляющихся одновременно в живых клетках.
В зависимости от механизма действия различают ферменты с относительной (или групповой) и абсолютной специфичностью. Так, для действия некоторых гидролитических ферментов наибольшее значение имеет тип химической связи в молекуле субстрата. Например, пепсин в одинаковой степени расщепляет белки животного и растительного происхождения, несмотря на то что эти белки существенно отличаются друг от друга как по химическому строению и аминокислотному составу, так и по физико-химическим свойствам. Однако пепсин не расщепляет ни углеводы, ни жиры. Объясняется это тем, что точкой приложения, местом действия пепсина является пептидная —СО—NH-связь.
Абсолютной специфичностью действия называют способность фермента катализировать превращение только единственного субстрата. Любые изменения (модификации) в структуре субстрата делают его недоступным для действия фермента. Примерами таких ферментов могут служить аргиназа, расщепляющая в естественных условиях (в организме) аргинин, уреаза, катализирующая распад мочевины, и др.
Под активным центром подразумевают уникальную комбинацию аминокислотных остатков в молекуле фермента, обеспечивающую непосредственное связывание ее с молекулой субстрата и прямое участие в акте катализа. Установлено, что у сложных ферментов в состав активного центра входят также простетические группы.
Структура активного центра:
1. участок, связывающий субстрат (с помощью водородных или дипольных взаимодействий)
2. каталитически активный участок (в состав входят хим группы, которые берут участие в превращении субстрата)
Помимо активного центра, в молекуле фермента может присутствовать также аллостерический центр (или центры) представляющий собой участок молекулы фермента, с которым связываются определенные, обычно низкомолекулярные, вещества (эффекторы, или модификаторы), молекулы которых отличаются по структуре от субстратов. Присоединение эффектора к аллостерическому центру изменяет третичную и часто также четвертичную структуру молекулы фермента и соответственно конфигурацию активного центра, вызывая снижение или повышение энзиматической активности. Ферменты, активность каталитического центра которых подвергается изменению под влиянием аллостерических эффекторов, связывающихся с аллостерическим центром, получили название аллостерических ферментов.
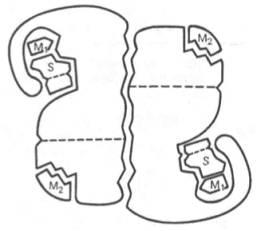
Рис. 4.4. Схематическое изображение аллостерического фермента, состоящего из двух протомеров, соединенных по типу гетерологической («голова»-«хвост») ассоциации (по Кошленду). S – субстрат; М1 – модификатор, связывающийся в активном центре; М2 – модификатор, связывающийся в аллосте-рическом центре (эффектор).
