
- •Исследование физико-химических свойств слюны
- •Содержание
- •Слюна и ротовая жидкость
- •1.1. Роль слюны, ее состав, физико-химические свойства, функции (краткий литературный обзор)
- •1.2. Анамнез (возраст, характер питания, тип питьевой воды, гигиена полости рта: сгпр, индекс кпу: кариес, пломба, удаление)
- •1.3. Определение скорости саливации.
- •1.4. Определение рН слюны
- •1.5. Определение буферной емкости слюны
- •2.1. Метод трилонометрии
- •2.2. Метод потенциометрии
- •3.1. Определение вязкости слюны
- •3.2. Определение поверхностного натяжения слюны
- •3.3. Оценка минеразлизующего потенциала слюны
- •3.4.Определение порога коагуляции электролита методом спектрофотометрии
- •3.5. Определение белка в слюне спектрометрическим методом
- •Этап 4 Оформление результатов исследовательской работы и защита
1.5. Определение буферной емкости слюны
Буферная емкость слюны – это количественная характеристика буферного действия тех буферных систем, которые играют защитную роль в полости рта и функционируют по принципу саморегуляции. Высокая буферная емкость слюны относится к числу факторов, повышающих резистентность зубов к кариесу.
В норме буферная емкость по кислоте составляет Вк = 8,21 ± 0,51 ммоль экв/л, а по основанию Вос. = 47,52 ± 0,40 ммоль экв/л.
Ход определения:
Предварительно определите рН слюны на рН-метре. Запишите показание прибора в таблицу 1.5.
Таблица 1.5
Результаты определения буферной емкости слюны
№ слюны |
рН слюны |
рН слюны |
∆рН |
В, моль экв/л |
|
После добавления НС1 |
После добавления NaOH |
||||
|
|
|
|
|
|
|
|
|
|
|
|
Затем к 10 мл слюны добавьте 1 мл раствора НС1 с концентрацией СЭ = 0,01 моль экв/л и вновь измерьте рН.
К другой порции слюны (10 мл) добавьте 1 мл раствора NaOH СЭ = 0,01 моль экв/л и измерьте рН. По скачку рН (∆рН) рассчитайте буферную емкость слюны по кислоте и по основанию.
Сравните полученные значения с нормой.
Сделайте вывод.
Покажите механизм буферного действия на примере тех буферных систем, которые функционируют в среде полости рта.
Этап 2
Определение содержания ионов Са2+ и Mg2+ в слюне
Общее содержание ионов кальция в слюне колеблется от 0,046 до 0,049 г/л, что соответствует 1,15-1,22 ммоль/л. При этом около 15 % кальция связано с белками, ~35 % связано в комплексы фосфатные, цитратные и др. и до 50 % кальция содержится в ионизированном состоянии. Именно этот ионизированный кальций участвует в процессах минерализации эмали и, наряду с гидрофосфатными ионами, поддерживает гетерогенное равновесие «слюна ↔ эмаль зуба». При развивающемся кариесе снижается содержание ионов кальция в слюне, что понижает ее насыщаемость, и указанное равновесие смещается в сторону процессов деминерализации. Ионы магния являются активаторами процесса минерализации эмали.
Количественное содержание ионов кальция и магния в слюне можно экспериментально определить методом комплексонометрического титрования (метод трилонометрии). Содержание ионов кальция можно также определить методом прямой потенциометрии с использованием Са2+-селективного электрода в качестве электрода определения.
2.1. Метод трилонометрии
Методом трилонометрии можно определить содержание не только ионов Са2+, но и ионов Mg2+, которые также имеются в составе слюны от 0,1 до 0,5 ммоль/л.
В основе метода лежит реакция образования прочного комплекса иона Са2+ или Mg2+ с трилоном Б (двунатриевая соль этилендиаминтетрауксусной кислоты) при рН = 8-10, создаваемом с помощью аммиачного буферного раствора.
Для фиксации наступления состояния эквивалентности используют металл-индикатор хромоген черный, который может образовывать непрочный комплекс с ионом определяемого металла. Индикатор представляет собой слабый электролит, ионизирующий по-разному в зависимости от рН раствора:
H3V ↔ H2V- + H+ (винно-красный) ↔ HV2- + 2H+ (синий) ↔ V3- + 3H+ (оранжевый)
рН< 6 pH=6 pH=7-11 pH=11,5
При рН = 9,5-10 комплекс Са2+ с индикатором имеет винно-красную окраску:
Са2+ (синий) + HV2- → СаV- (винно-красный) + H+
П![]() ри
титровании трилоном Б в точке
эквивалентности наблюдается полный
переход металла из непрочного комплекса
с индикатором в более прочный комплекс
с трилоном Б (бесцветным), и винно-красная
окраска меняется на синюю:
ри
титровании трилоном Б в точке
эквивалентности наблюдается полный
переход металла из непрочного комплекса
с индикатором в более прочный комплекс
с трилоном Б (бесцветным), и винно-красная
окраска меняется на синюю:
СаV- + Na2H2Y Na2СаY + HV2- + H+
винно-красн. б/цветн. б/цветн. синяя
и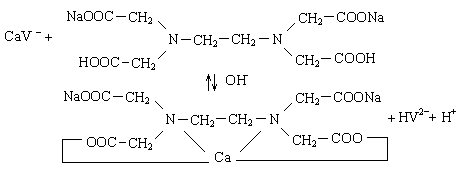 ли:
ли:
Ход определения:
Предварительно проведите определение ионов Са2+ и Mg2+ в контрольном растворе (получить у преподавателя) по указанной методике.
Для определения суммарного содержания
ионов Са2+ и Mg2+
в коническую колбу с помощью пипетки
отмерьте 10,0 мл исследуемой слюны.
Добавьте 5 мл буферного раствора мерной
пробиркой и несколько кристалликов
индикатора. Исследуемый раствор
приобретает винно-красную окраску.
Титруйте из бюретки трилоном Б до
перехода винно–красной окраски в синюю.
Показания бюретки отметьте с точностью
до 0,1 мл. Титрование повторите до получения
двух результатов, отличающихся не более
чем на 0,1 ± 0,2 мл. По
![]() рассчитайте
содержание ионов Са2+ и Mg2+
в слюне, ммоль/л. СЭтрилона
= 0,01 моль экв/л. Результаты титрования
занесите в табл. 2.1.
рассчитайте
содержание ионов Са2+ и Mg2+
в слюне, ммоль/л. СЭтрилона
= 0,01 моль экв/л. Результаты титрования
занесите в табл. 2.1.
Для определения содержания только ионов Са2+ также в коническую колбу отмерьте пипеткой 10,0 мл исследуемой слюны, добавьте 1 мл раствора NaOH (CЭ = 1 моль экв/л), выдержите не менее 5 мин. Затем добавьте 5 мл буферного раствора и несколько кристалликов индикатора мурексида. Исследуемый раствор приобретает ярко розовую окраску. Титруйте из бюретки трилоном Б до перехода окраски в фиолетовую. Показания бюретки занесите в таблицу 2.1. Опыт повторите дважды. По среднему объему трилона Б, пошедшего на титрование, рассчитайте содержание ионов Са2+ в слюне.
По разности в объемах трилона Б рассчитайте содержание ионов Mg2+ в слюне. Все полученные данные также занесите в таблицу 2.1.
Таблица 2.1
Результаты трилонометрического определения содержания ионов кальция и магния в слюне
№ опыта |
Vслюны, мл |
Vтрилона, мл |
мл |
мл |
Относит. ошибка
|
Содержание, ммоль/л |
|||
Mg2+ и Са2+ |
Са2+ |
Mg2+ |
|||||||
Mg2+ и Са2+ |
Са2+ |
||||||||
1 |
10,0 |
|
|
|
|
|
|
|
|
2 |
10,0 |
|
|
|
|
|
|
|
|
